肥大细胞糜蛋白酶在瘢痕疙瘩组织的活性表达
通信作者:董祥林,男,博士,副主任医师,副教授,硕士生导师,研究方向:创面修复与瘢痕修复,E-mail:dongxianglin8@126.com。
肥大细胞糜蛋白酶在瘢痕疙瘩组织的活性表达
徐涛, 董祥林
(新疆医科大学第一附属医院烧伤整形科, 乌鲁木齐830054)
摘要:目的探讨肥大细胞糜蛋白酶在人瘢痕疙瘩组织中的表达活性。方法采用免疫组织化学法检测瘢痕疙瘩组织和正常皮肤中肥大细胞的数量和糜蛋白酶的表达,并以RT-PCR和放免法检测瘢痕疙瘩和正常皮肤组织中糜蛋白酶mRNA表达活性变化。结果瘢痕疙瘩组织中肥大细胞数量与糜蛋白酶阳性表达评分为(10±0.25)个/HP、(6.2±0.23) mm2,明显高于正常皮肤组织的(4±0.22)个/HP、(2.5±0.12)mm2 (P<0.01);RT-PCR结果显示瘢痕疙瘩组织中肥大细胞mRNA和糜蛋白酶mRNA表达水平较正常皮肤组织明显增高。结论肥大细胞糜蛋白酶存在于瘢痕疙瘩中且活性表达明显高于正常皮肤组织。
关键词:肥大细胞糜蛋白酶; 瘢痕疙瘩; 活性表达
基金项目:新疆医科大学第一附属医院青年科研基金(2012QN02)
作者简介:徐涛(1978-),男,在读硕士,研究方向:瘢痕与修复。
中图分类号:R34
doi:10.3969/j.issn.1009-5551.2015.03.013
[收稿日期:2014-09-14]
The expression of mast cells chymase activity in keloid tissue
XU Tao, DONG Xianglin
(DepartmentofBurnsandPlasticSurgery,TheFirstAffiliatedHospitalof
XinjiangMedicalUniversity,Urumqi830054,China)
Abstract:ObjectiveTo explore the expressed activity of mast cells chymase exist in human keloid tissues. MethodsThe number of mast cell and chymase expression in keloid and normal skin were assessed by immunohistochemical methods. Quantitative real-time PCR and Radio immunity method were conducted to measure the change of mRNA expressed activity of chymase in keloid and normal skin tissues. ResultsCompared with normal skin tissue, the number of mast cells and chymase expression were higher in keloid tissues [(10±0.25)/hp vs (4±0.22)/hp, and (6.2±0.23) mm2 vs (2.5±0.12) mm2, P<0.01)]. The results of RT-PCR showed mast cell mRNA expression levels and chymase mRNA level were also significantly higher in keloid tissues than those of normal skin tissues (P<0.05). ConclusionThe chymase of mast cells exists in keloids and the expressed activity of chymase is statistically higher than those of normal skin tissues.
Key words: keloid; mast cells chymase; activity
瘢痕疙瘩是一种慢性炎症性纤维化疾病,其与众不同的组织学特征就是异常增多的细胞外基质、局部包括肥大细胞在内的炎症细胞浸润以及大量的细胞因子聚集[1]。瘢痕疙瘩的炎症部分常表现颜色发红、血管过度增生和高渗透性伴有包括肥大细胞和巨噬细胞的高浸润炎症细胞[2]。肥大细胞不仅被认为是皮肤过敏性炎症反应的主要细胞,而且在皮肤伤口异常愈合过程中其数量和质量发生了明显变化[3],表明肥大细胞与其他介质在病理性瘢痕发病中发挥了重要的作用[4]。
目前关于肥大细胞在瘢痕疙瘩的发病中起何作用还不清楚。但是肥大细胞活化后脱颗粒释放组胺、肝素和各种酶类如糜蛋白酶、胰凝乳蛋白酶、组织蛋白酶G和羟基肽酶A等[5], 在这些中性蛋白酶中,糜蛋白酶与组织纤维化密切相关。糜蛋白酶是α-糜蛋白酶-丝氨酸类蛋白酶(CLP),最初发现存在于肥大细胞,后来发现也存在于人的心脏和血管组织中[6]。糜蛋白酶涉及许多生理和病理生理过程,糜蛋白酶最重要的功能之一就是调节AngII的生成,已经被证实人的心脏糜蛋白酶是一种主要的非ACE的AngII形成酶。此外糜蛋白酶可促进心肌、皮肤等成纤维细胞增殖[7-8];促使细胞外基质绑定的TGF-β1释放[9];使溶胶原蛋白降解而参予组织塑形;并且参与炎症反应[10]。免疫组化显示CD117(C-Kit)是肥大细胞表面调控其功能的重要受体[11-12],其强烈的膜染色被认为存在于正常肥大细胞和所有肥大细胞疾病的肥大细胞上,主要分布在纤维化增生区,在表皮也可见糜蛋白酶标记的肥大细胞[13]。可见肥大细胞以及糜蛋白酶均存在于瘢痕疙瘩组织中且肥大细胞于瘢痕疙瘩中激活脱颗粒释放糜蛋白酶,发挥着活性作用。
来源于肥大细胞的糜蛋白酶与组织纤维化密切相关,研究表明肥大细胞存在于瘢痕疙瘩中且与其他介质在瘢痕疙瘩的形成中可能起到作用[4]。本研究通过对比研究正常皮肤和瘢痕疙瘩组织中肥大细胞糜蛋白酶基因和活性表达,探讨其是否存在于瘢痕疙瘩中及其活性表达情况,为进一步研究其在瘢痕疙瘩中的作用提供依据。
1材料与方法
1.1实验标本新鲜的瘢痕疙瘩和正常皮肤的组织标本来自于2011年10月-2012年9月在新疆医科大学第一附属医院整形外科因瘢痕疙瘩手术切除的瘢痕组织标本和其他手术的患者。其中瘢痕疙瘩10例,男性4例,女性6例;瘢痕部位:胸前4例,肩部3例,手腕部1例,耳垂2例。用于对照的正常皮肤10例,男性6例,女性4例;取自腋臭、痣行手术切除的皮肤组织,瘢痕切除后体表畸形需要修复重建的患者。由2名进行修复重建的整形外科医生选择患者。患者手术前均未使用激素及免疫抑制剂治疗,局部亦未行放射治疗。标本离体后分为两部分:一部分立即液氮转移至-70℃冰箱保存;另一部分立即行多聚甲醛固定,梯度酒精脱水,二甲苯透明,浸蜡包埋、制片。所用器械、容器均经清洁后采用0.1% DEPC水处理,并高压消毒。
本研究经过新疆医科大学第一附属医院伦理委员会同意并和受试者签署了知情同意书。每个瘢痕疙瘩组织都被切取一小块送病理实验室进行组织化学检查以进一步确认临床诊断的正确性。
1.2主要试剂多克隆兔抗人CD117(C-Kit)抗体、鼠抗糜蛋白酶多克隆抗体(购自Gene Company Limited 基因有限公司),逆转录试剂盒,实时定量PCR试剂盒(购自美国Bio-Rad公司),放免试剂盒(购自北京北方生物技术研究所)。
1.3方法
1.3.1肥大细胞和肥大细胞糜蛋白酶免疫组化和肥大细胞糜蛋白酶化染色肥大细胞和肥大细胞糜蛋白酶染色分别采用多克隆兔抗人CD117(C-Kit)抗体和鼠抗糜蛋白酶多克隆抗体作为一抗进行免疫组化染色。应用免疫组织化学EliVision二步法[14]对瘢痕疙瘩和正常皮肤组织石蜡切片进行CD117抗体和糜蛋白酶抗体检测,观察CD117和糜蛋白酶表达,其中一抗用抗体稀释液按1∶500稀释,二抗为抗兔Envision抗体。CD117、糜蛋白酶阳性部位为细胞膜及细胞质,光镜观察结果以细胞膜和细胞浆着棕色者为阳性染色,另用PBS代替一抗为阴性对照。结果判定:(1)CD117染色后可见肥大细胞膜呈棕黄色表现,检测每例切片随机5个高倍镜视野CD117染色的肥大细胞数,取其平均数/高倍视野。(2)肥大细胞糜蛋白酶染色后可见细胞浆呈浅棕褐色阳性表达。肥大细胞糜蛋白酶免疫组织化学半定量分析方法:在光镜下观察,根据染色的反应强度及着色面积判断结果:每张切片阳性细胞的阳性强度:无着色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分。着色阳性面积:无着色为0分,着色面积<1/3为1分,1/3~2/3为2分,>2/3为3分。根据评分标准≥3分为阳性[15]。
1.3.2瘢痕疙瘩和正常皮肤组织的肥大细胞糜蛋白酶实时定量PCR将正常皮肤及瘢痕疙瘩组织解冻后剪碎至0.2~0.8 mm大小,用玻璃匀浆器将其压成匀浆,提取总RNA(Trizol试剂,Invitrogen公司,美国),从总RNA中取2 μg DNA,按照AMV逆转录酶试剂盒(Promega,WI,USA)说明书进行操作。按照SYBR Premix Ex Taq kit (Takara)操作说明书,在IQ5实时PCR系统(Bio-Rad)进行实时定量PCR扩增。实时PCR反应体系容量为20 μL。实验方案:初始变性30 s 95℃;5 s 95℃, 30 s 55℃共40个循环,60 s 72℃;溶解曲线温度65℃~95℃。使用2△△CT方法计算初始规范肥大细胞糜蛋白酶对GAPDH的相对基因表达。肥大细胞糜蛋白酶和GAPDH特异性引物序列如下: F:5′-CTG AGA GGA TGC TTC TTC CTG C-3′, R: 5′-AGA TCT TAT TGA TCC AGG GCC G-3′。GAPDH引物序列:F: 5′-AAC TCC ATC ATG AAG TGT GA-3′, R: 5′-ACT CCT GCT TGC TGA TCC AC-3′。所有样品实时定量PCR实验重复3次。
1.3.3瘢痕疙瘩和正常皮肤组织的肥大细胞糜蛋白酶活性检测取100 mg组织反复匀浆后放入(10 w/v)50 mmol/L NaH-2PO-4缓冲液(pH/7.4),4℃静置15 min。4℃、9 000 r/min离心20 s,弃上清。将沉渣转移至50 mmol/L NaH-2PO-4 缓冲液中超声匀浆(设置为400安培,5 s/次,间隙10 s,反复3~5次)。匀浆组织在4℃、30 000 g离心20 min。重复上述匀浆与离心过程3遍,分别收集3次的上清(糜酶存在于上清液中)。分别取出经过上述处理的每个待测样品悬浮液1 500 μL,分成3管,每管500 μL,分别编号为A、B、C。反应体系如下:(1)反应体系A,加入6 ng AngI(血管紧张素I );(2)反应体系B,加入6 ng AngI和 50 μM赖诺普利;(3)反应体系C,加入6 ng AngI和20 μmol/L抑肽酶。置于37℃水浴15 min后,加入2.5倍体积预冷乙醇终止反应。按照放射免疫分析药盒说明书测定各样品的AngII含量。以每分钟每100 mg皮肤组织中生成 1 nmol AngII所需的酶活力量定义为1个酶活力单位(U)。ACE(血管紧张素转化酶)活性=应体系A的酶活性-反应体系B的活性;其他丝氨酸蛋白酶活性=反应体系A的酶活性-反应体系C的活性;肥大细胞糜蛋白酶的活性=应体系A的酶活性-ACE活性-其他丝氨酸蛋白酶活性。
1.4统计学处理应用SPSS13.0软件进行统计学处理,所有数据以均数±标准差(±s)表示,根据方差齐性,样本间两两比较采用q检验和秩和检验,以P<0.05为差异有统计学意义。
2结果
2.1肥大细胞CD117和肥大细胞糜蛋白酶免疫组化染色光镜下观察:瘢痕疙瘩组织切片可见纤维浓密,方向不规则,呈旋涡状,在纤维间还可见多个与成纤维细胞相邻的含有丰富胞质颗粒的肥大细胞,细胞形态圆形、椭圆形及不规则形。其胞质颗粒密度不均匀,一些细胞颗粒密度降低,表明肥大细胞有脱颗粒。CD117(C-Kit)免疫组化染色后肥大细胞膜呈棕黄色。瘢痕疙瘩组织块中细胞膜被染成棕黄色肥大细胞的数量(图1A)以及细胞浆中浅棕褐色颗粒染色(肥大细胞糜蛋白酶染色,图1B)明显多于正常皮肤组织(图1C、1D和表1 ),肥大细胞糜蛋白酶染色呈强阳性表达。
表1 瘢痕疙瘩组织和正常皮肤组织肥大细胞比较( ±s)

表1 瘢痕疙瘩组织和正常皮肤组织肥大细胞比较( ±s)
n肥大细胞数/(个/HP)肥大细胞糜蛋白酶/mm+2瘢痕疙瘩1010.00±0.256.20±0.23正常皮肤104.00±0.222.50±0.12
注:与正常皮肤组织比较,*P<0.05。
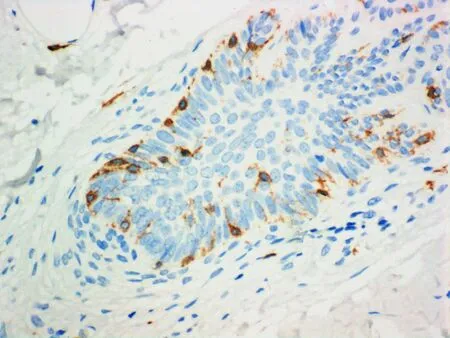
A: 肥大细胞CD117在早期瘢痕疙瘩组织中的表达(400×)
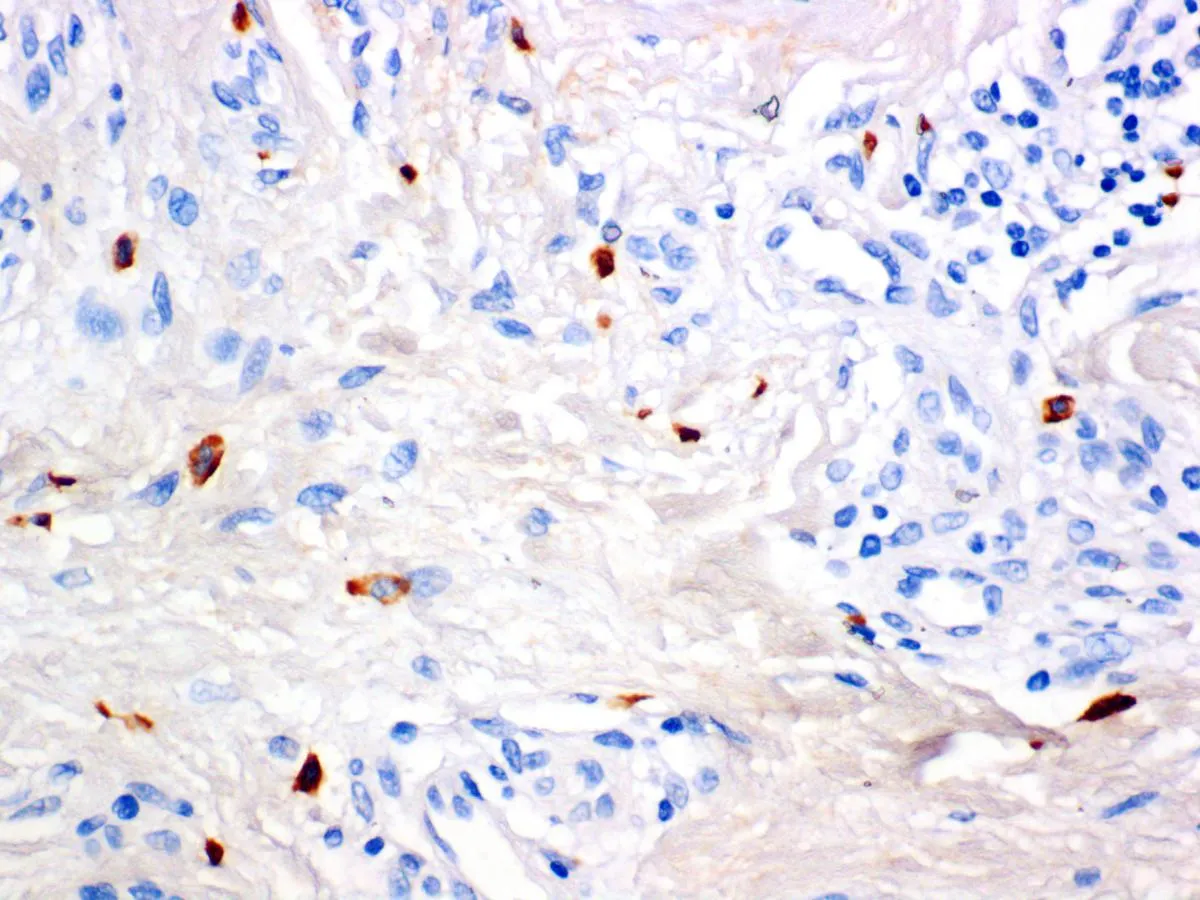
B: 肥大细胞糜蛋白酶在早期瘢痕疙瘩组织中表达呈强阳性(400×)
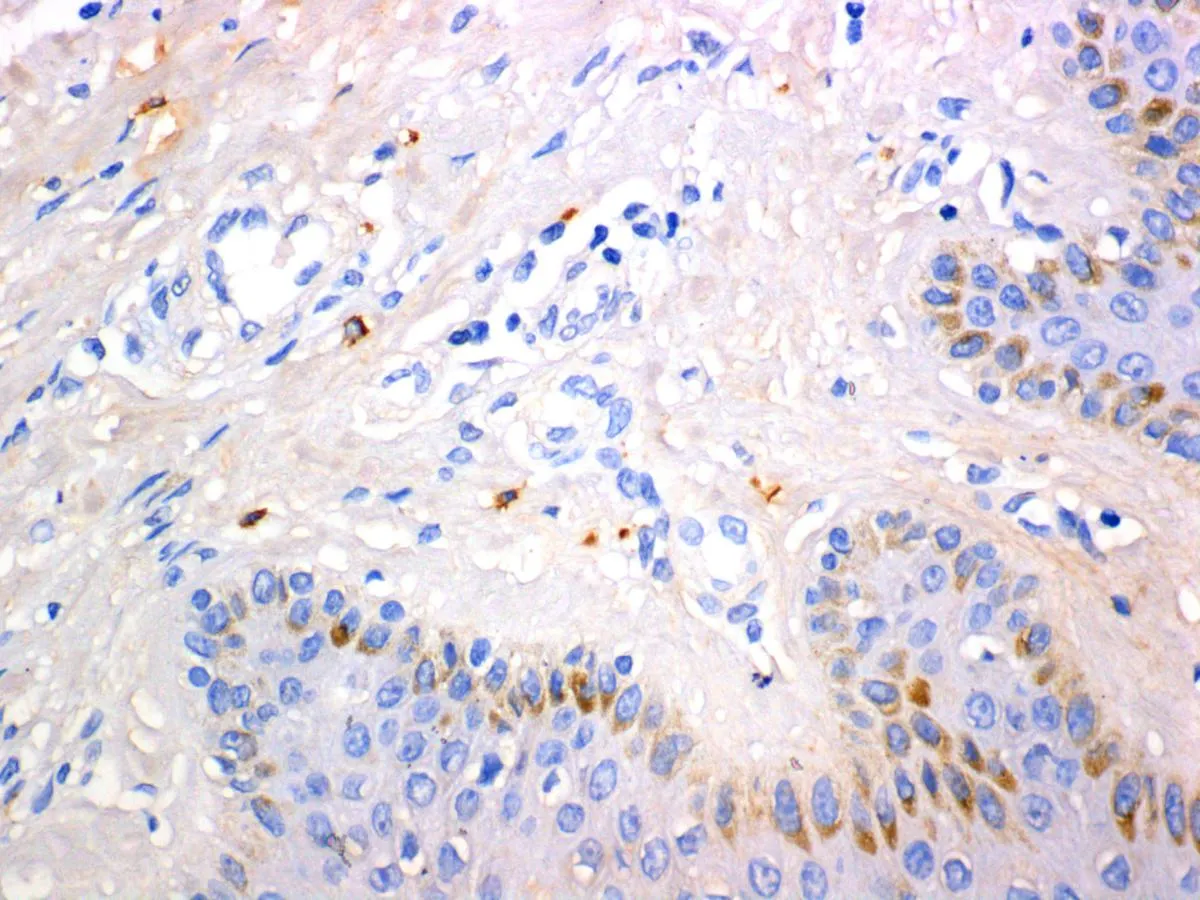
C: 肥大细胞CD117在正常皮肤中的表达(400×)
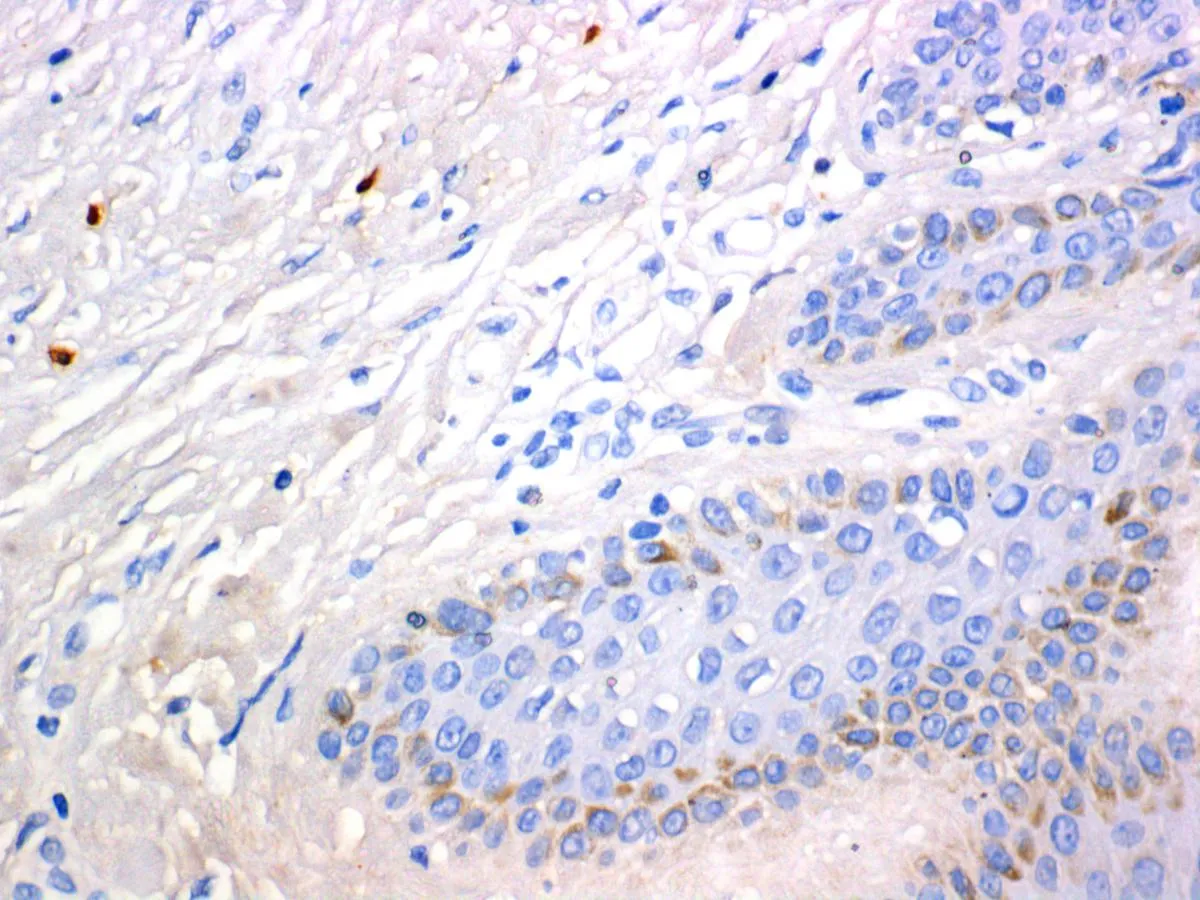
D: 肥大细胞糜蛋白酶在正常皮肤中的表达(400×)
图1肥大细胞CD117和肥大细胞糜蛋白酶在瘢痕疙瘩及正常皮肤中的表达
2.2糜蛋白酶的实时定量PCR 分析及其活性变化瘢痕疙瘩组织中肥大细胞糜蛋白酶mRNA表达水平明显高于正常皮肤(图2),瘢痕疙瘩组织中糜蛋白酶活性表达较正常皮肤明显增强(图3),差异均有统计学意义(P<0.05)。
3讨论
肥大细胞糜蛋白酶在瘢痕疙瘩中是否有活性表达还不清楚。目前肥大细胞糜蛋白酶的表达检测主要有基因检测和活性检测。Chen等[16]运用逆转录PCR检测仓鼠心力衰竭模型的心肌糜蛋白酶mRNA表达。Guo等[17]运用逆转录PCR检测卵白蛋白激发的仓鼠动脉粥样硬化糜蛋白酶mRNA表达。Matsumoto等[18]运用定量PCR检测糜蛋白酶抑制剂SUNC8257作用于心动过速诱导的狗心力衰竭糜蛋白酶mRNA表达。糜蛋白酶活性的检测方法尚无统一标准,国际上较多采用组织提取物加入含AngI的反应体系,应用HPLC检测糜酶活性,但测量误差较大。国内学者采用改良AngI反应体系,采用3种抑制剂分别抑制糜酶以外其他AngI水解酶活性,运用减法原则和放射免疫技术检测AngII水解活性来表示糜酶活性,理论上较为合理[19]。
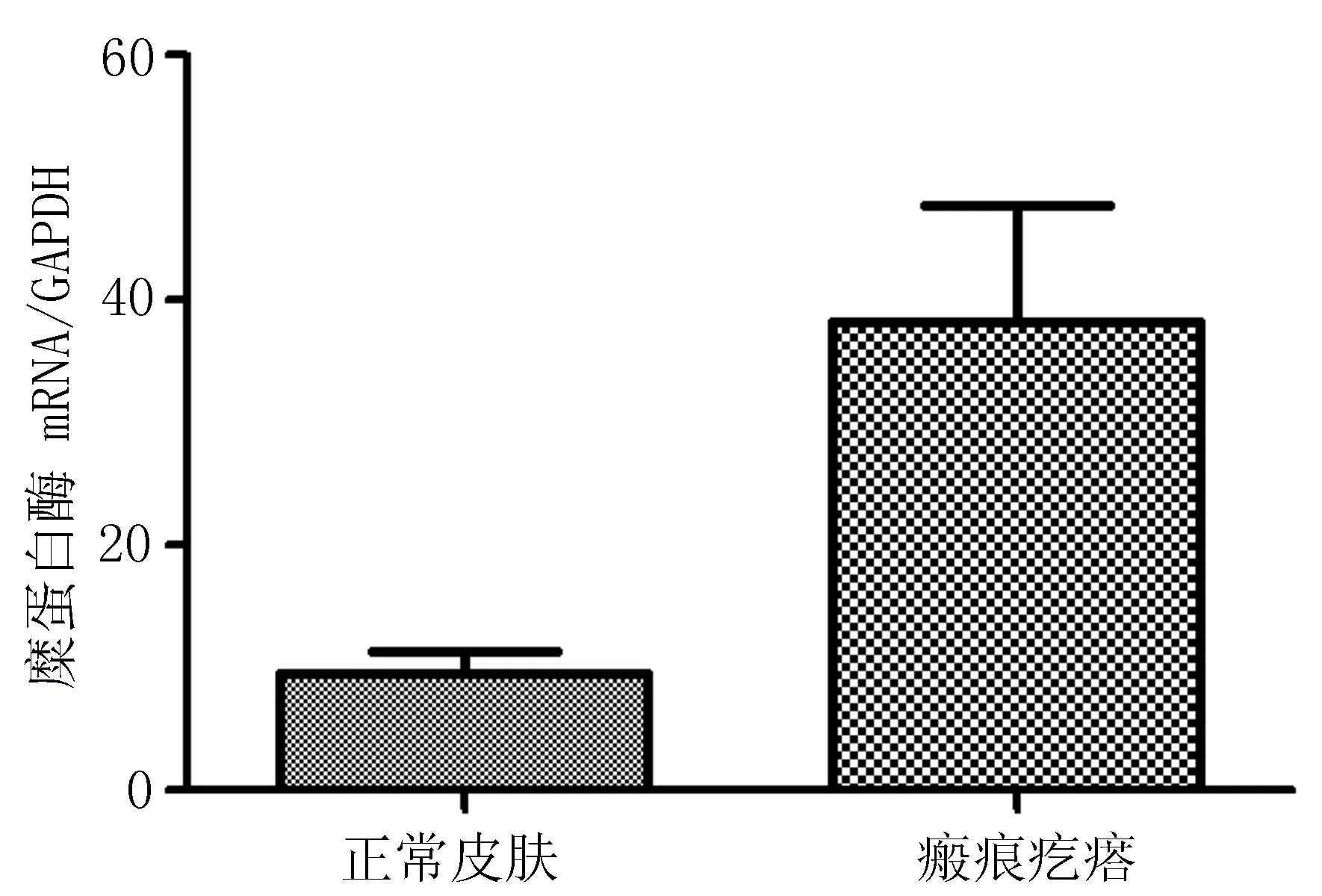
图2 瘢痕肥大细胞糜蛋白酶基因表达
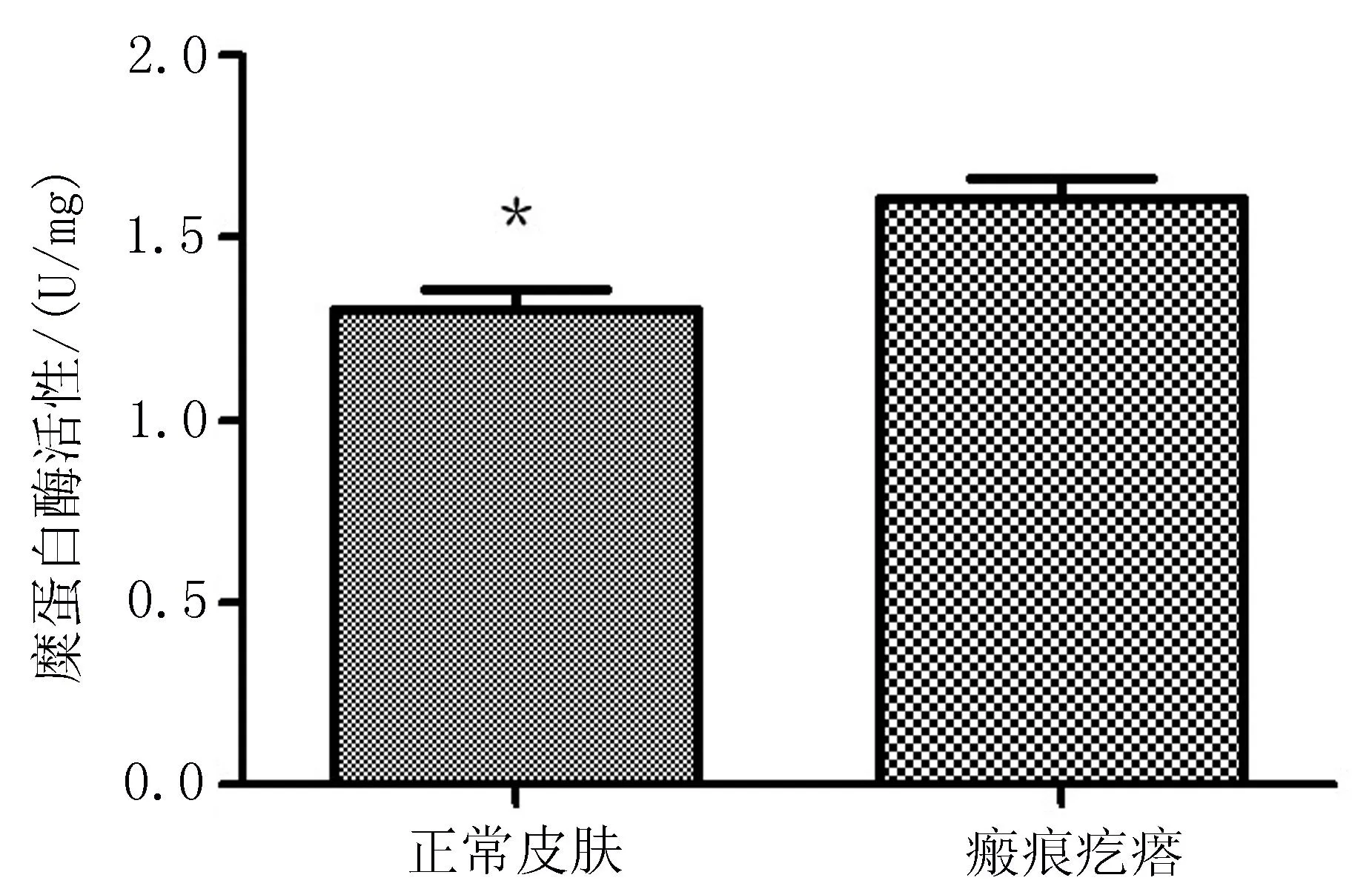
图3 肥大细胞糜蛋白酶活性表达
本研究显示瘢痕疙瘩中的肥大细胞数量明显多于正常皮肤,肥大细胞糜蛋白酶的免疫组化染色也表明瘢痕疙瘩中肥大细胞糜蛋白酶呈强阳性表达;瘢痕疙瘩组织中肥大细胞数量与糜蛋白酶阳性表达评分为(10±0.25)个/HP、(6.2±0.23)mm2,明显高于正常皮肤组织(4±0.22)个/HP、(2.5±0.12)mm2(P<0.01);RT-PCR结果显示瘢痕疙瘩组织中肥大细胞mRNA和糜蛋白酶mRNA表达水平较正常皮肤明显增高,表明糜蛋白酶活性在瘢痕疙瘩中明显高于正常组织。肥大细胞主要分布于纤维组织增生区。瘢痕疙瘩组织中糜蛋白酶浓度高的患者,其肥大细胞分布也增多,提示瘢痕疙瘩中糜蛋白酶浓度与纤维化关系密切。
瘢痕组织病理学表现均是以成纤维细胞增生和胶原为主的细胞外基质成分的过度积聚为特征。成纤维细胞是瘢痕组织的效应细胞,具有增殖及胶原合成功能,对细胞因子的反应性和细胞骨架改变等表型特征可能是受某些基因或细胞因子调控的。本研究结果显示,在瘢痕疙瘩组织中糜蛋白酶活性明显高于正常皮肤组织,提示瘢痕疙瘩中糜蛋白酶在创口愈合的纤维化中起重要作用。
肥大细胞的数量变化以及糜蛋白酶在皮肤创面的异常愈合过程中有着重要的作用,本实验进一步表明肥大细胞活化脱颗粒释放的肥大细胞糜蛋白酶可能在创面的异常愈合中起到一定的作用。可以设想,通过特异干预肥大细胞糜蛋白酶的表达,必定对核内的转录产生影响。另外,干预肥大细胞糜蛋白酶与其他细胞因子的结合,也将会对细胞功能产生一定影响,减少瘢痕疙瘩的产生。
综上所述,肥大细胞糜蛋白酶存在于瘢痕疙瘩中且活性表达明显高于正常皮肤组织,并参与瘢痕疙瘩的形成,但是其对瘢痕疙瘩形成的相关性还需要进一步研究。
参考文献:
[1]李惠斌,蔡景龙.瘢痕疙瘩治疗研究进展[J].中华医学美学美容杂志,2004,10(2):126-128.
[2]柳大烈,张选奋,鲁开化,等.增生性瘢痕和瘢痕疙瘩中PTK活性测定[J].中华医学美学美容杂志,2001,7(2):83-85.
[3]McNeil HP.The mast cell and inflammation[J].Aust N Z J Med, 1996 ,26(2):216-225.
[4]Lee YS, Vijayasingam S.Mast cells and myofibroblasts in keloid:a light microscopic, immunohistochemical andultrastructural study[J].Ann Acad Med Singapore,1995 ,24(6):902-905.
[5]Kovanen PT. Mast cells:multipotent local effector cells in atherothrombosis[J].Immunol Rev, 2007,217:105-122.
[6]Richard V, Hurel-Merle S, Scalbert E, et al. Functional evidence for a role of vascular chymase in the production of angiotensin II in isolated human arteries[J]. Circulation, 2001,104(7):750-752.
[7]Zhao LZ, Zheng JS, Guan FS, et al. Chymase induces profibrotic response via transforming growth factor-β1/Smad activation in rat cardiac fibroblasts[J].Mol Cell Biol, 2008,310(1-2):159-166.
[8]Maruichi M, Takai S, Sugiyama T, et al. Role of chymase on growth of cultured canine Tenon′s capsule fibroblasts and scarring in a canine conjunctival flap model[J]. Exp Eye Res, 2004,79(1):111-118.
[9]梁秀影,李健宁.增生性瘢痕中肥大细胞类胰蛋白酶的表达[J].中华医学美学美容杂志, 2007,13(6):345-347.
[10]Doggrell SA, Wanstall JC. Vascular chymase:pathophysiological role and therapeutic potential of inhibition[J]. Cardiovasc Res, 2004,61(4):653-662.
[11]El-Agamy DS.Targetingc-kit in the therapy of mast cell disorders:current update[J].Eur J Pharmacol, 2012,690(3):1-3.
[12]Ray P,Krishnamoorthy N,Oriss TB,et al.Signaling of c-kit in dendritic cells influences adaptive immunity [J].Ann NY Acad Sci,2010,1183(5):104-122.
[13]Natkunam Y, Rouse RV.Utility of paraffin section immunohistochemistry for C-KIT (CD117) in the differentialdiagnosis of systemic mast cell disease involving the bone marrow[J].Am J Surg Pathol, 2000 ,24(1):81-91.
[14]Vosse BA,Seelentag W,Bachmann A,et al.Background staining of visualization systems in immunohistochemistry: comparison of the Avidin-Biotin Complex system and the EnVision+system[J]. Appl Immunohistochem Mol Morphol,2007,15(1):103-107.
[15]赵雪莲,苏晓光,张锤,等.兔耳病理性瘢痕皮回植术后组织中基质金属蛋白酶-1及金属蛋白酶组织抑制剂-1表达的变化[J].中华医学美学美容杂志,2014,20(1):62-64.
[16]Pengmin C. Changes of chymase, angiotensin converting enzyme and angiotensin Ⅱ type 1 receptor expressions in the hamster heart during the development of heart failure[J]. Chinese Med J, 2005,22:1886-1892.
[17]Guo T, Chen WQ, Zhang C, et al. Chymase activity is closely related with plaque vulnerability in a hamster model of atherosclerosis[J]. Atherosclerosis. 2009,207(1):59-67.
[18]Matsumoto T, Wada A, Tsutamoto T, et al. Chymase inhibition prevents cardiac fibrosis and improves diastolic dysfunction in the progression of heart failure[J]. Circulation,2003, 107(20):2555-2558.
[19]Luchner A, Stevens TL, Borgeson DD, et al. Angiotensin Ⅱ in the evolution of experimental heart failure[J].Hypertension,1996, 28(3):472-477.
(本文编辑张巧莲)

