促排卵对小鼠卵巢组织中缺氧诱导因子-1α的影响
杜秀雅,马华刚
(1.潍坊医学院,潍坊 261041;2.潍坊市人民医院生殖医学科,潍坊 261041)
卵泡的生长发育过程受多因素相互作用、相互影响,多重调控因子影响其发育过程,其中极为重要的是下丘脑-垂体-卵巢轴及促性腺激素,如FSH、LH。FSH 是卵泡发育必须的激素,其主要生理作用是促进窦前卵泡及窦卵泡颗粒细胞增殖与分化,分泌卵泡液,使卵泡生长发育。LH 主要作用是刺激卵泡膜细胞合成雄激素,主要是雄烯二酮,为E2的合成提供底物。卵泡还受卵巢颗粒细胞分泌的抑制素、激活素、卵泡抑制素及众多细胞因子和生长因子的调节如白细胞介素-1、肿瘤坏死因子、胰岛素样生长因子(VEGF)、血管内皮生长因子、成纤维因子、转化生长因子、血小板衍生生长因子,对下丘脑-垂体-卵巢轴调节及通过其自、旁分泌的作用调节卵泡生长发育。适当的氧浓度对卵泡的生长发育极为重要,研究表明卵巢内氧气浓度较低,其范围在1.3%~5.5%左右[1],卵巢内环境为低氧环境,与低氧有关的因子有很多,其中最灵敏的当属缺氧诱导因子-1(HIF-1)。
HIF-1是缺氧条件下广泛存在于哺乳动物的一种转录因子,由HIF-1α和HIF-1β组成,其中HIF-1α是主要的氧调节亚基,可以调节下游靶基因VEGF的转录促进血管新生,对细胞适应缺氧状态至关重要,缺氧对卵母细胞减数分裂过程中染色体分离和复制有重要影响[2],本研究从蛋白水平检测了促排卵对小鼠卵巢组织中HIF-1α表达,旨在研究促排卵过程中多卵泡同时发育对卵母细胞氧供的改变及缺氧对卵母细胞质量的影响。
材料与方法
一、实验动物与分组
清洁级成年雌性昆明小鼠30只,鼠龄6~8周,体重20~25g,由潍坊医学院动物实验中心提供。适应性饲养1 周后进入实验阶段,自然光照,自由取水和摄食,阴道涂片检查动情周期。随机分为2组:自然排卵组(对照组)、促排卵组(实验组),每组15只。
二、研究方法
实验组于动情周期第3天腹腔注射促排卵药普丽康(50U/0.5ml,欧加农,荷兰)0.4U/g,注射后48h颈椎脱臼法处死;对照组小鼠进入动情期后(阴道涂片全为无核角化细胞,间或有少量上皮细胞)颈椎脱臼法处死。两组小鼠处死后取卵巢组织,经4%多聚甲醛固定,脱水,常规石蜡包埋,切片(4 mm),用于免疫组织化学方法检测小鼠卵巢HIF-1α的表达及定位。
三、小鼠卵巢组织中HIF-1α 表达及定位的检测
采用辣根过氧化物酶复合物(HRP)免疫组织化学SV(Super Vision)法检测HIF-1α在小鼠卵巢中的表达及定位,操作按试剂盒(武汉博士德公司)说明书要求进行,将上述切片脱蜡至水,滴加3% 双氧水,室温10min 以灭活内源性过氧化物酶,将切片放入盛有枸橼酸盐缓冲液的浴盒内,在微波炉内加热(92 ℃~96 ℃)5 min,冷却至室温,滴加封闭液,室温30min以阻断非特异性的结合。滴加一抗(山羊抗兔HIF-1α单克隆抗体,武汉博士德公司,1∶100 稀释),4 ℃过夜,滴加二抗(多聚体抗山羊IgG-HRP,武汉博士德公司),37 ℃30min,最后用二氨基联苯胺(DAB)显色试剂盒(武汉博士德公司)显色。山羊抗兔HIF-1α单克隆抗体用于检测小鼠卵巢组织中HIF-1α无交叉反应,阳性显色为棕黄色。每组以PBS代替一抗进行孵育作为阴性对照。
每组任选15只小鼠卵巢切片,经免疫组织化学染色,在卵泡的细胞胞浆或包膜中出现棕黄色颗粒,为阳性细胞,应用Lecia显微成像系统,高倍镜(×400)下随机选取10个视野,应用Image-Pro Plus图文分析系统计算平均光密度值,采用平均光密度法半定量法比较蛋白的表达强度。
四、统计学分析
平均光密度(AOD)=累计光密度(IOD)/area。计量资料采用(±s)表示,采用t检验比较两组间均数。采用SPSS 17.0统计软件进行处理。P 值为双侧概率,检验水准α=0.05。
结 果
一、HIF-1α在小鼠卵巢组织中的表达
HIF-1α蛋白在两组排卵状态下小鼠的卵母细胞及颗粒细胞上均有表达(图1)。
二、平均光密度法半定量比较HIF-1α蛋白的表达
实验组小鼠窦状卵泡卵母和颗粒细胞中HIF-1α蛋白AOD 值明显高于对照组,差异有统计学意义(P<0.05)(表1)。
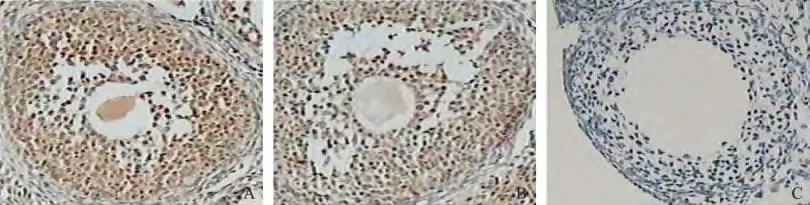
图1 各组小鼠卵巢卵泡中HIF-1α的表达 免疫组织化学SV 法×100
表1 两组小鼠卵巢组织HIF-1α蛋白AOD 的比较(±s)

表1 两组小鼠卵巢组织HIF-1α蛋白AOD 的比较(±s)
注:与对照组相比较,*P<0.05
组 别 样本量(n)AOD对照组10 0.149 5±0.034 7实验组 10 0.192 4±0.026 8*
讨 论
随着辅助生殖技术的发展,促排卵治疗应用日益广泛,促排卵导致的多个卵泡同时发育是否会影响卵母细胞的质量引起了人们的担忧。卵泡的生长发育过程是受多因素相互作用相互影响的,多重调控因子影响其发育过程,极为重要的是下丘脑-垂体-卵巢轴及促性腺激素。卵泡的生长发育还需要适当的氧浓度,与低氧的卵巢内环境有关的缺氧诱导因子-1最灵敏。
HIF-1是缺氧条件下广泛存在于哺乳动物的一种转录因子,由α和β两个亚基组成的异源性二聚体。编码HIF 的基因位于第14号染色体上,是细胞适应缺氧环境的主要调节因子[2],可以减轻缺氧导致的损害。HIF-1α可以在一定程度上反应氧的浓度,氧浓度越低,HIF-1α水平越高[3]。本研究证明促排卵组小鼠卵巢内HIF-1α水平较自然排卵组明显增高,正常情况下,HIF-1α通过泛素-蛋白酶体通路降解,HIF-1α通过识别并结合多个76氨基酸泛素多肽,然后迅速运送至26S的蛋白酶体处水解,其半衰期只有数分钟[4]。促排卵引起多个卵泡同时发育,卵泡周围氧浓度降低,卵泡长期缺氧,HIF-1α产生的保护性适应机制已不足,导致卵泡中HIF-1α泛素化急剧下降,降解减少,并且在低氧环境下,HIF-1α和HIF-β形成的二聚体变得更加稳定,降解进一步减少,最终导致HIF-1α增加[5]。
已经有很多文献表明促排卵可以影响卵泡的生长发育:促排卵影响卵母细胞的减数分裂,对其表达修饰过程及生长发育能力均起不良作用[6-7]。不仅如此,促排卵还可导致颗粒细胞的凋亡[7-8]。促排卵引起卵母细胞质量的变化可能是影响了调节其生长发育的因子进而影响其质量。良好的卵母细胞质量是优质胚胎的前提,卵母细胞质量下降势必导致胚胎质量下降,促排卵是否会增加新生儿出生缺陷的发生仍是人们思考的问题。有文献表明借助IVFET 助孕技术出生的新生儿先天畸形发生的概率明显高于自然妊娠出生的新生儿[9],促排卵获得较多的卵母细胞是IVF-ET 助孕技术的关键步骤,高水平的促性腺激素增加了卵母细胞非整倍体形成的风险,增加了后代先天畸形率。
在体外培养中,高浓度氧环境下生长的卵泡比在低氧浓度培养发育的成熟度高[10]。HIF-1α可以在一定程度上反应卵泡的质量,HIF-1α浓度与卵泡的质量成反比[11]。应用FSH 促排卵可以上调HIF-1的表达,增加HIF-1α的转录活性[12]。HIF-1α通过调节下游靶基因VEGF 的转录促进血管新生,新生的血管为卵泡提供营养物质,氧气,甾体激素等。多个卵泡同时发育导致单个卵泡周围血流量减少,进而导致氧浓度降低,影响卵泡的减数分裂,增加卵母细胞的非整倍体发生率。
综上所述,HIF-1α表达水平与卵泡质量密切相关,因此可以将HIF-1α表达水平作为评价卵泡质量的指标。通过检测HIF-1α 水平判断卵泡的质量,并将此应用到临床上来评估卵母细胞质量,优先选择质量高的卵母细胞,提高胚胎质量,减少促排卵引起的新生儿出生缺陷的发生率。
[1] Van Blerkom J,Antczak M,Schrader R.The developmental potential of the human oocyte is related to the dissolved oxygen content of follicular fluid:association with vascular endothelial growth factor levels and perifollicular blood flow characteristics[J].Hum Reprod,1997,12:1047-1055.
[2] Burgess DJ.Cancer genetics:HIF enhances its reputation[J].Nat Rev Cancer,2012,12:316.
[3] Fogg VC,Lanning NJ,Mackeigan JP.Mitochondria in cancer:at the crossroads of life and death[J].Chin J Cancer,2011,30:526-539.
[4] Kallio PJ,Wilson WJ,O’Brien S,et al.Regulation of the hypoxia-inducible transcription factor 1 alpha by the ubiquitin-proteasome pathway[J].J Biol Chem,1999,274:6519-6525.
[5] Kallio PJ,Pongratz I,Gradin K,et al.Activation of hypoxiainducible factor 1 alpha:posttranscriptional regulation and conformational change by recruitment of the Arnt transcription factor[J].Proc Natl Acad Sci USA,1997,94:5667-5672.
[6] Jauniaux E,Watson AL,Hempstock J,et al.Onset of maternal arterial blood flow and placental oxidative stress.A possible factor in human early pregnancy failure[J].Am J Pathol,2000,157:2111-2122.
[7] London SN,Young D,Caldito G,et al.Clomiphene citrateinduced perturbations during meiotic maturation and cytogenetic abnormalities in mouse oocytes in vivo and in vitro[J].Fertil Steril,2000,73:620-626.

