竹节参药材化学成分指纹图谱研究
通信作者:曾万勇(1973-),副教授,E-mail:vyzeng@163.com.
竹节参药材化学成分指纹图谱研究
任冰1,聂晶2,胡军林2,李丹平2,陈平1,曾万勇1
(1.武汉轻工大学 生物与制药工程学院,湖北 武汉 430023;2.湖北省食品药品监督检验研究院,湖北 武汉 430064)
摘要:建立竹节参药材化学成分的指纹图谱,为竹节参药材的质量分析及其临床应用提供依据。采用HPLC法,C18色谱柱,以0.05%磷酸水溶液和乙腈为流动相,梯度洗脱,检测波长为203 nm,建立了竹节参化学成分指纹图谱。竹节参指纹图谱共形成19个共有峰,通过对照品比对和HPLC-MS/MS分析,指认了10个共有峰,分别是人参皂苷Rg1、Re、Rb1、Rg2、Ro、Rg3、Rh2、竹节参皂苷Ⅳ、Ⅰb、Ⅳa。主成分分析和聚类分析将14批药材分为3类。主成分分析与聚类分析结果一致。所建立的竹节参化学成分指纹图谱准确、可靠、可行,对于竹节参药材的生产和质量控制提供依据。
关键词:竹节参;化学成分;指纹图谱,质量控制
收稿日期:2015-05-04.
作者简介:任冰(1991-),女,硕士研究生,E-mail:237632469@qq.com.
基金项目:国家自然科学
文章编号:2095-7386(2015)03-0007-04
DOI:10.3969/j.issn.2095-7386.2015.03.002
中图分类号:R 284.1
HPLC fingerprint spectra for discrimination ofRhizomaPanacisJaponici
RENBing1,NIEJing2,HUJun-lin2,LIDang-ping,CHENPing1,ZENGWan-yong1*
(1.School of Biology and Pharmacy Engineering,Wuhan Polytechnic University,Wuhan 430023,China;
2.Hubei Institute for Food and Drug Control,Wuhan 430064,China)
Abstract:To establish the chemical composition fingerprints for identification and evaluation of Rhizoma Panacis Japonici.HPLC method was used to establish Rhizoma Panacis Japonici fingerprint to identify them with the mobile of acetonitrile -0.05% phosphoric acid water solution by gradient elution on an C18 column at the detection wavelength of 203 nm.Twenty two common peaks were defined in Rhizoma Panacis Japonici by fingerprint analysis in all. Ten of them were identified as ginsenoside Rg1、Re、Rb1、Rg2、Ro、Rg3、Rh2;Chikusetsu saponin Ⅳ,Ⅰb,Ⅳa by comparing with standard references or HPLC-MS/MS method . The samples of Rhizoma Panacis Japonici was classfied into 3 clusters by principal component analysis and cluster analysis.The HPLC fingerprint provides the experimental basis for manufacture and quality control of Rhizoma Panacis Japonici .
Key words:RhizomaPanacisJaponici;chemical composition ;fingerprint;the quality control
1引言
竹节参为五加科人参属植物竹节参PanaxjaponicusC.A.Mey.的干燥根茎,略呈圆柱形,稍弯曲,有的具肉质侧根。长5—22 cm;直径0.8—2.5 cm;表面黄色或黄褐色,粗糙,有致密的纵皱纹及根痕;节明显,节间长0.8—2 cm,每节有1凹陷的茎痕;质硬,断面黄白色至淡黄棕色,黄色点状维管束排列成环[1-2]。竹节参主要的化学成分为皂苷类,以齐墩果烷型和达玛烷型皂苷为主,还含有竹节参多糖、挥发油类[3-4]。现代药理学实验表明,竹节参的提取物或总皂苷具有抗氧化、抗炎镇痛、抗肿瘤等作用[5-8]。由于气候、生态环境的影响,不同产地的竹节参化学成分差异较大,仅以单一化学成分含量作为质量评价标准,不能有效地控制竹节参药材质量。笔者通过考察不同产地的14批竹节参药材,建立化学指纹图谱,为竹节参药材的质量控制提供依据。
2材料
DIONEX Ultimate 3000高效液相色谱仪,Waters ACQUITY UHPLC Xevo G2Q-TOF液质联用色谱仪,HyperSonic DT-A超声波清洗仪(湖北省鼎泰恒胜科技设备有限公司)。三七皂苷R1(批号110745-201308)、人参皂苷Rg1(批号110703-201128)、人参皂苷Re(110754-201324)、人参皂苷Rb1(批号110704-201223)、人参皂苷Rb2(批号111715-201203)、人参皂苷Rb3(批号111686-201203)、人参皂苷Rd(111818-201001)、人参皂苷Rg3(110804-200402)、人参皂苷Ro(批号111903-201303)、竹节参皂苷Ⅳa(批号111861-201102),均为中国药品生物制品检定所提供。竹节参皂苷Ⅳ为实验室自制,纯度检测均大于98%。乙腈为色谱纯(Merck.KGaA,USA),磷酸、甲醇为分析纯(国药集团化学试剂有限公司),水由Millipore SYNERGY (UV)超纯水机制得。竹节参药材来源见表1,密封保存于阴凉干燥处。
3方法与结果
3.1色谱条件
Agilent ZORBAX Extent C18(4.6 mm×250 mm,5 μm)色谱柱;流动相为乙腈(A)- 0.05%磷酸水溶液(B),梯度洗脱,见表2;检测波长为203 nm;流速1.0 mL·min-1;柱温30 ℃;进样量20 μL。
3.2质谱条件
离子源为ESI源,负离子扫描模式,锥孔电压:40 V,毛细管电压:2 600 V,离子源温度:100 ℃,脱溶剂气体流速:600 L/h,碰撞能量:50 V。梯度洗脱程序如3.1。
表1样品来源及编号
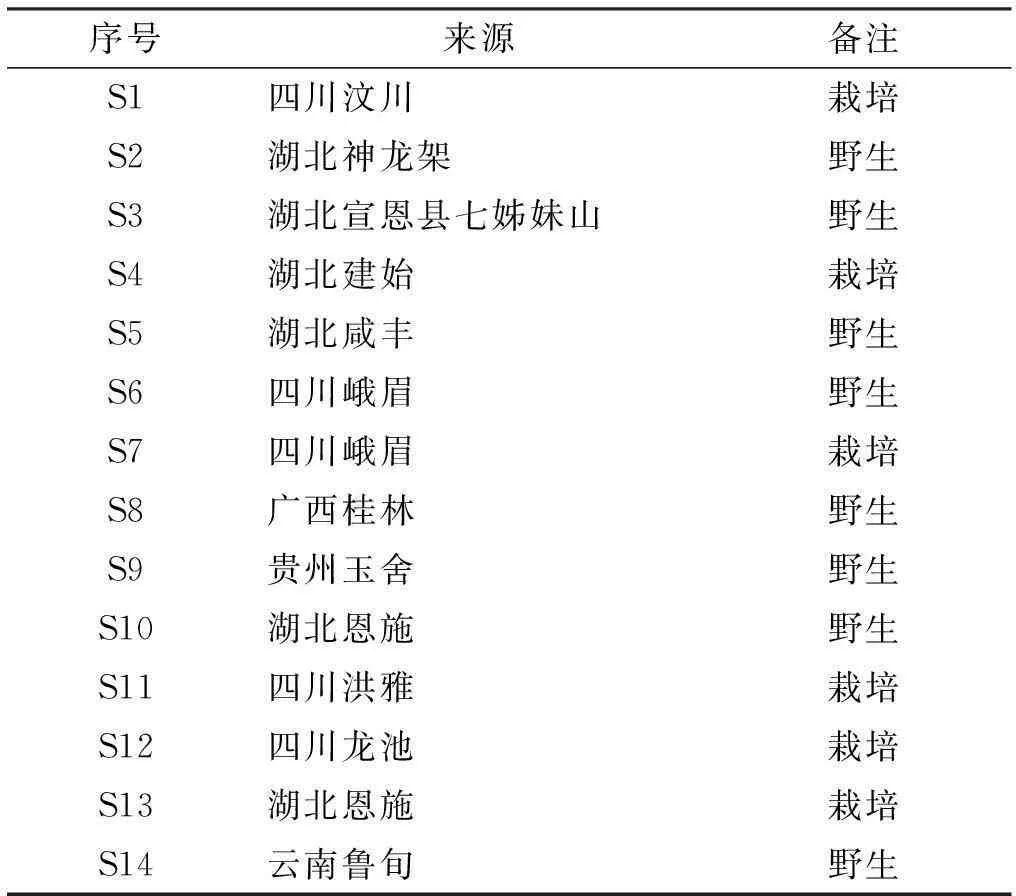
序号来源备注S1四川汶川栽培S2湖北神龙架野生S3湖北宣恩县七姊妹山野生S4湖北建始栽培S5湖北咸丰野生S6四川峨眉野生S7四川峨眉栽培S8广西桂林野生S9贵州玉舍野生S10湖北恩施野生S11四川洪雅栽培S12四川龙池栽培S13湖北恩施栽培S14云南鲁旬野生
表2梯度洗脱程序
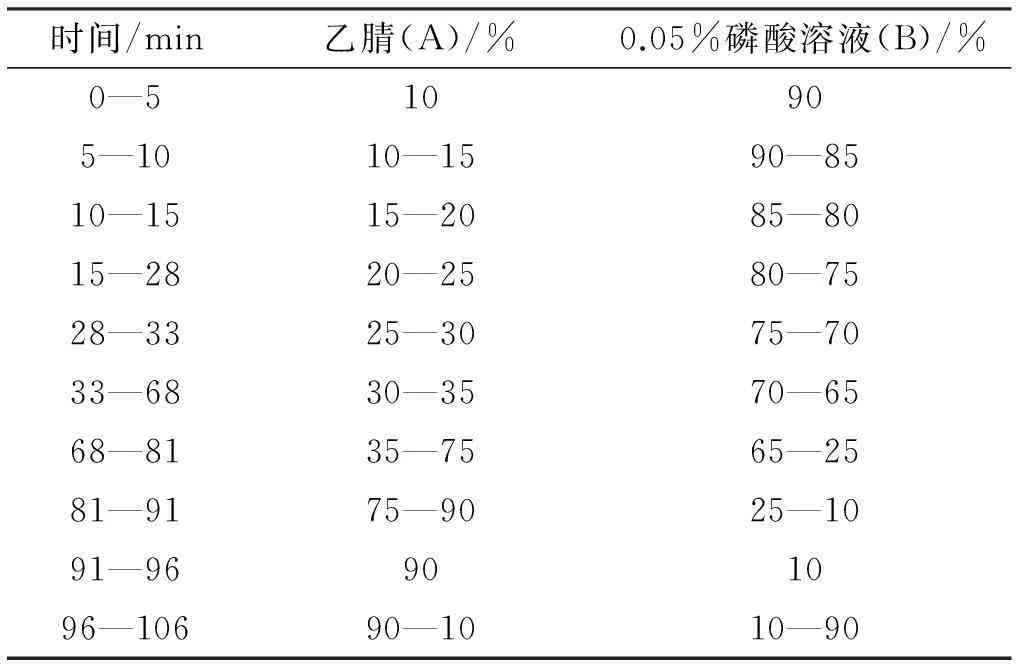
时间/min乙腈(A)/%0.05%磷酸溶液(B)/%0—510905—1010—1590—8510—1515—2085—8015—2820—2580—7528—3325—3075—7033—6830—3570—6568—8135—7565—2581—9175—9025—1091—96901096—10690—1010—90
3.3对照品溶液的制备
取人参皂苷Rg1、Re、Rf、Rb1、Rb2、Rb3、Rd、Rg3、Ro;竹节参皂苷Ⅳa、Ⅳ;三七皂苷R1对照品适量,精密称定,用甲醇配制为各对照品浓度为0.200 g·L-1的混合对照品溶液,4 ℃冷藏保存备用。
3.4供试品溶液的制备
精密称定S1—S14样品粉末(过四号筛)0.5 g,置于50 mL具塞锥形瓶中,精密加入25 mL甲醇,称定质量,浸泡2 h,再超声处理45 min,冷却至室温,再称定质量,用甲醇补足缺失的质量,摇匀过滤,0.22 μm微孔滤膜过滤,得到竹节参供试品溶液,进行HPLC分析。
3.5方法学考察
3.5.1精密度试验
取竹节参样品S11按3.4项下方法制备供试品溶液,按3.1中方法连续进样6次,测得相对保留时间RSD<0.5%,相对峰面积的RSD<3.0%,表明仪器精密度良好。
3.5.2重复性试验
取竹节参样品S11 6份,按3.4项下方法制备供试品溶液,按3.1项下方法进样测定,测得相对保留时间RSD小于0.3%,相对峰面积的RSD小于2.5%,表明方法重复性良好。
3.5.3稳定性试验
取竹节参样品S11按3.4项下制备供试品溶液,按3.1项下方法分别在0 h,8 h,12 h,24 h,48 h进样测定,测得相对保留时间RSD小于0.5%,相对峰面积的RSD小于3.0%,由此表明样品在48 h内稳定。
3.6样品测定
将竹节参样品S11—S14按3.3项下方法制备供试品溶液,按3.1项下的色谱条件下依次进样检测,得到竹节参药材的HPLC指纹图谱,见图1。
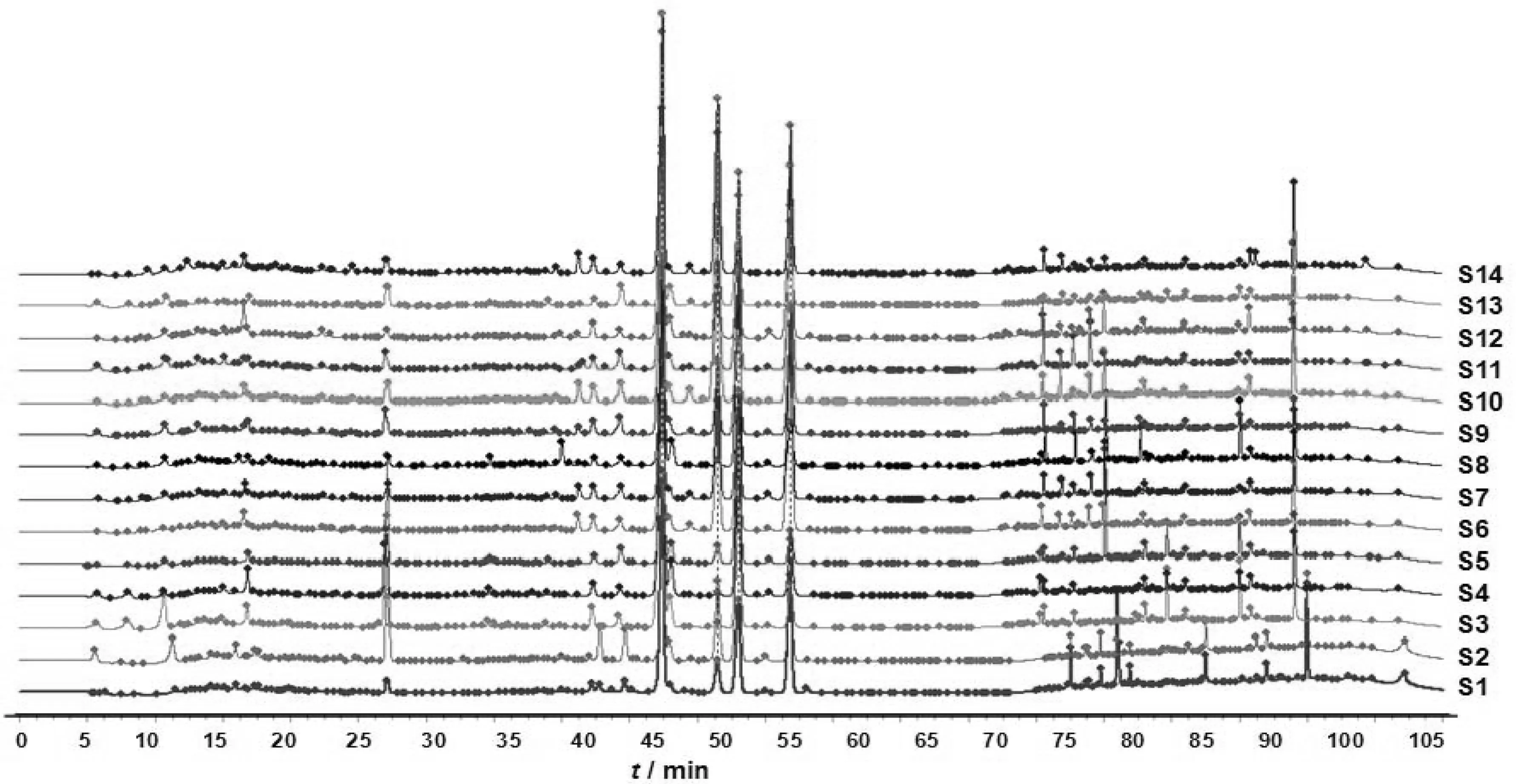
图1 竹节参样品(S1—S14)的HPLC指纹图谱
3.7指纹图谱分析
3.7.1聚类分析
将色谱数据导入SPSS 20.0 统计分析软件进行聚类分析,聚类方法采用word法,度量标准采用欧氏距离。聚类分析结果见图2。由图2可知,14批竹节参样品大致可以分为3类,当0
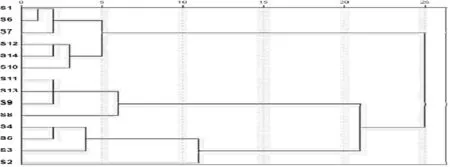
图2 聚类分析图
3.7.2 主成分分析
将色谱数据导入SPSS 20.0 统计分析软件进行主成分分析。因子分析得到两个主要的主成分,将主成分1和主成分2分别为X-轴和Y-轴,制成散点图,如图3所示。竹节参样品可分为3类,第Ⅰ类为S1、S6、S7、S10、S12、S14,分布较为密集,样品质量较为一致;第Ⅱ类S8、S9、S11、S13,分布松散,与其它三批存在差异,但可以归为一类;第Ⅲ类为S3、S4、S5,分布松散,S3与S4、S5差异较显著。S2不在这3类中。主成分分析结果与聚类分析结果一致。
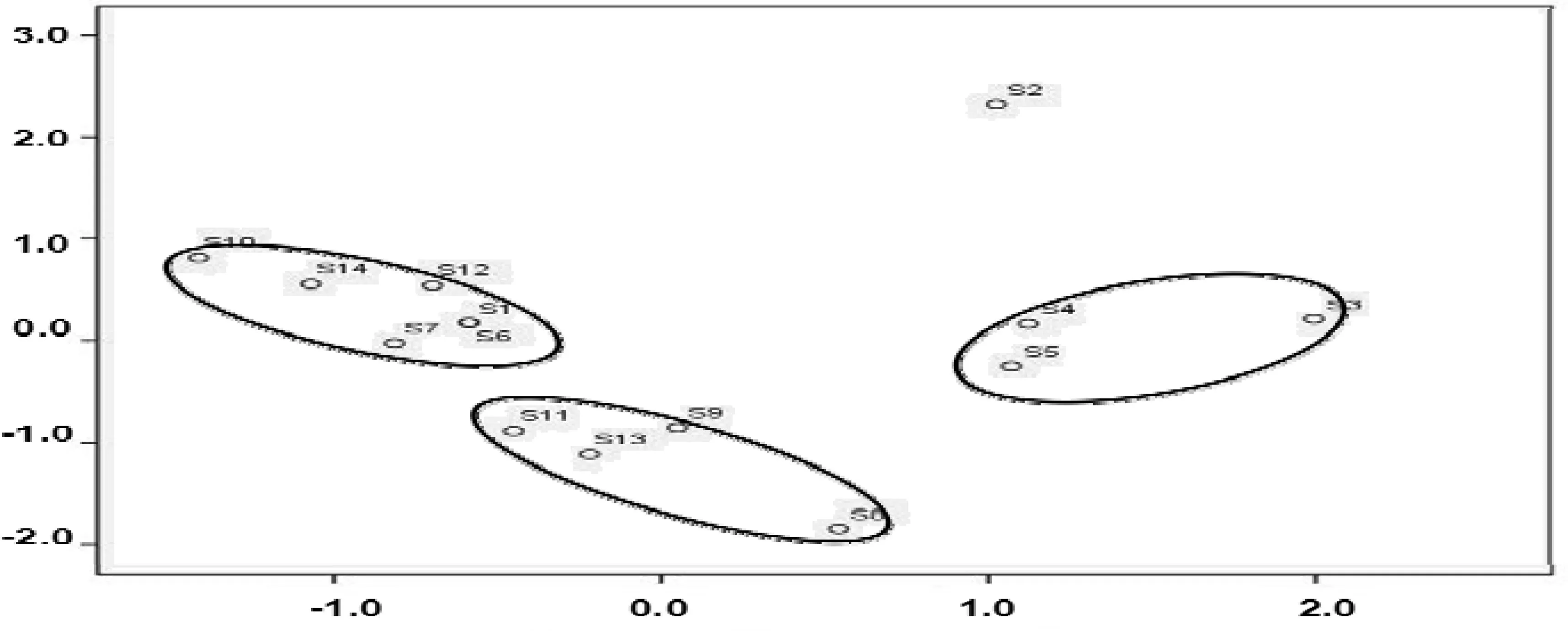
图3 主成分分析图
3.7.3特征指纹图谱的建立及相似度评价
将色谱图导入“中药色谱指纹图谱相似度评价系统(2010版)”,对14批竹节参进行指纹图谱分析。以竹节参样品S11作为参照图谱,生成特征指纹图谱,共标定19个共有峰,并进行了相似度计算。竹节参药材特征图谱指纹见图4。14批竹节参药材指纹图谱相似度评价结果分别为:0.977,0.920,0.917,0.933,0.929,0.966,0.949,0.898,0.992,0.923,0.901,0.934,0.951,0.927。除样品S8以外,其余样品的相似度均在0.9以上,说明建立的竹节参化学成分指纹图谱具有良好的代表性和专属性,能够用来控制其药材质量。

1.人参皂苷Rg 1;2.人参皂苷Re ;4.人参皂苷Rb 1;6.人参皂苷Ro ;8.竹节参皂苷Ⅳ;10.竹节参皂苷Ⅳa;11.竹节参皂苷Rg 3 图4 竹节参(A)HPLC指纹图谱和对照品色谱图(B)
建立的竹节参特征指纹图谱共形成19个特征峰,通过对照品对比及HPLC-MS/MS推断,指认了10个峰,分别为人参皂苷Rg1(1号峰)、人参皂苷Re(2号峰)、人参皂苷Rb1(4号峰)、人参皂苷Rg2(5号峰)、人参皂苷Ro(6号峰)、竹节参皂苷Ⅳ(8号峰)、竹节参皂苷Ⅰb(9号峰)、竹节参皂苷Ⅳa(10号峰)、人参皂苷Rg3(11号峰)、人参皂苷Rh2(12号峰)。HPLC-MS/MS数据推测结果见表3。
表3HPLC-MS/MS数据推测结果
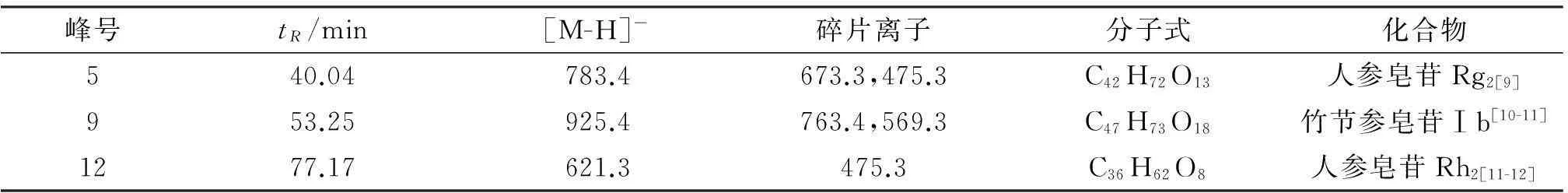
峰号tR/min[M-H]-碎片离子分子式化合物540.04783.4673.3,475.3C42H72O13人参皂苷Rg2[9]953.25925.4763.4,569.3C47H73O18竹节参皂苷Ⅰb[10-11]1277.17621.3475.3C36H62O8人参皂苷Rp[11-12]
4讨论
竹节参为传统名贵中药材,药用价值较高。《中国药典》2010年版中竹节参项下为显微鉴别和以人参皂苷Ro和竹节参皂苷Ⅳa 为指标的薄层鉴别,还未有建立含量测定指标。仅以显微和薄层鉴别不能全面的反映药材的质量差异。笔者采用HPLC法建立了竹节参指纹图谱,共形成19个共有峰,通过对照品比对和HPLC-MS/MS对10个共有峰进行了定性鉴别。还采用相似度评价、聚类分析和主成分分析等分析方法,对不同产地的14批竹节参药材质量进行评价。不同产地的竹节参化学成分相似度较好,但仍然存在着质量差异。本研究对于竹节参药材的质量控制和鉴别提供了依据。但对于建立的指纹图谱中未能指认的共有峰,仍需进行进一步研究。
参考文献:
[1]国家药典委员会.中华人民共和国药典2010 年版(一部)[M].北京:化学工业出版社,2010:129-129.
[2]顿耀艳,袁丁.竹节参化学成分研究进展[J].时珍国医国药,2006,17(10):1909-1902
[3]贾放,陈平,王如锋,周蓉蓉. 竹节参药材不同部位皂苷成分的分析研究[J]. 时珍国医国药, 2012,9:32-34.
[4]鲁道旺,朱国豪.土家族珍稀药材神参(竹节参)的研究概况.中国民族医药杂志.2008,5(5):64-66
[5]Wang R f, Chen P, Jia F,et al.Optimization of polysaccharides fromPanax Japonicus C.A.Meyer by RSM and its anti-oxidant activity .International Journal of Biological Macromolecules,2012,50:331-336.
[6]Wang R f ,Chen P,Jia F,et al.Characterization and antioxidant activities of polysaccharides from Panax Japonicus C.A. Meyer [J]. Carbohydrate Polymers, 2012,88:1402-1406.
[7]欧阳丽娜,吴雪,向大位,等.竹节参化学成分及药理活性研究[J].中草药.2010,41(6):1024-1027.
[8]钱丽娜,陈平,陈新,等.竹节参地上部分中总皂苷成分抗炎镇痛活性[J].中国医院药学杂志,2008,28(20):1731-1733.
[9]Chan H H , Hwang T L, Sun H D .et al.Bioactive Constituents from the Roots of Panax japonicus var.MAJOR and Development of a LC-MS/MS Method for Distinguishing between Natural and Artifactual Compounds [J]. J Nat Prod. 2011,74(4):796-802.
[10]Liu Y,Yang J S,Cai Z W.Chemical investigation on Sijunzi decoction and its two major herbs Panax ginseng and Glycyrrhiza uralensis by LC/MS/MS[J].Journal of Pharmaceutical and Bionmedical Analysis,2006,41:1642-1647.
[11]Chan H H , Hwang T L,Sun H D,et al.Bioactive Constituents from the Roots of Panax japonicus var .MAJOR and Development of a LC-MS/MS Method for Distinguishing between Natural and Artifactual Compounds[J]. J Nat Prod. 2011,74(4):796-802.
[12]Kouichi Y,Hari P D,Shoji Y,et al.Saponins Composition of Rhizomes, Taproots, and Lateral Roots of Satsuma-ninjin (Panax japonicus)[J].Chem.Pharm.Bull. 2013,61(3):344-350.

