Mn(II)在黄土性土壤上的静态吸附研究
郭印丽,李梦耀,张晓松,王莹,张海龙
(1.长安大学 环境科学与工程学院,陕西 西安 710054;
2.长安大学 旱区地下水文与生态效应教育部重点实验室,陕西 西安 710054)
近年来,工业迅速发展的同时也给环境带来了许多不好的影响,各种重金属污染事件保持高发态势,引起了国家的高度重视。锰是环境中的一种痕量重金属元素,在大自然界中多以可溶态的Mn(II)离子和氧化形式的二氧化锰存在。锰也是人体必需的一种元素,但摄入过量的锰会对人体带来严重危害[1-2]。黄土是我国典型的区域性土壤,它质地均一,没有明显的垂直、水平方向相变,各地黄土成分变化不大。想要揭示Mn(II)在黄土性土壤及地下水中的迁移转化规律,就必须了解它在土壤中的吸附特性[3-6]。本文采用静态实验方法研究了Mn(II)在黄土性土壤中的吸附动力学、吸附热力学行为,考察了Na+、Ca2+、Cd2+等3 种阳离子对黄土性土壤吸附Mn2+的影响,实验结果对研究黄土地区锰对土壤及地下水的污染及治理具有指导意义。
1 实验部分
1.1 原料与仪器
供试的黄土性土壤采自于宁夏固原地区某地,是地表10 cm 以下的黄土和沙土,使用前将土壤风干,除去其中的石粒和干草等杂物,过60 目筛;供试土壤的基本矿物成分见表1;硝酸、MnCl2·4H2O 均为分析纯;氯化钠、氯化钙、氯化镉均为化学纯;实验用水为蒸馏水。

表1 供试土壤的基本矿物成分Table 1 Basic mineral component of the soils tested
752 型紫外可见分光光度计;AL204 电子天平;HY-2 型调速多用振荡器;TDL80-2B 型台式离心机。
1.2 Mn(II)储备液(1 g/L)的制备
准确称量3.602 g 的MnCl2·4H2O,加去离子水溶解,并定容至1 L。
1.3 分析方法
1.3.1 Mn(II)分析方法 GB 11906—89 高碘酸盐分光光度法,在实验条件下,测定波长为525 nm,c=(1 542A+0.446)/V (μg/mL)。1.3. 2 静态吸附实验 准确称量供试土样10.00 g,然后置于250 mL 干燥三角瓶中,并加入100 mL 一定浓度的Mn2+溶液,在恒温振荡器上振荡90 min,过滤上清液,测其吸附平衡后溶液中的Mn2+浓度,按下式计算平衡吸附量q。

式中 q——吸附量,μg/g;

2 结果与讨论
2.1 吸附动力学
按静态吸附实验方法进行实验,测定吸附液中不同吸附时间Mn2+的浓度,并计算吸附量,以吸附量为纵坐标,吸附时间为横坐标考察吸附量随时间的变化,结果见图1。
由图1 可知,黄壤TS-1、TS-2 和TM-1 吸附Mn2+的动力学曲线变化趋势几乎相同,0 ~40 min,吸附量随吸附时间的延长而明显增加;40 ~90 min,吸附量随时间增加的趋势变缓,当吸附时间超过90 min以后,吸附量几乎不随吸附时间的变化而变化,达到吸附平衡。为保证吸附平衡,静态吸附实验的振荡时间应达到90 min 以上。

图1 吸附动力学曲线Fig.1 Curve of adsorption kinetic
金属离子在土壤表面吸附常见的动力学方程有:

对图1 数据进行拟合,一级反应式相关系数R2分别为:0.858 4,0.579 2,0.605 0,二级反应式拟合的相关系数R2分别为:0.900 4,0.616 8,0.646 8。土壤对Mn2+的吸附不符合一级、二级吸附模型,Elovich 和双常数方程拟合时得到的结果见表2。

表2 黄土性土壤吸附Mn2+Elovich 和双常数方程拟合结果Table 2 Kinetic models fitting parameters
由表2 可知,黄壤吸附Mn2+的动力学比较符合Elovich 和双常数模型。
2.2 吸附热力学
在室温下,以不同浓度的Mn2+溶液进行吸附实验,3 种黄壤吸附Mn2+等温线见图2。
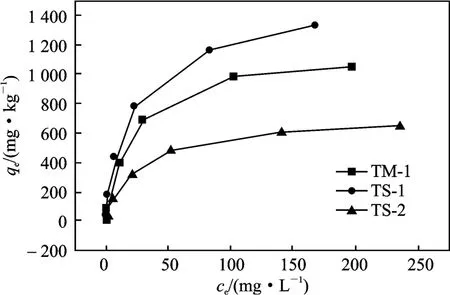
图2 黄壤吸附Mn2+的热力学曲线Fig.2 Curve of adsorption thermodynamics
由图2 可知,黄土TS-1、TS-2 和TM-1 的变化趋势基本相同,但TS-1 的平衡吸附量整体来说比其他两种大。当平衡浓度在0 ~90 mg/L 时,平衡吸附量随吸附平衡浓度的增大而明显增加;90 ~120 mg/L,平衡吸附量随吸附平衡浓度的增加的趋势变缓,当平衡吸附浓度超过120 mg/L 以后,吸附量几乎不随吸附平衡浓度的变化而变化。
金属离子在土壤表面的平衡吸附热力学模型应用最广泛的有线性吸附模型、Langmuir 吸附等温式和Freundlich 吸附等温式等。

由图2 可知,黄壤吸附Mn2+明显不符合线性模型;用Langmuir 吸附等温方程和Freundlich 吸附等温方程对图2 实验数据拟合,结果见表3。

表3 黄壤吸附Mn2+的Langmuir 方程和Freundich 等温吸附方程拟合结果Table 3 Parameters of soils fitted by Langmuir and Freundich isothermal adsorption curves
由表3 可知,Langmuir 和Freundlich 吸附等温式均能在一定程度上近似地描述土壤中Mn2+的吸附热力学规律。根据Freundlich 吸附等温式得出的拟合常数,1/n 均小于1,说明该吸附过程为优惠吸附。Mn2+在黄土性土壤表面的解吸过程不受其它分子的干扰。Mn2+在黄土性土壤中的吸附过程具有一定的可逆性。
2.3 加干扰离子的吸附热力学
在Mn2+溶液中分别加入干扰离子 Na+(NaCl)、Ca2+(CaCl2)、Cd2+(CdCl2)进行吸附实验,有干扰离子存在下的黄壤吸附Mn2+热力学曲线见图3 ~图5。
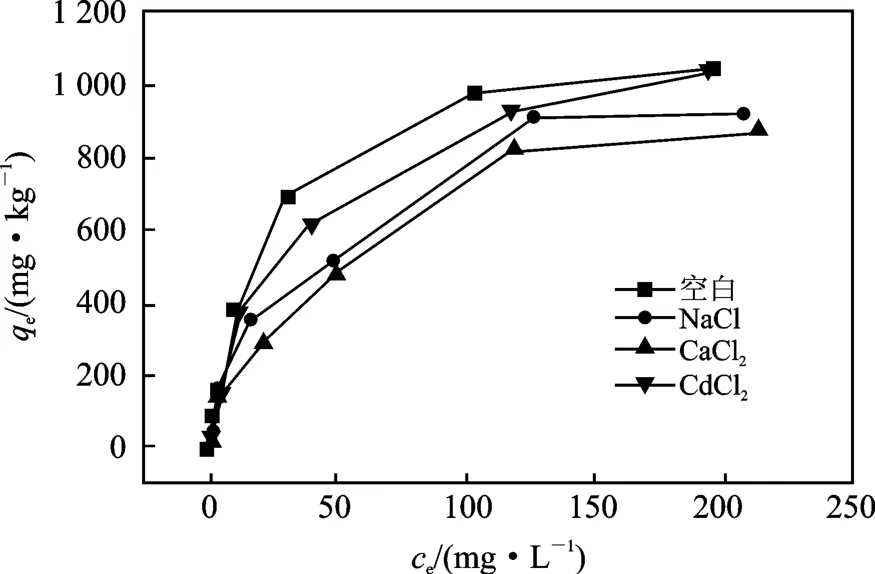
图3 共存离子对TM-1 土壤吸附Mn2+的影响Fig.3 Effects of coexisting ions on the adsorption of loess TM-1

图4 共存离子对TS-1 土壤吸附Mn2+的影响Fig.4 Effects of coexisting ions on the adsorption of loess TS-1
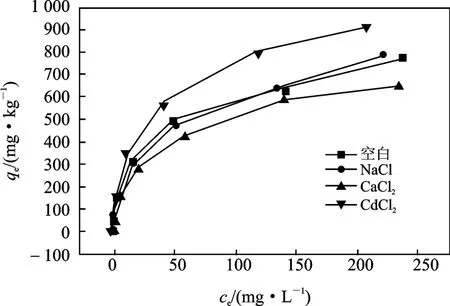
图5 共存离子对TS-2 土壤吸附Mn2+的影响Fig.5 Effects of coexisting ions on the adsorption of loess TS-2
由图3 ~图5 可知,Mn2+溶液中Na+、Ca2+和Cd2+的存在,都会使TM-1 和TS-1 土壤对Mn2+的吸附量产生影响,即使其吸附量减小,其减小的幅度为Ca2+>Cd2+>Na+。然而对于TS-2 土壤来说,虽然氯化隔和氯化钙同样能减小土壤对Mn2+的吸附量,但是减小的幅度较TM-1 而言都有所收敛。Na+干扰的平衡曲线和未加干扰的平衡曲线几乎重叠,这说明对于TS-2 吸附Mn2+几乎不受共存Na+的影响。
3 结论
(1)黄土性土壤吸附Mn2+的动力学研究表明,三种黄土性土壤对二价锰离子的吸附,不符合简单的一级和二级动力学方程,但符合Elovich 和双常数方程;吸附在90 min 内达到平衡。
(2)黄土性土壤吸附Mn2+的热力学过程可用Langmuir 方程和Freundich 方程描述,其中Freundich 等温方程的拟合常数1/n <1,说明吸附过程是优惠吸附;符合Langmuir 方程,说明在黄壤表面Mn2+的吸附主要为单分子层吸附。
(3)Mn2+溶液中共存的Ca2+、Cd2+会使Mn2+吸附量降低,Na+几乎无影响。
[1] Sharma Y C,Um A,Singh S N,et al. Fly ash for the removal of Mn(II)from aqueous solutions and wastewaters[J]. Chemical Engineering Journal,2007,132(1/2/3):319-323.
[2] Tiwari D,Yu M R,Kim M N,et al.Potential application of manganese coated sand in the removal of Mn (II)from aqueous solutions[J]. Water Science and Technology,2007,56(7):153-160.
[3] Verstraete W L.Modeling of the breakdown and the mobilization of hydrocarbons in unsaturated soil layers[C]//Sharpley J M. Kaplan A M. Proceedings of the 3rd international biodegradation symposium. London:Applied Science Pubishers,1976:99-112.
[4] Wang Yan,Tang Xiaowu,Wang Hengyu,et al. Sorption and desorption behaviors of heavy metal Mn(II)on loess soil[J]. Chinese Journal of Geotechnical Engineering,2011,33(S1):369-373.
[5] Li Z Z,Tang X W,Chen Y M,et al.Sorption behavior and mechanism of Pb(II)on Chinese loess[J].Journal of Environmental Engineering,ASCE,2009,135(1):58-67.
[6] Dal Bosco S M,Jimenez R S,Vignado C,et al.Removal of Mn(II)and Cd(II)from wastewaters by natural and modified clays[J].Adsorption,2006,12(2):133-146.

