3型肺炎球菌荚膜多糖结合疫苗的研制
张 涛 孟 欣 朱 涛 刘 正张立平郝杰清(天津科技大学,天津300457)
3型肺炎球菌荚膜多糖结合疫苗的研制
张涛孟欣朱涛刘正①张立平①郝杰清①(天津科技大学,天津300457)
[摘要]目的:研制3型肺炎球菌荚膜多糖-CRM197结合疫苗。方法:将3型肺炎球菌的荚膜多糖与蛋白CRM197通过化学方法偶联结合,制备成多糖蛋白结合疫苗并使用该疫苗免疫幼小鼠。结果:经过实验条件的考察,发现在85℃,0.2 mol/L乙酸水解处理多糖1 h,活化度为10.0,投料比为20∶10时制得的疫苗,在小鼠体内产生了高滴度的抗体。结论:该实验条件下制备的结合疫苗保留了完好的抗原性,以本工艺条件制备3型肺炎球菌荚膜多糖蛋白结合疫苗是可行的。
[关键词]3型肺炎球菌荚膜多糖;结合疫苗;铝佐剂;免疫原性
①天津康希诺生物技术有限公司,天津市呼吸道细菌重组及结合疫苗企业重点实验室,天津300457。
Preparation of Streptococcus pneumonia type 3 capsular polysaccharide conjugate vaccine
ZHANG Tao,MENG Xin,ZHU Tao,LIU Zheng,ZHANG Li-Ping,HAO Jie-Qing.Tianjin University of Science and Technology,Tianjin 300457,China
[Abstract]Objective: To prepare Streptococcus pneumonia type 3 capsular polysaccharide conjugate vaccine.Methods: Streptococcus pneumonia type 3 capsular polysaccharide was covalently linked to protein CRM197 and its immunogenicity was evaluated in infant mice.Results: Through the preliminary research,we found that the polysaccharide was treated with 0.2 mol/L acetic acid at 85℃for 1 h,activation grade reached to 10.0,and the radio of polysaccharide and protein was 20∶10,could induce infant mice to produce the high titers of antibodies.Conclusion: This result shows that conjugate vaccine prepared under this condition retained intact antigenicity.It is applicable to prepare Streptococcus pneumonia type 3 capsular polysaccharide conjugate vaccine by the process conditions.
[Key words]Streptococcus pneumonia type 3 capsular polysaccharide; Conjugate vaccine; Aluminum adjuvant; Immunogenicity
肺炎球菌感染是在全球范围内引起死亡的重要原因之一,且是肺炎、脑膜炎、中耳炎的主要病因[1]。美国有观察资料显示,估计每年有40~50万人患肺炎球菌性肺炎,病死率为5%~10%。在用疫苗可预防儿童死亡的疾病中,肺炎球菌引起的疾病排名第一[2,3]。随着抗菌素的大量使用,耐药菌株与日俱增,医学界再次关注疫苗的研发[4]。研究中发现抗表面的荚膜多糖能够保护机体对抗细菌感染,那么用多糖来制备疫苗的想法自然成形[5,6]。由于多糖是非胸腺依赖性(TI)抗原,再次免疫不能使降低的抗体达到初次免疫的水平,不能诱导免疫记忆细胞的产生,且对婴幼儿和老人几乎没有保护作用,而该年龄段人群是肺炎球菌感染的高危人群。但是将肺炎球菌多糖共价连接到蛋白却使之成为胸腺依赖性(TD)抗原,能够对婴幼儿和老人产生抗体,免疫效果得到提高[7,8]。
2000年惠氏成功研制出7价肺炎结合疫苗,包含血清型4、6B、9V、14、18C、19F和23F,接种PCV7可以预防疫苗所覆盖7种血清型所导致的IPD,约占所有IPD的80%左右。但PCV7不能预防疫苗血清型覆盖之外的其他血清型肺炎球菌的感染[9]。2010年惠氏上市的13价肺炎结合疫苗新增包括3型在内的其他6种血清型[10]。GSK研制的肺炎结合疫苗原本计划中有3型血清型的研究,但是最后上市的10价结合疫苗产品中放弃加入3型血清型。根据亚洲肺炎流行血清型的调查,除了7价包含的7种血清型以外,3型血清型肺炎的发病率很高,达到了6.2%[11,12]。而在我国目前肺炎结合疫苗的接种人群注射还很大程度上依赖于国外产品,成本很高,接种完成要付出几千元的高额费用,使很多潜在患者望而却步,起不到全民预防的作用。所以研究我国肺炎高发流行血清型结合疫苗,形成和国外产品的竞争,解决接种肺炎过程带来的高消费问题,已刻不容缓。
因地域和个体的不同,肺炎高发血清型在各个国家和地区都存在差异。目前国内没有自己正式上市的肺炎结合疫苗产品,所以血清型的工艺路线研究显得格外重要。本实验选取了在亚洲地区发病率很高的3型肺炎血清型进行工艺路线研究。3型多糖是由两个单糖的重复单位组成:→4) -β-D-Glcp-(1→3) -β-D-Glcp A-(1→。活化过程中,活化度的控制至关重要。活化度是多糖和氧化产生的醛基比例关系。活化度太大,氧化的醛基少,不利于蛋白的结合。活化度太小,反应剧烈容易发生交联。结合过程中,投料比、结合比的控制对于结合收率的影响以及免疫原型也至关重要。工艺路线的关键之处在于载体蛋白的选择。本实验选择CRM197作为载体蛋白,CRM197是一种白喉毒素突变体,具有其全长序列,是将其第52位Gly突变为Glu,丧失了毒素的毒性和酶活性,保留了其免疫原性,克服了类毒素作为载体蛋白因为脱毒不彻底会产生毒性的潜在危险性[13]。通过本实验的初步研究,经过长期不同条件的优化,将3型肺炎球菌多糖与CRM197共价偶联,最终能够在小鼠体内引发很好的免疫反应。
1 材料与方法
1.1实验材料3型肺炎球菌多糖、CRM197(天津康希诺生物技术有限公司提供),氰基硼氢化钠(Sigma公司),辣根过氧化物酶标记的山羊抗鼠IgG抗体(Sigma公司),96孔酶标板(通派生物科技有限公司),氢氧化铝佐剂(国药集团化学试剂有限公司)。
1.2实验动物BALB/c小鼠,SPF级;由具有动物生产资格证的繁育基地提供,并附带合格证。实验开始前2~3 d,由具有动物使用资格证的研究单位进行检疫,淘汰检疫不合格动物。动物体重12~14 g;同组幼小鼠体重不超过或不低于同性别动物平均体重的20%。试验用100只,雌性小鼠。
1.3方法
1.3.1 3型肺炎多糖活化由于3型肺炎多糖黏度大,不利于活化,所以使用前,用0.2 mol/L乙酸在85℃水解预处理1 h,减小多糖分子片段,降低分子量,降低黏度,利于活化的进行。温度降低至20℃后加入0.1 mol/L氯化镁。再加入一定量的高碘酸钠氧化多糖,使其在邻位羟基处产生醛基,在23℃下避光反应19 h。反应结束后,通过100 K的膜包用纯化水对活化多糖超滤10次以上。超滤结束后,在超净台用0.22 μm囊式过滤器过滤。然后用0.2 mol/L pH7.0的磷酸缓冲液调节活化多糖pH 至6.5,加入载体蛋白使其慢慢溶解,之后,再加入25倍于3型多糖含量的蔗糖,溶解后倒入平皿冷冻冻干。
1.3.2 3型肺炎多糖和载体蛋白结合取出冻干的多糖和蛋白后,用0.1 mol/L pH7.0的磷酸缓冲液溶解,然后加入7倍醛基含量的氰基硼氢化钠,在37℃下避光反应48 h,反应结束后加入硼氢化钠避光封闭5 h。
1.3.3结合产物的纯化封闭反应结束后,可以取出适量的样品跑胶(SDS-PAGE)初步观察多糖和蛋白的结合结果。然后通过疏水柱纯化去掉未反应的多糖片段,再用纯化水通过100 K膜包超滤10次以上去掉未反应结合的蛋白,得到最后的结合产物。超滤结束后,在超净台下用0.22 μm囊式过滤器过滤,无菌储备。
1.3.4多糖和蛋白的检测采用蒽酮法检测多糖的含量,采用Lowry法检测蛋白含量。测得的多糖含量与蛋白含量的比值即为结合产物中多糖与蛋白的结合比。
1.3.5氢氧化铝佐剂的配制氢氧化铝目标浓度20.32~24.84 g/L。分别配制400 ml 0.658 mol/L氯化铝溶液和1.577 mol/L氢氧化钠溶液,置于65℃水浴锅中保温。加入200 ml纯化水至烧瓶中,搅拌。然后用双头蠕动泵将两种溶液泵入加水的烧瓶中,混匀,继续搅拌30 min。将氢氧化铝佐剂混悬液稀释5倍,混匀,常温下静置待完全分层后,用蠕动泵抽取上清液1 L。用冰醋酸调pH至6.5,且相对稳定。最后121℃灭菌30 min,结束后拧紧瓶盖,室温或2~8℃保存。
1.3.6疫苗的配制样品的缓冲液为生理盐水和5 mmol/L pH5.8琥珀酸(已经121℃,30 min高压灭菌)。每个实验组需准备9 ml样品,3 ml/瓶。其中多糖浓度为5 μg/ml,pH5.8,已经使用0.22 μm滤膜过滤无菌。
1.4疫苗接种
1.4.1免疫分组BALB/c小鼠在动物房饲养2~3 d后挑选检疫合格的小鼠100只,按照检疫期结束时动物体重均衡性原则分组。本实验共设10组,每组10只BALB/c小鼠,雌性,第十组为阴性对照组。
1.4.2免疫流程两周免疫一次,共免疫3次,三免前每只小鼠单独采集二免血,三免结束后采集全血(见表1)。血样处理和测定:取血后将血样立即放入含有肝素钠的Eppendorf管中,温和颠倒几次,水浴中暂存,2 h内低温4℃条件下8 000 r/min离心6 min,分离血清,放置于-20℃保存,避免反复冻融。
1.5 ELISA法检测抗体
1.5.1包被将3型肺炎球菌纯化多糖抗原用包被液稀释至10 μg/ml,每孔加入100 μl包被酶标板,4℃过夜。
1.5.2洗涤弃去包被液,每孔加入洗涤液200 μl,静置洗涤5 min甩干,此过程重复3次,拍干。
1.5.3封闭每孔加入200 μl 1% BSA封闭1 h,同1.5.2过程重复3次后拍干。
1.5.4加样在96孔酶标板上横向加入待测稀释好的血清,每孔100 μl,进行倍比稀释,以1% BSA作为空白对照,37℃孵育1 h,孵育结束后,同1.5.2洗涤3次,拍干。
1.5.5加入酶标抗体每孔加100 μl一定稀释度的辣根过氧化物酶标记的山羊抗鼠IgG抗体,37℃孵育1 h,孵育结束后,同1.5.2洗涤6次后拍干。
1.5.6显色加TMB显色液100 μl,避光显色10~15 min。
1.5.7终止每孔加终止液2 mol/L浓硫酸50 μl终止反应。
1.5.8检测使用酶标仪在450 nm下测定吸光度。
2 结果
2.1高碘酸钠的消耗实验在活化过程中,跟踪观察高碘酸钠随时间的消耗情况。图1是在85℃多糖水解0.5、1.0、1.5 h三个处理条件下在活化反应中高碘酸钠的消耗情况:
图1中可以根据OD280得知NaIO4的浓度。图2中我们可以发现,在初始情况下,水解0.5 h多糖溶液中高碘酸钠OD值最低,水解1.0 h多糖溶液中OD值居中,水解1.5 h多糖溶液中高碘酸钠OD值最高,说明水解时间长的多糖消耗高碘酸钠的能力较弱。随着时间的进行,三条曲线逐渐降低,高碘酸钠逐渐被消耗,在16 h以后OD值基本不再发生变化。所以23℃反应19 h是可行的。
2.2不同高碘酸钠浓度对多糖活化度的影响从图3我们可以看出,随着高碘酸钠浓度的增加,多糖活化表位产生的醛基数量在增加,多糖活化度在随之降低。选取合适的活化度成为活化过程关键所在。
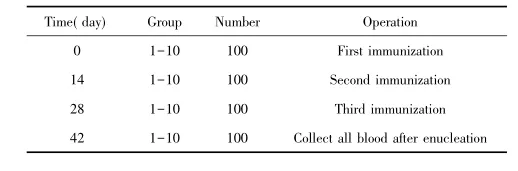
表1 疫苗接种动物实验方案Tab.1 Experiment plan of animal vaccination
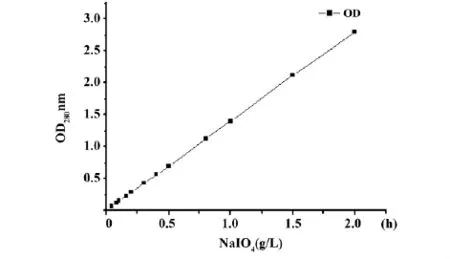
图1 NaIO4浓度和OD280nm的关系曲线Fig.1 Relationship between NaIO4concentration and OD280nm

图2 NaIO4浓度变化和反应时间的关系曲线Fig.2 Relationship between NaIO4concentration and reaction time

图3 高碘酸钠浓度和活化度(DO)走势关系Fig.3 Relationship between NaIO4reaction concentration and DO

图4 活化度对工艺中回收率的影响Fig.4 Relationship between process recovery and DO

图5 不同投料比条件下结合产物SDS-PAGE分析Fig.5 SDS-PAGE analysis of different feed ratio conditions
2.3不同多糖活化度的对比实验从图4可以看出,活化过程中活化度对多糖的回收率没有很明显的差异。在结合过程中,活化度很小的时候,反应剧烈,发生交联,所以回收率处于0点,随着活化度的升高,回收率有升高的趋势。活化度增大,多糖活化的醛基位点就少,不利于蛋白的结合,所以在活化度10以后有个很明显的下降趋势。所以我们初步选择活化度10为最优点。
2.4投料比对结合反应的影响结合反应中,分别加入20∶10、10∶5、15∶5、20∶5、10∶2.5不同投料比的多糖和蛋白,观察初步结果,上样量为10 μg蛋白,如图5所示:胶图泳道上方即为结合产物。从胶图中可以看出投料比20∶10的初步结合情况最好,在60附近的条带较少,几乎没有游离蛋白,而10∶5、15∶5、20∶5的游离蛋白相对较多,10∶2.5的结合产物相对较少,所以结合反应中初步选择20∶10投料比。

表2 不同水解处理结合疫苗免疫原性Tab.2 Immunogenicity of different hydrolysis conjugates

表3 不同活化度结合疫苗免疫原性Tab.3 Immunogenicity of different DO conjugates
2.5多糖不同水解条件对免疫原性的影响在对多糖的预处理中,通过对水解时间和温度的筛选,使用高碘酸钠的氧化,之后与载体蛋白结合,配制成疫苗,考察制备条件对最终免疫原性的影响,免疫实验的结果如表2所示:前四组为不同时间的水解处理,后四组为不同温度的水解处理。前四组可以看到随着在85℃下时间的增加,结合比逐渐降低,但是在1 h的免疫效价最高,达到3.93。选定水解处理时间1 h后,后四组研究不同温度的影响。随着温度的升高,结合比没有明显的变化趋势,免疫原性逐渐升高。85℃和95℃免疫原性几乎没有差别。考虑到对多糖抗原原始分子结构的保护,我们选择85℃下水解处理1 h做为最优条件。
2.6活化度对免疫原性的影响活化实验中,多糖浓度为2 g/L,考察多糖与蛋白结合比对最终免疫原性的影响,免疫的数据如表3所示:可以看出随着活化度的减小,醛基数量的增加,结合比越来越小,结合的蛋白越来越多,并且效价呈现出上升的趋势。免疫原性没有太大区别,都维持在4左右。考虑到多糖原始结构免疫原性,所以我们选择活化度为10左右作为最优活化度。
3 讨论
肺炎荚膜多糖的血清型很多,根据多糖抗原免疫机制的需要、化学性质以及载体蛋白的不同,每种血清型都有适合自己的结合方法。结合疫苗的结合化学主要是指根据荚膜多糖和所选载体蛋白的性质,在保证多糖抗原的抗原决定簇(抗原表位、特异性基团)不被破坏,免疫原性以及免疫反应性不受影响的基础上,选择合适的结合方式进行结合。实质就是通过一定的化学反应或借助连接剂将多糖抗原和载体蛋白连接在一起。多糖的修饰和活化程度,分子量的大小,特异性基团的多少,结合方式,与载体蛋白的结合比例,交联程度,结合产物分子量的大小,结合产物中游离多糖的含量等很多因素都会影响到结合疫苗的免疫原性。因此对工艺步骤的各个阶段进行质量监督是十分必要的。
随着结合疫苗价数和载体蛋白剂量的增加,结合物之间或共免疫抗原之间产生干扰的可能性就越大。解决这一问题需要对免疫干扰的机制进行更深入的研究,应用不同载体来结合荚膜多糖是一种可行的方法。肺炎球菌表面蛋白A (PspA)广泛存在于90多种肺炎球菌的血清型中,在以PspA为载体应用于肺炎结合疫苗中,PspA发挥载体作用的同时,还对肺炎球菌具有免疫保护。这样不仅可以增大血清型的覆盖率,同时也防止在大量的商业疫苗过度使用中由于相同蛋白而引发的免疫应答功能障碍。研究者还以沙门菌为载体,构建了传递多种Pn蛋白抗原的沙门菌疫苗,并证实这种疫苗经口服免疫能诱导保护作用[7,14]。
3型肺炎链球菌在我国属于导致肺炎频率较高的病原体,所以针对地区选择高发血清型进行研究显得格外重要[15]。目前市场肺炎球菌结合疫苗包含的血清型均是参照西方发达国家的流行病学资料,对于其他血清型没有相应的预防作用。地域和个体的不同,血清型的地理分布限制了疫苗发挥的最大作用。发展中国家在疫苗引进及开发过程中还需要进一步完善本地区的流行病学资料,使得所开发的疫苗最大限度的覆盖本地区优势发病血清型,同时密切关注疫苗可能导致肺炎球菌引起疾病的主要血清型发生明显转换,采取更合理的免疫预防策略,达到最佳免疫预防效果。
此外肺炎结合疫苗研究成本较高,使其在发展中国家的应用受到限制。发展中国家的肺炎感染占有很大的比重,要想起到全球预防的作用,降低成本,使其成为绝大多数人可以承担起的商品显得尤为重要,这样才能更好地预防肺炎球菌感染的传播。
本实验选用CRM197作为载体蛋白,通过在水解温度、水解时间、活化度以及投料比四个方面对3型肺炎球菌多糖结合疫苗的探究优化,可以在幼小鼠体内表现出较高的免疫原性,为以后研究多价肺炎结合疫苗奠定了基础。
参考文献:
[1]陆权.儿童肺炎链球菌性疾病的治疗[J].世界临床药物,2012,32(12) : 705-708.
[2]Ronsen JB,Thomas AR,Lexau CA,et al.Geographic variation in invasive pneumococcal disease following pneumococcal conjugate vaccine introduction in the United States[J].Clin Infect Dis,2011,53(2) : 137-143.
[3]Russell F,Mulholl K.Prevention of otitis media by vaccination[J].Drugs,2002,62(10) : 1441-1445.
[4]Sadowy E,Kuch A,Gniadkowski M,et al.Expansion and evolution of the Streptococcus pneumoniae Spain9V-ST156 clonal complex in Poland[J].Antimicrob Agents CH,2010,54(5) : 1720-1727.
[5]Lee CJ,Wang TR,Frasch CE.Immunogenicity in mice of pneumococcal glycoconjugate vaccines using pneumococcal protein carriers [J].Vaccine,2001,19(23) : 3216-3225.
[6]鲜墨,吴忠道.肺炎链球菌感染的流行病学及毒力因子研究进展[J].热带医学杂志,2006,6(6) : 740-742.
[7]白庆瑞,徐飚,孙铁英,等.上海市老年人社区获得性肺炎危险因素的病例-对照研究[J].卫生研究,2007,36 (5) : 587-590.
[8]王剑虹,江丽君.肺炎链球菌疫苗研究进展[J].国际生物制品学杂志,2012,35(1) : 37-40.
[9]Dinleyici EC,Yargic ZA.Pneumococcal conjugated vaccines: impact of PCV-7 and new achievements in the postvaccine era[J].Expert review of vaccines,2008,7(9) : 1367-1394.
[10]Centers for Disease Control and Prevention(CDC) .Licensure of a 13-valent pneumococcal conjugate vaccine(PCV-13) and recommendations for use among children-Advisory Committee Immunization Practices (ACIP ),2010[J].MMWR,2010,59 (9) : 258-261.
[11]Kim SH,Song JH,Chung DR,et al.Changing trend of antimicrobial resistance and serotypes in Streptococcus pneumoniae in Asian countries: an ANSORP study[J].Antimicrob Agents CH,2012,56(3) : 1418-1426.
[12]Song JH,Jung SI,Ko KS,et al.High prevalence of antimicrobial resistance among clinical Streptococcus pneumoniae isolates in Asia(an ANSORP study)[J].Antimicrob Agents CH,2004,48 (6) : 2101-2107.
[13]Giannini G,Rappuoli R,Ratti G.The amino-acid sequence of two non-toxic mutants of diphtheria toxin: CRM45 and CRM197[J].Nucleic Acids Research,1984,12(10) : 4063-4069.
[14]Moffitt KL,Malley R.Next generation pneumococcal vaccines[J].Current Opinion in Immunology,2011,23(3) : 407-413.
[15]Black S,Shinefield H,Fireman B,et al.Efficacy,safety and imunogeni-city of heptavalent pneumococcal conjugate vaccine in children[J].Peditatr Infect Dis,2000,19(3) : 187-195.
[收稿2015-03-25修回2015-04-22]
(编辑倪鹏)
·免疫学技术与方法·
doi:10.3969/j.issn.1000-484X.2015.10.014
通讯作者及指导教师:朱涛(1973年-),男,博士,教授,主要从事疫苗方面的研究,E-mail: tao.zhu @ cansinotech.com。
作者简介:张涛(1990年-),男,主要从事肺炎结合疫苗方面的研究,E-mail: 993065503@ qq.com。
文章编号1000-484X(2015) 10-1361-05
文献标志码A
中图分类号R186.3