帕瑞昔布钠及甲基强的松龙对CCI模型大鼠神经病理性疼痛的影响
吴文峰 尧永华 江 涛 刘威力 付文婷
(广州医科大学附属肿瘤医院麻醉科,广东广州510095)
神经病理性疼痛是由于外周或中枢神经系统受到直接损伤或功能紊乱引起的,疼痛在损伤修复后仍长期存在。其特征为自发性疼痛、痛觉过敏、异常性疼痛[1]。此外,其他疾病也可影响周围神经功能而导致神经病理性疼痛,如糖尿病、AIDS或肿瘤等。一直以来神经病理性疼痛机制不明确,缺乏有效治疗手段。近年研究发现,TNF-α可能参与了神经病理性疼痛的发生发展,但其确切机制目前仍不清楚[2]。也有研究发现,CCI术后可大鼠脊髓背角NF-κB活化并致TNF-α的表达上调,从而调控神经病理性疼痛的过程[3]。
帕瑞昔布钠是一种新型非甾体抗炎药,其镇痛机制是通过外周和中枢作用,选择性的抑制COX-2,减少前列腺素的生物合成;消除外周损伤周围的炎症因子;抑制中枢的COX-2上调,抑制中枢痛觉超敏,兼有抗中枢和外周敏化作用。甲基强的松龙是一种人工合成的糖皮质激素类免疫抑制剂,目前广泛用于中枢神经损伤急性期的治疗,其机制与抑制脂质过氧化反应,减少髓鞘变性,以及抑制炎症反应,降低TNF-α,从而保护神经元有关[4]。帕瑞昔布钠及甲基强的松龙是临床上治疗疼痛及缓解炎症反应的常用药物,其药物本身具有抑制TNF-α等作用[5,6]。因此,本研究通过观察帕瑞昔布钠与甲基强的松龙治疗后 NF-κB、TNF-α和 IL-1β表达的变化,探讨其作用机制是否与NF-κB信号转导有关,为神经病理性疼痛的防治提供新的理论依据。
1 材料与方法
1.1 实验动物及分组
180~220 g成年雄性SD大鼠40只,由中山大学北校区实验动物中心提供,分笼饲养,室温维持在(22±1)℃,室内相对湿度(65±5)%,按照大鼠的昼夜节律在每天7:00 AM-7:00 PM维持光照。随机分为假手术组(S组,n=8)、手术对照组(C组,n=8)、帕瑞昔布纳组(P组,n=8)、甲基强的松组(M组,n=8)、帕瑞昔布纳 +甲基强的松组(PM组,n=8)。为尽量减轻动物在实验中的痛苦,实验步骤均按照实验动物的相关使用原则操作。
1.2 慢性坐骨神经挤压损伤模型(CCI)的建立
参照 Bennett等[7]创建的办法,10%水合氯醛(300 mg/kg)腹腔注射麻醉后,剃除大鼠左大腿毛,0.5%氯已定消毒,于股骨外侧纵行切开皮肤,钝性分离肌肉,暴露坐骨神经,在接近分叉前游离出约7 mm的神经,在显微镜下用4-0铬制肠线松扎4处,间隔为1 mm,以不响神经外膜的血运为原则,结扎时可见肢体轻微抽动,然后逐层缝合。假手术组仅暴露坐骨神经干,不予结扎。
1.3 各组大鼠的处理
从模型建立后第3天开始,P组给予帕瑞昔布钠10 mg/kg(生理盐水稀释到1 mL)腹腔注射,M组予甲基强的松30 mg/kg(生理盐水稀释到1mL)腹腔注射,PM组予帕瑞昔布钠10 mg/kg+甲基强的松30 mg/kg(生理盐水稀释到1 mL)腹腔注射,S组和C组给予生理盐水1 mL腹腔注射。
1.4 行为学测试
于测试前1周把大鼠放于测试箱内20 min,隔天1次,共3次,让大鼠熟悉测试环境。建立模型手术前1 d 测基础痛阈,术后 1、3、5、7、10、14 d 腹腔给药1次,30 min后测痛阈。测定机械缩足反射阈值(MWT):将大鼠置于透明的有机玻璃箱(22 cm×12 cm×22 cm)中,底部铁丝网孔径为0.5 cm×0.5 cm。测试前先适应15 min。以不同折力的von Frey细丝分别刺激大鼠足底外侧缘。从2.0 g开始,以up and down法推测阈值,在阈值上下各刺激 5次,用内推法算出50%反应阈值(即引起5次试验中2.5次反应的值)。最大折力为15 g,大于此值时记为15 g。每次测试至少间隔15 s,并等刺激引起的行为反应(如舔足等)完全消失后再给予下一次刺激。
1.5 Western Blot法检测 TNF-α、IL-1β 和 NF-κB
于术后14 d测痛后,10%水合氯醛(300 mg/kg)腹腔注射麻醉大鼠,分离L4~L6脊髓,放入预冷的组织蛋白裂解液中,超声匀浆机冰上匀浆,4℃离心机12 500 r/min离心60 min,取上清蛋白溶液-70℃保存。Bradfold方法测定蛋白浓度。取50 μg蛋白在8%SDS-PAGE胶上电泳分离,之后转印至硝酸纤维素膜上。用5%脱脂奶粉封闭2h,在4℃条件下分别用1∶500倍稀释的兔抗鼠TNF-α、1∶500倍稀释的兔抗鼠 NF-κB、1∶500倍稀释的兔抗鼠 IL-1β、1∶500倍稀释的羊抗鼠 β-actin(美国 Sigma公司)孵育1 h,TBST溶液洗膜3次后,用 1∶500稀释的辣根过氧化酶标记的羊抗兔及兔抗羊IgG第二抗体,室温水平摇床上孵育 2 h,用 TBST溶液洗膜 3次后行增敏二氨基联苯胺(DAB)显色。
1.6 统计学方法
应用SPSS11.0统计软件进行分析,计量资料以±s表示,组内采用重复测量资料的方差分析,组间采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠左后足MWT变化
CCI术前1 d测基础值,各组比较,差异无统计学意义(P>0.05)。CCI术后,S组大鼠MWT变化差异无统计学意义(P>0.05),其他各组大鼠机械痛阈值逐天下降,提示触觉痛产生。PM组、M组及P组大鼠MWT从第三天开始明显升高(P<0.05),14 d PM组用药后MWT基本恢复正常,与S组比较,差异无统计学意义(P>0.05)。P组、M组和PM组与C组比较,MWT明显升高(P<0.05);PM组MWT明显比P组和M组高(P<0.05),而P组MWT比M组高(P<0.05)。 见图1。
2.2 各组大鼠脊髓TNF-α的表达
C组手术侧TNF-α表达水平明显高于其余各组(P<0.05);PM组明显低于P组、M组(P<0.05),PM组和S组比较,差异无统计学意义(P<0.05);P组和M组均明显高于S组(P<0.05);P组明显低于M组(P<0.05)。 见图2。
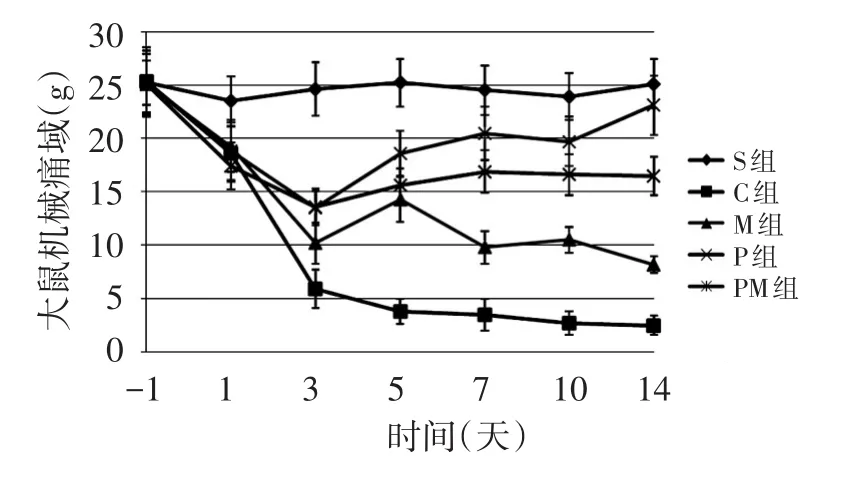
图1 各组大鼠不同时相点MWT值
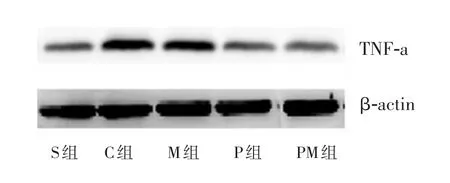
图2 各组手术侧脊髓TNF-α表达结果
2.3 各组大鼠脊髓IL-1β表达
各组手术侧IL-1β表达水平比较,差异均无统计学意义(P>0.05),见图3。
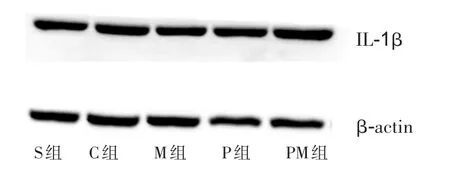
图3 各组手术侧脊髓IL-1β表达结果
2.4 各组大鼠脊髓NF-κB表达
C组手术侧NF-κB表达水平明显高于其余各组(P<0.05);PM组明显低于P组、M组(P<0.05),PM组和S组比较,差异无统计学意义;P组和M组均明显高于S组(P<0.05);P组明显低于M组(P<0.05)。见图4。
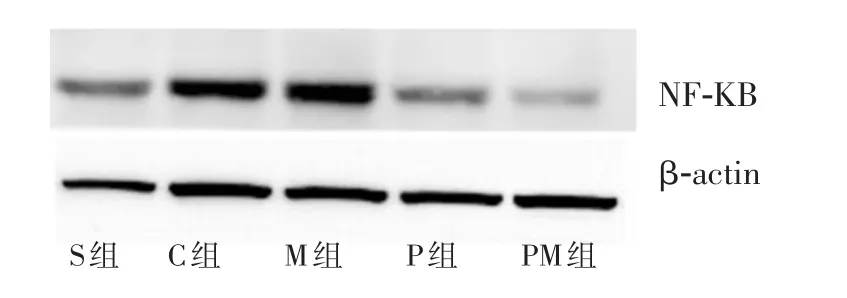
图4 各组手术侧脊髓NF-κB表达结果
3 讨 论
本研究中所用的CCI模型是依照Bennette等[7]的方法建立的。该模型优点是与临床神经病理性痛特点相似,选择性的使粗的有髓鞘纤维损伤,但大部分传递疼痛的C类纤维仍保留。疼痛产生的机制是由轴突损伤导致异位放电和结扎线引起的炎性反应共同引起的。因此该模型具有神经病理性痛和炎性痛的结合。本研究中,CCI术后3 d,除S组外其余各组大鼠机械痛域均出现明显下降,说明了大鼠的CCI模型是建立成功的。
核转录因子κB(NF-κB)是一种具有多向性转录激活功能的调节因子,能够调控编码多种疼痛相关因子 (如 NO、TNF-α、IL-1β、IL-6)的表达。 在中枢神经系统的神经塑形、神经发育及神经变性等过程中,NF-κB信号转导系统起着独特的作用。外周神经损伤后,在损伤神经和背根神经处NF-κB被激活,参与神经病理性疼痛的启动和发展[8]。而TNF-α是NF-κB信号转导通路中重要的促炎性细胞因子,它参与了神经病理性疼痛的调控。TNF-α的启动子中有NF-κB的结合位点,激活的TNF-α可以诱导NF-κB活化[9],然后调控其通路下游疼痛相关因子的表达,导致中枢痛敏的形成[10]。有研究表明,在坐骨神经周围注射重组大鼠 TNF-α(rrTNF-α)可导致机械性触诱发痛,而鞘内注射NF-ΚB抑制剂可明显减轻上述症状[11]。Ohtori等[12]发现在CCI小鼠的坐骨神经TNF-α通过其自身受体使细胞间黏附分子-1(ICAM-1)的表达上调。ICAM-1的表达上调可以导致外周神经损伤引起的沃勒变性的炎性细胞聚集。同时,华勒氏变性会引起TNF-α生成,并通过NF-κB途径引起感觉神经元的损伤[12,13]。
本研究中PM组用药后14 d MWT基本恢复正常,与S组比较,差异无统计学意义(P>0.05)。而帕瑞昔布钠和甲基强的松龙单独应用,效果不如两药联合应用,帕瑞昔布钠效果比甲基强的松龙好。说明帕瑞昔布钠和甲基强的松龙联合应用能明显抑制中枢痛敏的形成,抑制外周炎性细胞的聚集。而IL-1β在各组大鼠中的表达均无明显的差别。说明帕瑞昔布钠和甲基强的松龙对疼痛的抑制,主要是通过NF-κB调控TNF-α的表达而不能抑制IL-1β的表达。通过实验结果,我们推出其机制可能为:外周神经损伤导致炎性细胞聚集从而导致TNF-α生成,激活的TNF-α诱导 NF-κB活化,NF-κB信号转导通路激活,又导致大量疼痛相关因子的表达。帕瑞昔布钠和甲基强的松龙通过抑制炎性因子的释放,阻断NF-κB信号转导通路激活而发挥治疗作用。
综上所述,帕瑞昔布钠及甲基强的松龙能减轻大鼠神经病理性疼痛,两药合用能缓解大鼠的神经病理性疼痛。其机制可能是抑制脊髓背角的NF-κB的激活及其下游炎性因子TNF-α释放有关。
[1]庄 宇,肖礼祖,张德仁.病理性疼痛的发生发展机制[J].实用疼痛学杂志,2009,5(3):224-230.
[2]钟 敏,曾因明,柳垂亮,等.脊髓TNF-α、IL-1β和 IL-6在神经病理性疼痛过程中的表达变化[J].中国疼痛医学杂志,2010,16(1):42-44.
[3]张 丽,傅志俭,孙 涛,等.神经病理性疼痛大鼠脊髓背角NF-κB及其下游肿瘤坏死因子α表达的变化[J].中华医学杂志,2010,90(15):1067-1071.
[4]Cerqueira SR,Oliveira JM,Silva NA,et al.Microglia response and in vivo therapeutic potential of methylprednisolone-Loaded dendrimer nanoparticles in spinal cord injury[J].Small,2013,9(5):738-749.
[5]岳晓敏,程 桥.帕瑞昔布钠对切口痛大鼠脊髓TNF-α表达的影响[J].中国医疗前沿,2011,6(20):571-573.
[6]Shaik IH,AgarwalHK,ParangK,etal.Hepatic immunosuppressive effectsofsystemically administered novel dextran–methylprednisolone prodrugs with peptide linkers in rats[J].J Pharm Sci,2012,101:4003-4012.
[7]Bennett GJ,Xie YK.A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man[J].Pain,1988,33(1):87-107.
[8]Ma W,Bisby MA.Increased activation of nuclear factor kappa B in rat lumbar dorsal root ganglion neurons following partial sciatic nerve injures[J].Brain Res,1998,797(2):243-254.
[9]Smith D,Tweed C,Fernyhough P,et al.Nuclear factorkappaB activation in axons and Schwann cells in experimental sciatic nerve injury and its role in modulating axon regeneration:studies with etanercept.[J].J Neuropathol Exp Neurol,2009,68(6):691-700.
[10]Myers RR,Campana WM,Shubayev VI.The role of neuroinflammation in neuropathic pain:mechanisms and therapeutic targets[J].Drug Discov Today,2006,11(1-2):8-20.
[11]Wei XH,Zang Y,Wu CY,et al.Peri-sciatic administration ofrecombinantratTNF-alpha induces mechanical allodynia via upregulation of TNF-alpha in dorsal root ganglia and in spinal dorsal horn:the role of NF-kappa B pathway[J].Exp Neurol,2007,205(2):471-484.
[12]Ohtori S,Takahashi K,Moriya H,et al.TNF-alpha and TNF-alpha receptor type 1 upregulation in glia and neurons after peripheral nerve injury:studies in murine DRG and spinal cord[J].Spine,2004,29(10):1082-1088.
[13]Sch fers M,Schmidt C,Vogel C,et al.Tumor necrosis factor-alpha(TNF)regulates the expression of ICAM-1 predominantly through TNF receptorlafter chronic constriction injury of mouse sciatic nerve[J].Acta Neuropathol,2002,104(2):197-205.

