沙门氏菌和金黄色葡萄球菌3种DNA提取方法的比较
颜 瑛,罗玉彬,王文娟,潘 影,万承波 (江西省产品质量监督检测院,江西南昌330029)
沙门氏菌和金黄色葡萄球菌是食物中毒中常见的致病菌。沙门氏菌是革兰氏阴性杆菌,无荚膜和芽孢,除雏沙门氏菌、鸡伤寒沙门氏菌外绝大多数有鞭毛能运动[1],菌体溶解时,其细胞壁所含的脂多糖释放出来,形成内毒素[2],易引起伤寒、急性肠胃炎、菌血症和败血症等疾病[3]。资料统计显示,我国70% ~80%的食物中毒由沙门氏菌引起[4]。金黄色葡萄球菌是革兰氏阳性菌,能产生较多的毒素和酶等毒力因子,引起包括食物中毒、化脓性炎症、败血症、假膜性肠炎等疾病[5]。金黄色葡萄球菌细胞壁较厚,90%以上金黄色葡萄球菌含有葡萄球菌蛋白A,有些金黄色葡萄球菌自身还分泌一种耐热核酸酶的蛋白质可以降解核酸[6],DNA提取难度大。目前,我国国家标准中传统的沙门氏菌和金黄色葡萄球菌的检测方法需5~7 d[7-8],费时耗力且繁琐。分子生物学技术因其高灵敏度、高特异性、高通量等特点,已广泛应用于食源性致病菌检测技术的研究和开发,而基因组DNA的质量直接关系到PCR及其他分子生物学试验结果,笔者比较了沙门氏菌和金黄色葡萄球菌不同的DNA提取方法,获得了一种适用于沙门氏菌、金黄色葡萄球菌及其他病原菌的有效提取方法,为进一步的分子生物学试验奠定基础。
1 材料与方法
1.1 菌株 鼠伤寒沙门氏菌(CMCC 50013-8)、金黄色葡萄球菌(CMCC 26001-2d),购自中国医学微生物菌种保藏中心。
1.2 试剂和培养基 TE(10 mmol/L Tris.Cl,1 mmol/L EDTA,pH 8.0);10%SDS;饱和酚∶氯仿∶异戊醇(25∶24∶1);氯仿∶异戊醇(25∶24∶1);氯化钠(5 mol/L);醋酸钠(3 mol/L);50×TAE;EB溶液;蛋白酶K(20 mg/ml);溶葡萄球菌酶(1 mg/ml);溶菌酶(50 mg/ml);RNase(10 mg/ml);DNA Marker;琼脂糖;LB培养基。所有试剂按文献[9]配制。
1.3 主要设备 Mastercycler nexus型 PCR仪(Eppendorf,Germany)、GelDoc XR+BIO-RAD凝胶成像系统(Bio-Rad,USA)、Nanodrop-1000全波长紫外/可见光扫描分光光度计(Thermo Scientific,USA)。
1.4 菌种培养方法 将沙门氏菌、金黄色葡萄球菌分别在平板上划线分离,挑取单菌落,接种于灭菌的LB液体培养基中,37℃振荡培养过夜。
1.5 基因组DNA提取 方法1:取1 ml菌悬液于1.5 ml离心管,12 000 r/min离心2 min去上清,用TE洗涤沉淀,加300 μl TE,金黄色葡萄球菌加溶葡萄球菌酶(1 mg/ml)10 μl,37 ℃ 作用 30 min;加 30 μl 10%SDS 和蛋白酶 K(20 mg/ml)3 μl,55℃水浴1 h;加入等体积的饱和酚∶氯仿∶异戊醇(25∶24∶1)混匀,10 000 r/min 离心5 min 取上清;加入等体积的氯仿∶异戊醇(24∶1)混匀,10 000 r/min离心5 min取上清;加入0.1倍体积3 mol/LNaAc和2倍体积的冰无水乙醇混匀,-20℃静置30 min,离心去上清,沉淀用70%乙醇洗涤,于通风橱中自然干燥后加50 μl ddH2O溶解,储存备用。
方法2:取1 ml菌悬液于1.5 ml离心管,12 000 r/min离心2 min去上清,用TE洗涤沉淀,加300 μl TE,金黄色葡萄球菌加溶葡萄球菌酶(1 mg/ml)10 μl,37℃作用30 min;加30 μl 10%SDS 和蛋白酶 K(20 mg/ml)3 μl,55 ℃水浴1 h;取出置于沸水浴中高温煮沸15 min,12 000 r/min离心2 min,取上清保存备用。
方法3:取1 ml菌悬液于1.5 ml离心管,12 000 r/min离
心2 min去上清,用TE洗涤沉淀,加465 μl TE,加溶菌酶(50 mg/ml)4 μl、溶 葡 萄 球 菌 酶 (1 mg/ml)10 μl、RNase(10 mg/ml)1 μl,0 ℃作用 1 h,期间间隔摇晃几次;取出放置-20℃冰箱20 min,立即放入68℃水浴10 min,加入10%SDS 53 μl,68 ℃ 水浴 15 min,加入 5 mol/L 氯化钠 87 μl、CTAB/NaCl(1%CTAB,0.73 mol/L NaCl)69 μl,68 ℃水浴15 min,放置-20℃冰箱30 min,取出加入等体积的饱和酚∶氯仿∶异戊醇(25∶24∶1)混匀,10 000 r/min 离心 5 min 取上清;加入等体积的氯仿∶异戊醇(24∶1)混匀,10 000 r/min离心5 min取上清;最后用2倍体积的冰无水乙醇混匀,放置-20℃冰箱30 min,离心去上清,沉淀用70%乙醇洗涤,于通风橱中自然干燥后加50 μl ddH2O溶解,储存备用。
1.6 DNA浓度和纯度的测定 采用全波长紫外/可见光扫描分光光度计对提取的DNA进行浓度测定,并在波长230、260、280 nm 处测量吸光值,计算 A260/A230、A260/A280进行纯度评估。
1.7 DNA模板电泳 提取的DNA凝胶电泳、EB染色后利用凝胶成像系统检测比较[9]。
1.8 PCR扩增 针对沙门氏菌选择相对保守的invA基因设计引物:正向引物5'-tcatcgcaccgtcaaaggaac-3',反向引物5'-gtgaaattatcgccacgttcggg-3',理论扩增长度为284 bp;针对金黄色葡萄球菌nuc基因设计引物:正向引物5'-aaagggcaatacgcaaagaggt-3',反向引物 5'-ctttagccaagccttgacgaac-3',理论扩增长度为484 bp[10]。2 种细菌的扩增均采用降落 PCR[11],扩增条件:94℃预变性4 min;随后94℃变性30 s,68℃退火(每个循环降0.5℃)30 s,72℃延伸45 s,26个循环;然后94℃变性30 s,55 ℃退火30 s,72℃延伸45 s,14个循环,最后再72℃延伸10 min,所得PCR扩增产物凝胶电泳检测。
2 结果与分析
2.1 3种不同方法提取的DNA结果与分析 由表1可知,从浓度来看,方法3提取的DNA浓度最高,方法1次之,方法2最低。从纯度来看,方法1和方法3提取的DNA都较好,A260/A280均在1.8 ~2.0,而方法 2 提取的 DNA 低于 1.8;方法1和方法3提取的DNA A260/A230均大于2.0,而方法2提取的DNA低于2.0。
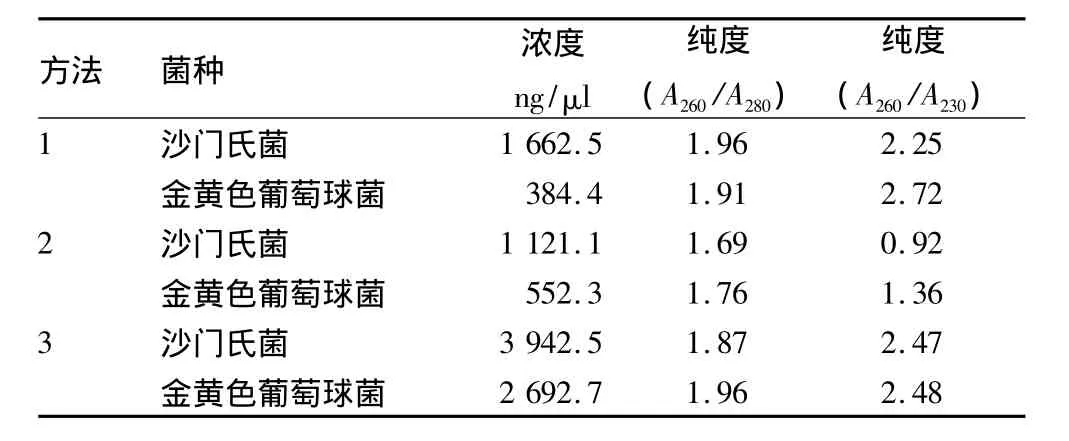
表1 3种不同方法提取DNA的浓度和纯度
由图1可知,DNA模板电泳的结果也与全波长紫外/可见光扫描分光光度计检测结果相印证,方法3提取的DNA模板含量最高,条带最亮,方法1次之,而方法2的条带几乎看不见。因此,综合考虑DNA模板的浓度和纯度,选择方法3作为最佳提取方法。
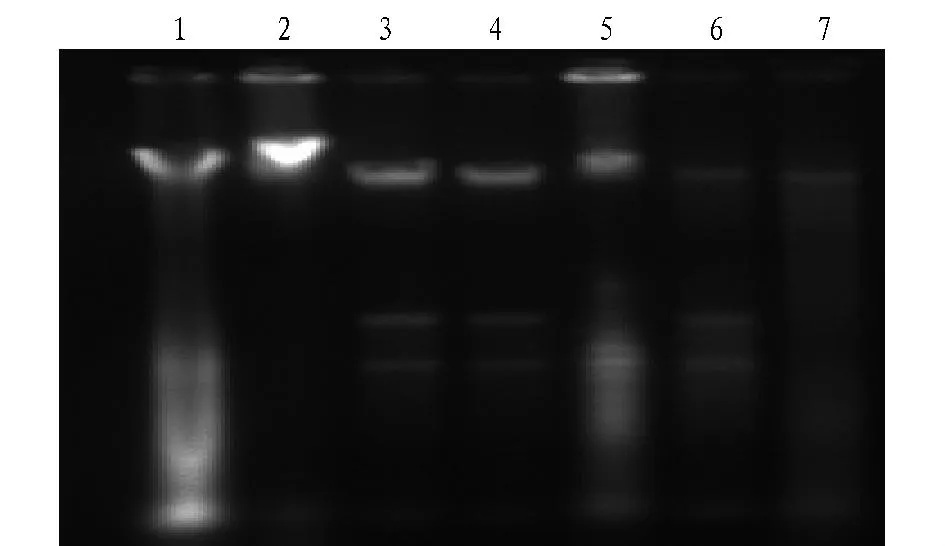
图1 DNA模板电泳结果
2.2 PCR扩增结果 应用方法3提取的沙门氏菌和金黄色葡萄球菌经过PCR扩增都得到了目标片段,表明方法3提取的DNA可用于分子生物学方面的研究(图2、3)。
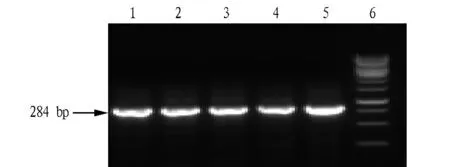
图2 方法3提取的沙门氏菌DNA PCR扩增结果
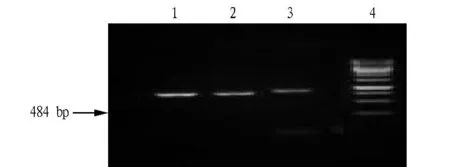
图3 方法3提取的金黄色葡萄球菌DNA PCR扩增结果
3 讨论
目前,细菌DNA提取的方法有很多,如CTAB法、SDS法、高温煮沸法、试剂盒法、酶解法、chelex-100树脂法[12]等,每个方法各有优劣。从经济实用的角度出发,该研究选择3种提取方法对沙门氏菌和金黄色葡萄球菌基因组DNA提取效果进行比较。
考虑到溶菌酶对于金黄色葡萄球菌这样典型的革兰氏阳性菌DNA提取效果不佳[13],因此金黄色葡萄球菌DNA提取选择溶葡萄球菌酶破除细胞壁来释放细胞内DNA。
核酸在波长260 nm处有最高吸收峰,蛋白质的吸收高峰在280 nm波长处,而碳水化合物的吸收高峰在230 nm波长处。A260/A280可进行核酸样品纯度评估:纯DNA的A260/A280为1.8,纯 RNA 为 2.0。如果比值低于 1.8,表示受到蛋白(芳香族)或酚类物质的污染,需要纯化样品,如果比值高于2.0,表示受到RNA污染,同样要进行纯化。A260/A230也可进行核酸样品纯度评估:纯DNA和 RNA的A260/A230为2.5。若比值小于2.0表明样品被碳水化合物、盐类或其他小分子物质污染,需要纯化样品。
该研究中,方法2操作简便、时间短,但提取的纯度和浓度明显偏低,虽然利用SDS和蛋白酶K来去除蛋白质,但高温煮沸后并没有去除杂质的过程,所以在利用全波长紫外/可见光扫描分光光度计测定纯度时得到的结果不够理想,从谱图上可看到在230波长处有明显的吸收峰,A260/A230比值偏低,表明受到碳水化合物、盐类或其他小分子物质污染,这与牟恺[14]的结果一致。方法1在方法2的基础上增加了用氯仿/异戊醇的除杂过程,再加上用乙醇来沉淀核酸,纯度比方法2提高,但金黄色葡萄球菌也因为增加试验步骤导致DNA损耗而浓度稍下降,且方法2和方法1因为没有去除RNA的过程,所以在图1的电泳图谱也可以看到有RNA条带。方法3中增加溶菌酶与溶葡萄球菌酶协同破除细胞壁,用RNase来降解RNA,后续再增加CTAB/NaCl等除杂过程,得到的DNA浓度高,纯度好,采用PCR扩增试验也得到了目的片段,表明方法3提取的DNA对PCR扩增无抑制作用,适用于其他分子生物学操作。
沙门氏菌是典型的革兰氏阴性菌,金黄色葡萄球菌是典型的革兰氏阳性菌,该研究为病原菌高质量的DNA提取提供了解决方案,从而为后续的基因操作和快速检测技术奠定基础。
[1]王德宁.鸡源沙门氏菌耐药性、致病性与毒力基因相关性分析[D].哈尔滨:东北农业大学,2014.
[2]陈杖榴.兽医药理学[M].2 版.北京:中国农业出版社,2004.
[3]王学硕,崔生辉,邢书霞,等.餐饮食品中沙门氏菌的危害分析、污染调查与防控[J].中国药事,2013,27(9):974 -979.
[4]曾晓芳.畜产品中沙门氏菌污染的检测与控制[J].四川畜牧兽医,2003,30(4):28 -29.
[5]FRANKLIN D,LOWY M D.Staphylococcus aureus infections[J].N Engl J Med,1998,339(8):520-532.
[6]唐俊妮.金黄色葡萄球菌耐热核酸酶相关基因的功能与特征分析[D].武汉:华中农业大学,2007.
[7]中华人民共和国卫生部.食品微生物学检验沙门氏菌检验:GB 4789.4-2010[S].北京:中国标准出版社,2010.
[8]中华人民共和国卫生部.食品微生物学检验金黄色葡萄球菌检验:GB 4789.10 -2010[S].北京:中国标准出版社,2010.
[9]J萨姆布鲁克,D·W·拉塞尔.分子克隆实验指南[M].黄培堂,译.3版.北京:科学出版社,2002.
[10]牟恺,陈智,王春民,等.同时检测四种病原菌的PCR方法研究[J].山东农业大学学报(自然科学版),2010(2):253-257.
[11]李玉恒,赵明慧,赵紫阳,等.利用梯度PCR和降落PCR扩增CIRP基因的比较[J].黑龙江八一农垦大学学报,2011(5):46 -49,75.
[12]钱雪琴,张军,沈芳.Chelex-100法和碱性裂解法提取细菌DNA的比较[J].中国卫生检验杂志,2008(8):1565-1566.
[13]任晓东,李一松,姜毓君.优化金黄色葡萄球菌基因组DNA的提取方法[J].东北农业大学学报,2009,40(1):92 -96.
[14]牟恺.同时检测四种病原菌的PCR方法的研究[D].泰安:山东农业大学,2009.

