具有漆酶活性细菌的鉴定及芽孢漆酶对染料脱色的研究
苏诗茜,孙海琼,刘少楠,苏秋钰,崔岱宗*
(1.黑龙江省实验中学,黑龙江哈尔滨150001;2.东北林业大学,黑龙江哈尔滨150040)
漆酶(EC 1.10.3.2)是一种多铜氧化酶,能够将氧气还原为水,同时介导芳环化合物的氧化。漆酶对底物的特异性低,能氧化多种污染物,在废水处理和生物修复方面具有很大的潜力[1]。工业生产的条件比较苛刻。在高温、极酸或极碱的环境下[2],要求有极高稳定性的漆酶。与细菌漆酶相比,虽然真菌漆酶氧化还原能力较强,产量较高[3],但是其稳定性比较低,pH范围比较窄,而且活性易受盐溶液的影响[4]。近年来,细菌漆酶以其固有的热和碱性pH稳定性作为具有潜力的生物催化剂而被广泛研究[5]。
染料被应用于纺织、皮革、医药、化妆品和塑料工业。大多数染料由于其复杂的化学结构而具有毒性,并且不易被降解。工业上的染料废水对人类的健康有很大的危害[6]。采用生物酶法处理染料废水比采用物理、化学方法处理具有节约成本的优势[7]。漆酶能使多种合成染料脱色[8],对环境污染的治理具有潜在的意义。笔者从东北林业大学实验林场的土壤中分离出一株具有漆酶活性的新菌株。它对三苯甲烷类和蒽醌类染料具有较高的脱色率。
1 材料与方法
1.1 材料 菌株10`ZS由从东北林业大学实验林场樟子松林下的土壤中分离。
1.2 方法
1.2.1 菌株10`ZS的形态学及生理生化反应特性。菌株10`ZS的革兰氏染色和糖类分解、明胶液化及硝酸盐还原等生理生化特性测定方法见参考文献[9]。
1.2.2 菌株10`ZS的16S rDNA序列分析及系统发育树的构建。细菌的16S rDNA通用引物27F:5`-GAGTTTGATCMTGGCTCAG-3`(M=A+C)和1492R:5`-TACGGYTACCTTGTTACGACTT-3`(Y=C+T)[10],由华大基因公司合成。以CTAB法提取的菌株10`ZS的总DNA为模板进行PCR反应,20 μl反应体系组成为:10 ×Taq反应缓冲液2 μl,10 mmol/L的 dNTP 0.4 μl,5 μmol/L 的上、下游引物各 4 μl,3 U/μl的Taq DNA 聚合酶 0.2 μl,DNA 模板1 μl,ddH2O 8.4 μl。反应条件为:94℃预变性5 min,94℃变性30 s,58℃退火45 s,72℃延伸90 s,循环30次,72℃延伸10 min。
扩增产物经浓度1.0%琼脂糖凝胶分离后,对扩增片段进行回收,将回收的目的片段与pMD18-T Simple载体连接,转化大肠杆菌DH5α感受态细胞,挑取阳性转化子,进行菌落PCR鉴定,将阳性转化子送华大基因公司对菌株10`ZS的16S rDNA进行测序分析。将测序结果在NCBI上进行BLAST分析,选取同源性较高的序列,利用Clustal X软件进行多序列比对,用Phylip软件的最大简约法构建系统发育树。
1.2.3 菌株生长特性的研究。将菌株10`ZS分别在25、30、35和40℃条件下培养12 h,测定菌液的OD600,研究温度对菌株生长的影响。将菌株10`ZS在 pH 分别为5.0、6.0、7.0和8.0的条件下培养12 h,测定菌液的OD600,研究pH对菌株生长的影响。将菌株10`ZS分别接种到质量分数为1%、2%、4%和6%NaCl的LB培养基中,培养12 h,测定菌液的OD600,研究NaCl溶液对菌株生长的影响。将菌株10`ZS分别接种到 Cu2+浓度为 0、0.2、0.4 和 0.6 mmol/L 的 LB 培养基中,培养12 h,测定菌液的OD600,研究Cu2+对菌株生长的影响。重复3次。
1.2.4 菌株10`ZS的芽孢漆酶对染料脱色的研究。芽孢漆酶悬液的制备、漆酶活性的测定方法及芽孢漆酶对染料的脱色方法见参考文献[11]。活性亮蓝(RBBR)、活性黑、靛红和结晶紫分别属于蒽醌、偶氮、靛蓝和三苯甲烷类染料。
2 结果与分析
2.1 菌株10`ZS的形态学及生理生化反应特性 菌株10`ZS革兰氏染色呈蓝紫色,为革兰氏阳性菌,杆状,具有芽孢。菌株10`ZS能利用葡萄糖、蔗糖和甘露醇,具有明胶酶(表1)。

表1 菌株10`ZS的生理生化反应特性
2.2 菌株10`ZS的16S rDNA序列分析及系统发育树的构建 由图1可知,菌株10`ZS的16S rDNA扩增条带清晰,没有非特异性扩增片断,大小在1.5 kb左右,其测序结果为1 451 bp。将菌株10`ZS的16S rDNA序列在NCBI网站进行BLAST同源性分析,它与芽孢杆菌属同源性达99%。结合该菌株的形态和生理生化特性,将其命名为Bacillus sp.10`ZS。利用Clustal X软件对菌株10`ZS、其他菌株的的16S rDNA进行多序列比对,用Phylip软件的最大简约法构建系统发育树(图2)。
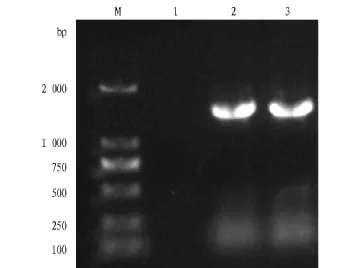
图1 菌株10`ZS的16S rDNA PCR结果
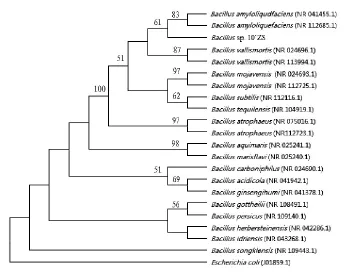
图2 基于菌株10`ZS的16S rDNA序列构建的系统发育树
2.3 菌株10`ZS的生长特性 由图3可知,菌株10`ZS的最适生长温度是35℃,在25~40℃之间生长良好。由图4可知,菌株10`ZS的最适生长pH为6.0,适宜在pH 5.0 ~8.0 生长。由图5可知,菌株10`ZS在1% ~4%NaCl溶液中正常生长,在6%NaCl溶液中生长相对缓慢。由图6可知,菌株10`ZS在0.2 ~0.4 mmol/L 的 Cu2+溶液中正常生长,在 0.6 mmol/L的Cu2+溶液中生长缓慢。

图3 温度对菌株10`ZS生长的影响

图4 pH对菌株10`ZS生长的影响
2.4 菌株10`ZS的芽孢漆酶对染料的脱色效果 以丁香醛连氮为底物,以芽孢干重计算,菌株10`ZS的芽孢漆酶活性为39.7 U/g。由图7可知,菌株10`ZS的芽孢漆酶对结晶紫、RBBR、靛红和活性黑6 h脱色率分别为87.9%、78.5%、16.1%和 14.6%。
3 讨论

图5 NaCl对菌株10`ZS生长的影响
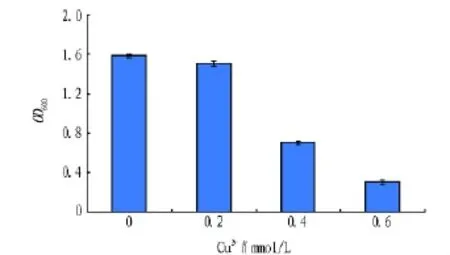
图6 Cu2+对菌株10`ZS生长的影响

图7 菌株10`ZS芽孢漆酶对4种染料的脱色效果
菌株10`ZS是从东北林业大学实验林场的樟子松林下的土壤中分离出来的,有芽孢,在pH 5.0~8.0的范围内均能生长,能够耐受6%NaCl溶液。这些特性使得这株细菌适用于工业废水的处理。菌株10`ZS能够耐受0.6 mmol/L的Cu2+。这是它得以在Cu2+作为筛选剂的培养基中被分离出的原因。以丁香醛连氮为底物,以芽孢干重计,菌株10`ZS的芽孢漆酶活性为39.7U/g,稍低于Bacillussp.CLb[11]和Bacillus sp.9BS[12]的芽孢漆酶的活性。
菌株10`ZS的芽孢漆酶在6 h内对三苯甲烷类染料结晶紫和蒽醌类染料RBBR的脱色率较高,分别为87.9%和78.5%。蒽醌类染料是漆酶的特异底物,可以直接被氧化[13],而三苯甲烷类染料不是漆酶的特异底物,但是菌株10`ZS的芽孢漆酶则可以直接氧化结晶紫使其脱色,表明菌株10`ZS的芽孢漆酶具有新的功能。综上所述,菌株10`ZS具有耐盐和耐铜的性能,在6 h内芽孢漆酶对结晶紫和RBBR具有较高的脱色效果。这表明菌株10`ZS的芽孢漆酶在工业染料废水的处理中具有潜力。
[1]CLAUS H,FABER G,KÖNIG H.Redox-mediated decolorization of synthetic dyes by fungal laccases[J].Appl Microbiol Biotechnol,2002,59:672-678.
[2]SANTHANAM N,VIVANCO J M,DECKER S R,et al.Expression of industrially relevant laccases:Prokaryotic style[J].Trends Biotechnol,2011,29:480-489.
[3]DWIVEDI U N,SINGH P,PANDEY V P,et al.Structure-function relationship among bacterial,fungal and plant laccases[J].J Mol Catal B:Enzym,2011,68:117-128.
[4]FANG Z M,LI T L,CHANG F,et al.A new marine bacterial laccase with chloride-enhancing,alkaline dependent activity and dye decolorization ability[J].Bioresour Technol,2012,111:36-41.
[5]SINGH G,BHALLA A,KAUR P,et al.Laccase from prokaryotes:A new source for an old enzyme[J].Rev Environ Sci Biotechnol,2011,10:309-326.
[6]SHARMA J K,ARORA M K.Decolourization of textile effluent[J].Pollution Res,2001,20:453-457.
[7]DURA’N N,DURA’N M.Enzyme applications in the textile industry[J].Rev Progress Coloration,2000,30:41-44.
[8]WESENBERG D,KYRIAKIDES I,AGATHOS S N.White rot fungi and their enzymes for the treatment of industrial dye effluents[J].Biotechnol Adv,2003,22:161-187.
[9]沈萍,范秀容,李广武.微生物学实验[M].3版.北京:高等教育出版社,1999:116-120.
[10]王远亮,杨瑞红,毛爱军,等.采用未培养技术对荷斯坦奶牛瘤胃细菌多样性进行初步分析[J].微生物学报,2005,45(6):915-919.
[11]李凡姝,刘海洋,戴绍军,等.高产漆酶菌株Bacillus sp.CLb的筛选及其对染料脱色效果的研究[J].安徽农业科学,2014,42(6):1614-1616,1654.
[12]汪春蕾,田菲,张月颖,等.耐盐Bacillus sp.9BS的筛选及其对染料的脱色效果[J].湖南农业大学学报(自然科学版),2015,41(3):313-317.
[13]WONG Y,YU J.Laccase-catalyzed decolorization of synthetic dyes[J].Water Res,1999,33:3512-3520.

