何首乌叶原生质体制备与融合研究
黄国文,管天球,赵雨云,陈莫林,刘宏辉 (湖南科技学院生化系,湖南永州425199)
何首乌[Fallopia multiflora(Thunb.)Harald]为双子叶蓼科多年生草本植物,分布在我国广东、四川、湖南等省区,生长于灌木丛中、山脚阴处或石隙中。茎缠绕,基部中空,多分枝,基部木质化。叶心形,两面光滑,有膜质短筒状的托叶鞘,圆锥状花序。瘦果椭圆形,光滑,黑色[1]。块茎供药用,有滋补强壮作用,茎藤可治失眠症[2]。野生何首乌的块茎生长缓慢,不能满足人类对药物的开发利用。植物原生质体培育和融合是植物育种的重要技术之一。目前分离原生质体的方法有机械法和酶法,常用的方法是酶法。笔者用机械法制备何首乌叶片的原生质体,用PEG结合高Ca2+-高pH诱导融合法来融合其原生质体,以期为何首乌多倍体植株的培育奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验材料。何首乌新鲜成熟叶片。
1.1.2 主要仪器。血细胞计数板,光学显微镜,离心机,数码相机。
1.2 方法
1.2.1 原生质体制备。用机械法制备原生质体,具体操作步骤见文献[3]。何首乌叶片经过质壁分离一定时间后切成0.5 cm宽的长条,转入到25%蔗糖溶液中放置8 min,过滤后得到原生质体溶液。原生质体经过27%蔗糖溶液洗涤一次,再用13%甘露醇CPW溶液悬浮。悬浮液原生质体可用牛氏记数板记数和细胞融合。原生质体得率=记数室大方格原生质体的平均个数×104个(FW)。
1.2.2 渗透剂的选择。以 0.9 mol/L NaCl、6%KNO3和35%蔗糖溶液作为高渗溶液,在35℃水浴锅中处理何首乌叶片30 min后,制备原生质体,计算原生质体的得率,确定制备原生质体的渗透剂类型。
1.2.3 影响原生质体得率的测定方法。设定原生质体质壁分离的蔗糖浓度为25%、30%、35%、40%、45%,处理温度为4、15、25、35、45 ℃,处理时间为10、30、50、70、90 min。将何首乌叶片放置在特定蔗糖浓度和特定温度的条件下处理一定时间,叶片经过切条后获得原生质体,测定原生质体的得率。
1.2.4 PEG结合高Ca2+-高pH诱导法融合原生质体的方法。经过质壁分离法获得的原生质体溶液,1 500 r/min下离心8 min,沉淀用少量13%甘露醇CPW溶液悬浮,为原生质体溶液。用吸管取原生质体悬浮液滴两滴在载玻片上,静置几分钟,使原生质体在载玻片上产生一薄层。取特定浓度PEG融合液两滴,缓慢滴加到载玻片上的原生质体溶液中,再静置一定时间,观察载玻片原生质体间的粘连。每隔5 min,用吸管向原生质体液中滴两滴高Ca2+-高pH溶液,共3次。盖上盖玻片,用吸水纸吸去多余的溶液即成临时装片。用显微镜观察细胞融合,统计融合百分数。用数码照相机在显微镜下拍照。
2 结果与分析
2.1 渗透剂对原生质体得率的影响 用0.9 mol/L NaCl、6%KNO3和35%蔗糖溶液作为何首乌叶片质壁分离的高渗溶液,在25℃下制备的原生质体数量分别为0.9×105、3.8×105和5.8×102个/g(FW);且KNO3溶液会引起叶片流出物大量成块,可能是原生质体数量减少的原因。NaCl溶液处理的叶片制备的原生质体溶液虽然杂物少,但相对蔗糖溶液而言细胞也较少。因此,以35%蔗糖溶液作为高渗溶液处理何首乌叶片制备的原生质体数量较多,可用于制备原生质体的条件优化。
2.2 蔗糖浓度对原生质体得率的影响 在25℃水浴锅中用浓度分别为25%、30%、35%、40%、45%蔗糖溶液处理何首乌成熟叶片30 min后,制备原生质体。测定原生质体得率分别为100、2.3 ×104、3.5 ×105、2.2 ×105、0.5 ×104。可见,原生质体数目随着蔗糖浓度的增加先升高后降低。25%蔗糖溶液处理制备的原生质体得率最少,为何首乌叶片细胞的低渗溶液。35%蔗糖溶液处理制备的原生质体得率最多。当蔗糖浓度高于35%时,得到的原生质体数量逐渐减少,可能是细胞失水过快过多导致细胞质壁分离复原活性降低的原因。
2.3 温度对原生质体得率的影响 在5份35%蔗糖溶液烧杯中加入等量何首乌成熟叶片,分别放在4、15、25、35、45℃的水浴锅中处理30 min后,制备原生质体。测定原生质体得率分别为70、0.4 ×103、5.7 ×105、2.3 ×105、1.3 ×103。可见,质壁分离温度影响原生质体得率,在25℃时处理的材料得到的原生质体数量最多,温度过高或者过低得到的原生质体数量减少。说明温度影响细胞内渗透压的变化。温度过低,细胞活性低,导致细胞失水少,质壁分离的细胞数目少,因此制备的原生质体数目少;温度过高,细胞内的活性过高,导致细胞失水过快过多,质壁分离的细胞数目多,但细胞复原活性降低,甚至引起细胞活性丧失,因此制备的原生质体数量少。
2.4 质壁分离时间对原生质体得率的影响 用35%蔗糖溶液在25 ℃下处理何首乌叶片10、30、50、70、90 min 后,制备原生质体。测定的原生质体的得率分别为2.7×102、3.2×105、3.4 ×105、4.1 ×105、3 ×104。表明蔗糖处理时间影响原生质体得率。蔗糖处理时间过短或者过长,原生质体的得率减少。因此质壁分离时间决定原生质体质壁分离复原的活性,从而影响原生质体的产率。在35%蔗糖溶液处理70 min时原生质体得率最多(图1A)。考虑到原生质体脱水时的生理活性变化,为了更好地保持原生质体的活力,选择以35%蔗糖溶液在25℃下处理30 min时制备的原生质体,经过离心用13%甘露醇CPW溶液悬浮后用于融合研究。
2.5 融合液PEG浓度和处理时间对原生质体融合的影响 以PEG结合高Ca2+-高pH方法融合原生质体,变化PEG融合液中PEG溶度,分别为10%、20%、30%、40%,分别处理35%蔗糖溶液制备的原生质体15、20、25、30 min,观察各种条件下原生质体的融合效果(表1)。在20%PEG溶液条件下,融合20 min后,原生质体的融合效率最高,为11.7%。PEG之所以能介导原生质体融合,是因为在高浓度的PEG溶液中,PEG与水之间的氢键结合,使溶液中自由水消失,导致原生质体发生膜结构变化,促使其发生融合[4]。当PEG浓度大于20%时,PEG浓度越高和处理时间越长,融合率越低。PEG浓度过高和时间过长,可能使原生质体反应液环境黏滞度过高,阻碍高钙-高PH溶液的洗涤作用,导致细胞融合减少。另外,PEG浓度过高,可能会使细胞体积减小,导致各细胞之间膜的接触面减少,细胞融合效率降低。

表1 不同PEG浓度处理条件下原生质体融合效率 %
20%PEG融合液融合原生质体20 min,在显微镜(400×)下观察到原生质体粘连在一起(图1B)。经过3次高Ca2+-高pH溶液洗涤后,在显微镜下观察到2个原生质体融合现象(图1C),融合率为11.7%,没有观察到3个细胞的融合现象。但在各种条件下用高Ca2+-高pH溶液洗涤聚集的原生质体时都发现大部分原生质体被成块地冲向一边,只有少量的原生质体在原位,这可能是原生质体融合效率不高的原因。
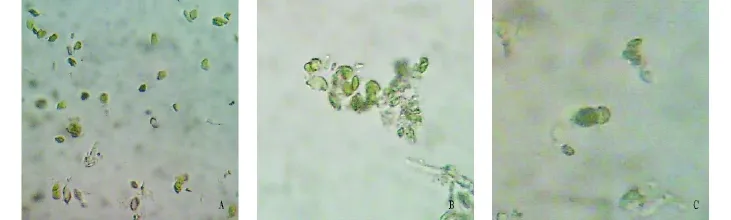
图1 何首乌叶片的原生质体制备和融合现象
3 讨论
植物原生质体的制备有机械法和酶法[5]。由于酶解法操作简单方便,获得的细胞数量多,大多数研究采用酶解法,但酶解法中使用的各种酶可能对分离的原生质体及其成分有作用会引起不良后果[6]。机械法是将叶片放入高渗溶液中进行质壁分离一段时间,然后采用切条或者研磨的方法将叶片破裂,然后将碎块放入低渗溶液中使细胞分离出来的方法。用此种方法制备原生质体所用的时间短,成本低,没有受到酶等化学试剂的影响,能够保持细胞的原有状态,是一种值得研究的方法。但目前认为机械法制备原生质体数量少,不能用于细胞下游试验。该研究根据细胞质壁分离和复原的原理[7-8],以蔗糖溶液作为叶片细胞质壁分离的渗透剂,对蔗糖浓度、质壁分离时间和温度进行了多个水平试验,用切条办法破碎细胞,用能够保持原生质体活性的溶液13%甘露醇CPW溶液作为质壁分离复原的试剂,分离到数量较多的原生质体。该试验结果表明,在25℃条件下将何首乌叶片浸入35%蔗糖溶液处理30 min能够分离3.2×105个/g(FW)。这些原生质体经过20%PEG融合液作用20 min,用高Ca2+-高pH溶液洗涤诱导融合,能够得到11.7%的2个原生质体融合的细胞融合体,说明用此种方法制备的原生质体也是有活性的;同时说明融合效率不高,有待于进一步研究。该研究结果为何首乌植株的细胞育种研究奠定了坚实的基础。
[1]中国科学院植物研究所.中国高等植物图鉴[M].北京:科学出版社,1972:567.
[2]王文静,薛咏梅,赵荣华,等.何首乌的化学成分和药理作用研究进展[J].云南中医学院学报,2007,30(3):62 ~63.
[3]黄国文.野燕麦原生质体制备和融合的研究[J].安徽农业科学,2013,41(23):9546-9547.
[4]复镇澳.第九讲 植物原生质体融合和细胞杂交[J].植物生理通讯,1979(3):58-66.
[5]张良波,李培旺,黄振,等.木本植物原生质体制备体系的研究发展[J].中南林业科技大学学报,2011,31(8):102 -106.
[6]AHUIA M R,庞广昌,胡前进.原生质体分离、培养和融合技术的现状及其展望[J].国外林业,1983(4):10 -11.
[7]顾怡,胡兴昌.应用NaCl进行“植物细胞质壁分离及复原实验”的探索[J].生物学教学,2012,37(6):47.
[8]杨培俊,赵吉勇.探究植物细胞在KNO3溶液中的质壁分离与复原的最佳浓度[J].生物学教学,2008,33(8):45-46.

