miR-9和miR-9*在SAMP8小鼠衰老中的功能及机制
刘 伟,刘 畅,阴 彬,彭小忠,3
中国医学科学院 北京协和医学院 1基础医学研究所医学分子生物学国家重点实验室2人体解剖与组织胚胎学系 3神经科学中心,北京100005
·论 著·
miR-9和miR-9*在SAMP8小鼠衰老中的功能及机制
刘 伟1,2,刘 畅1,阴 彬1,彭小忠1,3
中国医学科学院 北京协和医学院1基础医学研究所医学分子生物学国家重点实验室2人体解剖与组织胚胎学系3神经科学中心,北京100005
目的 探讨miR-9和miR-9*在SAMP8小鼠衰老中的功能及机制。方法 选取4-、8-、12-月龄快速老化倾向小鼠(SAMP8)作为研究对象,并以同月龄快速老化抵制小鼠(SAMR1)为对照,每组3只,取脑,切片进行原位杂交检测miR-9和miR-9*的表达;分别以miR-9和miR-9*的模拟物和抑制物转染N2a细胞,采用流式细胞术检测过表达和敲低miRNA对细胞周期的影响;生物信息学预测miR-9和miR-9*靶基因并进行双荧光素酶报告基因实验验证。结果 miR-9 和miR-9*在SAMP8小鼠海马区的表达低于SAMR1小鼠。敲低miR-9和miR-9*都可以增加N2a细胞G1期细胞在群体中的比例,减少S期细胞在群体中的比例,过表达则相反。生物信息学预测并通过文献筛选miR-9的靶基因有PSEN1、SCN2B、MAP3K3和BACE1,miR-9*的靶基因有CDKn1c。荧光素酶报告基因实验证实miR-9的靶基因是MAP3K3,miR-9*的靶基因是CDKn1c。结论 miR-9和miR-9*可能是分别通过其靶基因MAP3K3和CDKn1c在SAMP8小鼠衰老进程中发挥重要作用。
miR-9;miR-9*;衰老;SAMP8小鼠;SAMR1小鼠;靶基因
Acta Acad Med Sin,2015,37(3):253-258
衰老是一个遗传和环境因素相互作用的复杂过程,可导致机体对某些疾病的易感性升高,丧失某些修复再生能力并逐渐虚弱[1]。对某些疾病表型进行全基因组关联分析(genome-wide association study,GWAS)证实,其致病因素与衰老有关[2]。microRNA是一类长度约为22个核苷酸的非编码单链RNA分子,其在动、植物中参与转录后基因表达调控[3]。目前研究表明,miRNA在衰老过程中发挥着重要的作用。Bonifacio等[4]检测了衰老过程中成纤维细胞miRNA的表达,从中筛选出miR-143,结果发现过表达miR-143可以引起正常对照年轻的成纤维细胞生长停滞。本课题组以往采用miRNA芯片对SAMP8小鼠和SAMR1小鼠的研究显示,两种小鼠海马区miR-9和miR-9*的表达存在显著差异[5],本研究探讨了miR-9和miR-9*在SAMP8小鼠衰老中的功能及机制。
材料和方法
实验动物 雄性4-、8-、12-月龄SAMP8小鼠各3只,体重25~30 g;雄性4-、8-、12-月龄SAMR1小鼠各3只,体重25~30 g;均购自天津中医药大学第一附属医院老化鼠研究中心动物房,饲养于中国医学科学院基础医学研究所动物房,室温22~24℃,自由饮食,昼夜各12 h。
主要试剂 牛血清白蛋白(BSA)购自瑞士Roche公司,miR-9和miR-9*LNA-修饰原位杂交探针由上海生工公司合成,Lipofectamin 2000、TRIzol购自美国Invitrogen公司,Vigfect转染试剂购自北京威格拉斯公司,双荧光素酶报告基因检测试剂盒购自美国Promega公司。
主要质粒载体 pcDNA3.1:哺乳动物表达载体,购自美国 Invitrogen公司,用于构建报告基因以及miRNA的过表达;pcDNA3.1-Luc:用于荧光素酶报告基因分析,由本实验室基于 pcDNA3.1改造;pcDNA3.1-GFP:用于miRNA对靶基因3’UTR的效应分析,由本实验室基于pcDNA3.1改造。
原位杂交检测miRNA表达 将小鼠用0.7%戊巴比妥钠腹腔注射麻醉后,灌流取脑,4%PFA固定过夜,25%的蔗糖溶液脱水,O.C.T(Sakura,日本)包埋,Leica冰冻切片机切片(14 μm厚度),常规原位杂交流程。切片于400倍镜下随机选取5个不连续视野,采用IPP6.0专业图像分析软件对各组图片阳性区域测定平均光密度值(mean optical density,MOD)进行半定量分析。
流式细胞术分析细胞周期 分别以miR-9和miR-9*的模拟物和抑制物及其相应的阴性对照(对照组)转染N2a细胞,采用Real-time PCR检测过表达和敲低效果。胰酶消化收集对数生长期的细胞,70%预冷乙醇4℃固定12 h以上;用 PBS洗去乙醇,1500 r/min(r=5.5 cm)离心5 min;加入0.5 ml PCB作用5 min,PBS清洗;0.5 ml PBS重悬细胞,加入RNase A至终浓度50 μg/ml,37℃水浴30 min以上;加入PI至终浓度50 μg/ml,37℃染色10 min;采用流式细胞仪(CELL Quest,美国Becton-Dickinson)测定周期。
生物信息学预测靶基因 通过www.targetscan.org 和www.microrna.org两个网站对miR-9/miR-9*进行了靶基因的生物信息学预测,结合文献筛选与老化相关的基因。
荧光素酶报告基因实验 将候选靶基因的3’UTR克隆到pcDNA3.1-Luc载体中,共转染miR-9和miR-9*的模拟物或抑制物(吉玛,中国)、pcDNA3.1-Lucgene 3’UTR和pRL-TK入293ET细胞中,观察荧光素酶活性变化。
Western blot法验证靶基因 将pcDNA3.1-GFPMAP3K3-3’UTR、miR-9模拟物和pcDNA3.1-GFP-CDKn1c-3’UTR、miR-9*的模拟物分别转染293ET细胞,用蛋白裂解液裂解细胞,收取蛋白,12%SDS-PAGE 胶70V电泳,半干法电转,5%脱脂奶封闭1 h,加小鼠单抗GFP(美国Abmart公司;1∶2000),4℃过夜孵育。TBS-T将膜浸洗3次,羊抗小鼠二抗(北京中杉金桥,1∶5000)室温孵育2 h;用TBS-T将膜浸洗3次,显色。
统计学处理 采用Excel 2007统计软件,实验数据以均数±标准差表示,两样本均数比较采用配对t检验,P<0.05为差异有统计学意义。
结果
原位杂交结果 miR-9探针阳性信号呈蓝紫色颗粒状,主要分布在海马区域的大神经元,在齿状回颗粒细胞表达较海马CA区锥体细胞高,SAMR1的染色深度略高于SAMP8小鼠(图1A);IPP6.0半定量结果显示,SAMR1的miR-9 MOD值明显高于SAMP8(0.81± 0.03比0.34±0.02,P=0.04)。miR-9*的染色深度较miR-9高,在海马CA区锥体细胞尤其是CA2、CA3表达较高,SAMR1的染色深度略深于SAMP8小鼠(图1B);IPP6.0半定量结果显示,SAMR1的miR-9*MOD值明显高于SAMP8(0.74±0.04比0.40±0.01,P= 0.02)。
miR-9和miR-9*过表达和敲低对N2a细胞周期的影响 过表达或敲低miR-9和miR-9*的表达量与对照组相比差异均有统计学意义(P均<0.01)(图2A)。流式细胞检测结果显示,过表达miR-9和miR-9*均可显著减少N2a细胞G1期细胞在群体中的比例,增加S期细胞在群体中的比例(P<0.05或P<0.01)(图2B);敲低miR-9和miR-9*时均可显著增加N2a细胞G1期细胞在群体中的比例,减少S期细胞在群体中的比例(P均<0.05)(图2C)。
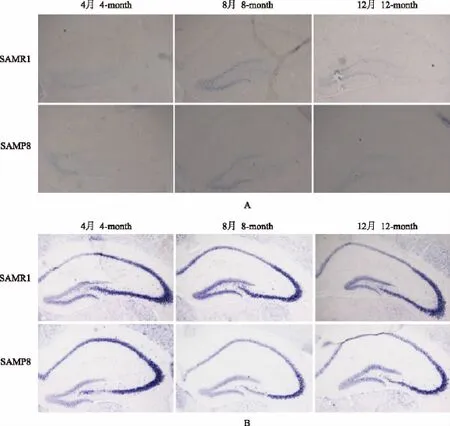
图1 miR-9和miR-9*在4-,8-,12-月SAMR1及SAMP8小鼠中的表达情况(×40)Fig 1 Expression pattern of miR-9 and miR-9*in 4-,8-,and 12-month SAMR1 and SAMP8 mice(×40)
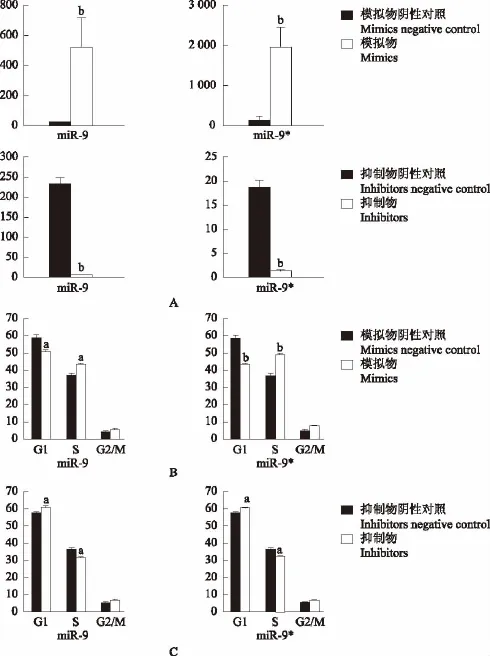
图2 miR-9和miR-9*过表达和敲低对N2a细胞周期的影响Fig 2 Effects of miR-9/miR-9*overexpression and knock-down on cell cycle in N2a cells
miR-9和miR-9*的靶基因验证 靶基因生物信息学预测结合文献筛选结果显示,miR-9的候选靶基因为PSEN1、SCN2B、MAP3K3和BACE1,miR-9*的候选靶基因为CDKn1c。荧光素酶报告基因实验结果显示,过表达miR-9后pcDNA3.1-Luc-MAP3K3-3’UTR的荧光素酶活性较对照组显著降低(P<0.05),而PSEN1、SCN2B和BACE1-3’UTR与对照组差异无统计学意义(P均>0.05);敲低miR-9后,pcDNA3.1-Luc-MAP3K3-3’UTR荧光素酶活性有所回复。过表达miR-9*后pcDNA3.1-Luc-CDKn1c-3’UTR的荧光素酶活性也较对照组显著降低(P<0.01),敲低miR-9*可导致荧光素酶活性显著增高(P<0.01)。Western blot验证miR-9和miR-9*的靶基因实验结果显示,过表达miR-9和miR-9*均可导致GFP蛋白表达降低(图3)。
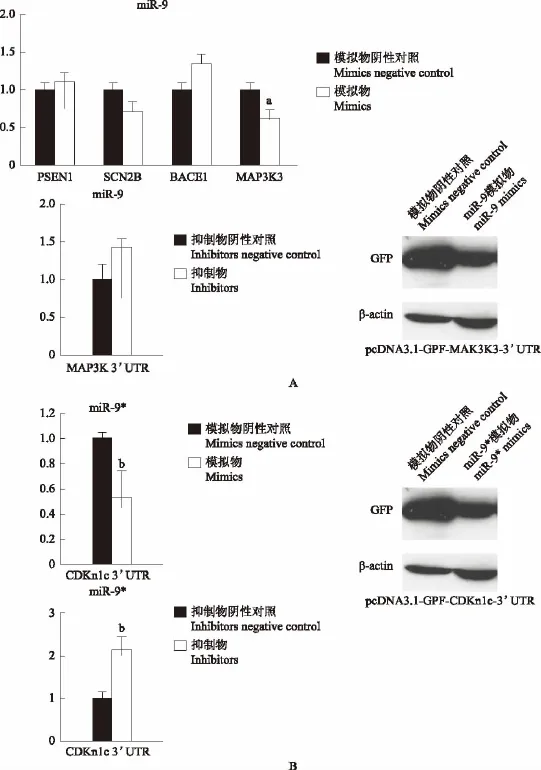
图3 miR-9和miR-9*的靶基因验证Fig 3 Verification of the target genes of miR-9/miR-9*
讨论
快速衰老小鼠是一种常用于老化相关实验的动物模型,由日本京都大学在对AKR/J系小鼠进行常规近交系培育时意外发现的,是国际上公认的可用于老化研究的动物模型[6]。海马组织受衰老影响较大并且和学习记忆相关,选取海马部位观察能够较好地反映一个基因对脑衰老的影响。目前临床尝试把miRNAs作为在血浆和脑脊液中诊断衰老相关疾病老年痴呆的分子标志物,例如miR-146和miR-9在其中低表达[7]。而对血管内皮细胞衰老模型的检测则显示,miR-146 和miR-9呈高表达[8]。Packer等[9]研究发现,miR-9/9*在亨廷顿氏病中低表达,可分别通过调控REST和coREST对疾病的发生发展起关键作用。Schonrock等[10]采用Aβ处理神经干细胞,结果显示包括miR-9在内的大部分miRNAs都有明显下调。miR-9和miR-9*来自同一个pre-miRNA,本研究结果显示它们在海马组织中都有表达,且SAMR1的染色深度均略高于SAMP8,提示SAMP8小鼠海马miR-9和miR-9*的表达较SAMR1降低。
已知衰老常伴随细胞周期的改变。本研究采用流式细胞仪检测了过表达和敲低miRNA对细胞周期的影响,结果发现过表达miR-9和miR-9*均可显著减少N2a细胞G1期细胞在群体中的比例,增加S期细胞在群体中的比例,而敲低则相反,说明过表达和敲低miR-9和miR-9*均可对细胞周期产生影响。
此外,本研究结合生物信息分析、荧光素酶报告基因实验及Western blot检测证实miR-9的靶基因是MAPK。MAPK是介导细胞反应的重要信号系统,普遍存在于多种生物中(包括酵母和哺乳动物细胞),参与了细胞生长、发育、分裂、死亡以及细胞间的功能同步等多种生理反应过程。MAPK的精细调控与阿尔茨海默病、帕金森病、肌萎缩性侧索硬化症及多种癌症相关[11]。本研究证实miR-9参与了MAPK的转录后调控,推测这可能也是其促进SAMP8小鼠老化的原因之一。同样,本研究亦证实miR-9*的靶基因是CDKn1c(又名p57,细胞周期蛋白依赖性激酶抑制剂),其在细胞周期的调控中能够导致G1期阻滞,对肿瘤的发生发展有抑制作用。研究显示,CDKn1c在脑发育过程中能够促进细胞的放射状迁移和影响大脑皮层形成[12]。笔者推测,SAMP8小鼠脑中低表达的miR-9*会引起CDKn1c增高,进而影响细胞周期,从而对小鼠海马的发育及功能状态产生影响,最终导致SAMP8小鼠出现快速老化。
综上,本研究结果显示,miR-9和miR-9*在SAMP8小鼠海马中的表达均降低,两者可能是分别通过其靶基因MAP3K3和CDKn1c在SAMP8小鼠衰老进程中发挥重要作用。
[1]Sorrentino JA,Sanoff HK,Sharpless NE.Defining the toxicology of aging[J].Trends Mol Med,2014,20(7):375-384.
[2]Jeck WR,Siebold AP,Sharpless NE.Review:a meta-analysis of GWAS and age-associated diseases[J].Aging Cell,2012,11(5):727-731.
[3]Ambros V.microRNAs:tiny regulators with great potential [J].Cell,2001,107(7):823-826.
[4]Bonifacio LN,Jarstfer MB.MiRNA profile associated with replicative senescence,extended cell culture,and ectopic telomerase expression in human foreskin fibroblasts[J].PLoS One,2010,5(9).pii:e12519.doi:10.1371/journal.pone.0012519.
[5] 刘伟,刘畅,阴彬,等.衰老相关miRNAs的筛选和鉴定[J].基础医学与临床,2015,35(5):674-679.
[6]Takeda T,Hosokawa M,Takeshita S,et al.A new murine model of accelerated senescence[J].Mech Ageing Dev,1981,17(2):183-194.
[7]Kiko T,Nakagawa K,Tsuduki T,et al.MicroRNAs in plasma and cerebrospinal fluid as potential markers for Alzheimer’s disease[J].J Alzheimers Dis,2014,39(2):253-259.
[8]Olivieri F,Lazzarini R,Recchioni R,et al.MiR-146a as marker of senescence-associated pro-inflammatory status in cells involved in vascular remodelling[J].Age(Dordr),2013,35(4):1157-1172.
[9]Packer AN,Xing Y,Harper SQ,et al.The bifunctional microRNA miR-9/miR-9*regulates REST and CoREST and is downregulated in Huntington’s disease[J].J Neurosci,2008,28(53):14341-14346.
[10]Schonrock N,Ke YD,Humphreys D,et al.Neuronal microRNA deregulation in response to Alzheimer’s disease amyloid-beta[J].PLoS One,2010,5(6):e11070.doi:10.1371/journal.pone.0011070.
[11]Munoz L,Ammit AJ.Targeting p38 MAPK pathway for the treatment of Alzheimer’s disease[J].Neuropharmacology,2010,58(3):561-568.
[12]Tury A,Mairet-Coello G,Dicicco-Bloom E.The cyclin-dependent kinase inhibitor p57Kip2 regulates cell cycle exit,differentiation,and migration of embryonic cerebral cortical precursors[J].Cereb Cortex,2011,21(8):1840-1856.
Functions of miR-9 and miR-9*during Aging in SAMP8 Mice and Their Possible Mechanisms
LIU Wei1,2,LIU Chang1,YIN Bin1,PENG Xiao-zhong1,3
1State Key Laboratory of Medical Molecular Biology,Department of Molecular Biology and Biochemistry,
2Department of Human Anatomy,Histology and Embryology,3Neuroscience Center,Institute of Basic Medical Sciences,CAMS and PUMC,Beijing 100005,China
Objective To explore the functions of miR-9 and miR-9*in SAMP8 mice during the aging and their possible mechanisms.Methods SAMP8 mice(4-,8-,12-month old,respectively)were selected,three age-matched SAMR1 mice were used as the control group with three mice in each group.The brains were collected and then sectioned for in situ hybridization of miR-9 and miR-9*.Mimics or inhibitors of miR-9 and miR-9*were transfected into N2a cells,and the effects of overexpression or knockdown of the microRNAs on the cell cycle were detected by flow cytometry.Target genes were predicted by bioinformatic analysis and confirmed by dual luciferase assay.Results Expressions of miR-9 and miR-9*in hippocampus of SAMP8 mice were lower than those of SAMR1 mice.Knockdown of miR-9 and miR-9*induced a prolonged G1 phase and a shortened Sphase in N2a cells;in contrast,miR-9 and miR-9*overexpression showed opposite effects.The predicted target genes of miR-9 were PSEN1,SCN2B,MAP3K3,and BACE1,and that of miR-9*was CDKn1c.Dual luciferase reporter gene assay showed that miR-9 targeted MAP3K3 while miR-9*targeted CDKn1c.Conclusion miR-9 and miR-9*play an important role during aging via the target genes MAP3K3 and CDKn1c in the SAMP8 mice.
miR-9;miR-9*;ageing;SAMP8 mice;SAMR1 mice;target gene
PENG Xiao-zhong Tel:010-69156434,E-mail:peng_xiaozhong@163.com
R34
A
1000-503X(2015)03-0253-06
10.3881/j.issn.1000-503X.2015.03.001
2015-02-13)
彭小忠 电话:010-69156434,电子邮件:peng_xiaozhong@163.com
重大科学研究计划(2011CBA01104)Supported by the Key Scientific Research Project(2011CBA01104)

