放射性下颌骨坏死的BS临床分类及治疗策略*
何悦 刘忠龙 代天国 王中和 张志愿
·临床研究与应用·
放射性下颌骨坏死的BS临床分类及治疗策略*
何悦①刘忠龙①代天国①王中和②张志愿①
目的:本研究旨在通过对下颌骨放射性骨坏死(osteoradionecrosis of mandible,ORNM)病例的回顾性分析,提出一种用于指导放射性骨坏死治疗的新的分类及分期系统。方法:总结上海交通大学医学院附属第九人民医院2000年1月至2013年12月99例ORNM病例资料,并以此为基础将病损中骨组织(bone tissue)及软组织(soft tissue)病损分别进行分类。再将骨、软组织病损的分类“合并”,同时结合国外关于ORNM的分期研究,提出了最新的“BS”分类及分期系统,在此基础上提出ORNM标准化治疗的构思。结果:根据骨坏死的不同严重程度将其分为4期:0期(8例),Ⅰ期(14例),Ⅱ期(65例),Ⅲ期(12例)。0期患者给予保守性治疗;Ⅰ期患者实施死骨摘除术;Ⅱ期患者行下颌骨边缘性切除或是节段性切除,血管化骨肌瓣或单纯软组织瓣修复;Ⅲ期患者则行下颌骨方块切除,血管化骨肌瓣或单纯软组织瓣修复。4个不同分期患者接受相对应治疗后均获得较好效果。结论:“BS”分类及分期系统能够更容易且更为恰当地运用于ORNM的临床治疗指导。
放射性下颌骨坏死 放射治疗 临床分类及分期 “BS”分类 治疗策略
放射治疗是头颈部恶性肿瘤综合序列治疗中不可或缺的一部分,其既可以作为主要的治疗方式,也可以是辅助治疗。虽然放射治疗能够强有力地杀伤局部肿瘤组织并且提高患者的远期生存率,但其晚期并发症,如放射性颌骨坏死也是临床上难以攻克的问题,使得患者遭受身体上及心理上的巨大创伤。Regaud等[1]早在1922年提出了ORNJ(osteoradio⁃necrosis of the jaw)这一概念,此后受到越来越多的学者关注。1983年Marx等[2]将ORNJ定义为“在受辐照区域暴露的直径>1 cm的骨质,至少持续6个月以上且没有任何愈合的倾向”。自此以后,许多关于ORNJ不同的理论及定义相继被提出[3-4]。尽管缺乏标准及统一的定义,ORNJ的本质是辐照后不同程度的骨质破坏伴随着软组织的缺损。正是由于骨质破坏程度的不同,临床上有必要提出一个分类及分期系统用于ORNJ的治疗指导。Marx等[5]于1983年提出了ORNJ的病因学说理论,即“低细胞、低氧、低血运”三低学说,基于这一学说其创建了高压氧治疗。在他们机构中,根据患者对高压氧治疗的有效性将ORNJ分成3个分期并获得较好印证,其他机构也争相采用这一分类分期系统。然而此分期系统有其自身的局限性,包括:1)不适用于未接受高压氧治疗患者;2)缺乏对ORNJ临床表现及其严重程度的基本描述;3)目前高压氧的治疗效果受到越来越多的质疑[6-9]。Tsai等[10]将需要接受高压氧治疗的ORNJ患者定义为StageⅢ,而其他3个分期则需要不同的处理方式。这一分期方法同样不适合用于ORNJ的临床评估。目前,ORNJ的发病机制尚不明确[11-12]。Delanian等[13]提出了放射诱导纤维萎缩机制,其认为放射线能够诱导组织氧自由基形成,微血管栓塞,触发组织纤维化反应,最终诱发颌骨骨坏死的发生。根据这一理论,Lyons等[14]在2014年基于抗纤维化药物乙酮可可碱的作用效果提出了下颌骨ORN的新的分类分期系统,同样地,这一分期方法不适用于未接受抗纤维化药物治疗的患者。Epstein等[4]则根据病损的进展情况将ORNJ分为3个分期,这是一个比较独特的方法且能够指导临床医生何时进行疾病的干预治疗。但在临床上很难界定ORNJ的进展状态且其忽略了疾病的本身特点,限制了这一分期方法的使用。有些学者根据颌骨垂直方向的破坏程度对ORNJ进行分期,如下牙槽神经管是否涉及,局部或者是弥散性病变等[15-17]。这些方法对骨质破坏提供了一定的定量分析,但其不适用于从颌骨中央起源的骨坏死[18]。从上述回顾可知,以往的分类分期系统均存在其自身的局限性,不能够非常恰当地体现出ORNJ的严重程度,这也限制了其普遍适用性。本研究旨在提出一种新的下颌骨放射性骨坏死分类分期,使其能够更为合理地运用于临床的治疗指导。
1 材料与方法
1.1 病例资料
对上海交通大学医学院附属第九人民医院口腔颌面-头颈肿瘤科2000年1月至2013年12月下颌骨放射性骨坏死的病例资料进行回顾性分析。本研究将下颌骨放射性骨坏死(ORNM)定义为在受辐照区域中影像学上明显的骨质坏死,且排除原发及复发性颌骨肿瘤,这一定义与Store等[19]提出的关于ORNJ的概念基本相似。纳入分类分期病例的标准包括:1)被诊断为ORNM且排除原发肿瘤复发;2)发病前在本院接受单次放疗;3)无严重的并发症(冠心病、脑梗死、精神疾病等不能够耐受手术);4)在本院接受后续治疗(排除不同机构间的误差);5)有完整的治疗及随访资料。
1.2 方法
头颈部恶性肿瘤患者术后或未接受手术在本院给予一定剂量的放射治疗。患者放疗后每3个月至本院复诊(摄全景片及CT),直至数据统计日期。对于发展成ORNM的患者,记录原发肿瘤的类型及部位、ORNM的临床表现,包括自发性疼痛(轻度:能够忍受的间歇性疼痛;中度:能够承受的持续性疼痛;重度:无法忍受的疼痛),骨质暴露,皮肤瘘管,张口受限情况,皮肤麻木及病理性骨折。本研究利用CT检测骨坏死的最大直径及病理性骨折情况,且最大直径由CT中测得的3个方向(颊舌径、前后径、上下径)中的最大长度决定(图1)。
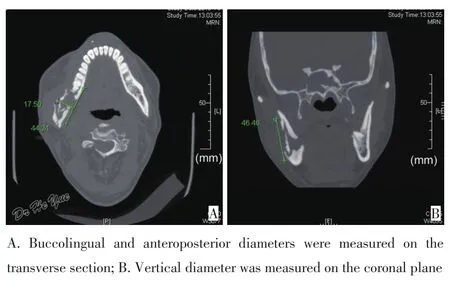
图1 骨坏死区域最大直径测量Figure 1 Measurement of maximal diameter for the osteonecrosis zone
治疗记录包括保守性治疗(抗生素、口腔卫生控制、增强免疫力),死骨摘除及下颌骨边缘性切除伴或不伴血管化组织修复。治疗效果包括“消退”、“改善”、“稳定”、“进展”。“消退”是指患者无明显主观症状且疾病无明显进展的状态;“改善”是指患者症状减轻且骨坏死区域减小;“稳定”是指疾病既无改善也无进展;“进展”是指疾病恶化。
基于本院ORNM的临床特征及对以往不同分类分期系统的回顾分析,本研究建立了新的分类分期系统并将患者根据不同的严重程度归纳于不同的分期中。
2 结果
2.1 ORNM的临床特征
2.1.1 一般临床特征 自2000年1月至2013年12月本院资料库中共搜集ORNJ资料120例,其中上颌骨11例,下颌骨109例。在下颌骨ORN中,10例患者因不符合研究标准被排除,最后纳入研究99例,其中女性27例,男性72例;年龄26~78岁,平均年龄54.5岁,中位年龄55岁。患者原发肿瘤部位见表1。放疗剂量60~74 Gy,平均剂量65.5 Gy,中位剂量68 Gy。其中25例(25.3%)患者接受60Co辐照,74例患者(74.7%)接受直线加速器辐照。放射治疗后,55例(55.6%)患者在12个月内发生ORNM,27例(27.3%)患者在12~60个月内发生ORNM。17例患者(17.2%)ORNM发生时间较晚(放疗后60个月以上)。55例ORNM(55.6%)患者单纯累及下颌骨体部,37例(37.4%)患者同时累及下颌骨体部及升支部,7例(7.1%)患者单纯累及下颌骨升支部。
2.1.2 ORNM影像学特征 影像学检查在评估下颌骨骨质矿化改变、骨质坏死乃至病理性骨折中起到极为关键的作用。99例ORNM中,8例患者无明显的影像学表现,但有明显的骨疼痛表现(轻度3例;中度5例);91例患者(91.9%)有明显的影像学改变,其中最大直径<2 cm:14例(14.1%);最大直径>2 cm:65例(65.7%);病理性骨折:12例(12.1%)(表2)。骨质暴露(65例,65.7%)及病理性骨折(12例,12.1%)是ORNM典型的临床表现,在本研究中,骨质暴露不包含病理性骨折。ORNM影像学改变与口腔内骨质暴露不存在必然的联系。本组病例中,2例无明显影像学变化的患者口腔内有暴露的骨质,这一暴露骨质的活性及密度有待于后期前瞻性实验评估。相反地,16例在影像学上有明显死骨存在的患者在口腔内并无死骨的暴露,其上黏膜及皮肤均完整。更令人惊讶的是有1例病理性骨折患者,其口腔内黏膜及口外皮肤均完整未破坏。这就表明骨组织的坏死与软组织的缺损可以分离,并不存在正相关关系。
2.1.3 ORNM临床表现 55例(55.6%)患者存在皮肤瘘管,提示这些患者口内及口外存在相通的管道,这为感染提供了天然的扩散渠道。同样地,皮肤瘘管与口内骨质暴露也不存在必然联系,6例死骨形成患者在口内无骨质暴露而在口外可见明显的皮肤瘘管形成。疼痛同样是ORNM典型的临床表现,本研究77例患者(77.8%)有不同程度的自发性疼痛,其中轻度26例,中度31例,重度20例。由于放疗后咬合肌群的损失伴发局部炎症,59例患者(59.6%)存在不同程度的张口受限表现(表2)。
2.2 ORNM新的临床分类及分期系统—“BS”分类分期系统
根据99例ORNM患者的临床及影像学表现,结合以往国外的分类分期方法,本研究提出了新的ORNM临床分类及分期系统(表3,图2~6)。

表1 口腔颌面部原发肿瘤部位Table 1 Primary site of tumor in the oral and maxillofacial regions

表2 不同分期ORNM病例的临床及影像学特征Table 2 Clinical and radiographic characteristics of ORNM cases at different stages

表2 不同分期ORNM病例的临床及影像学特征(续表2)Table 2 Clinical and radiographic characteristics of ORNM cases at different stages

表3 ORNM新的临床分类Table 3 New clinical classification of ORNM

图2 Ⅰ期患者(B1S2)Figure 2 Stage I patients(B1S2)
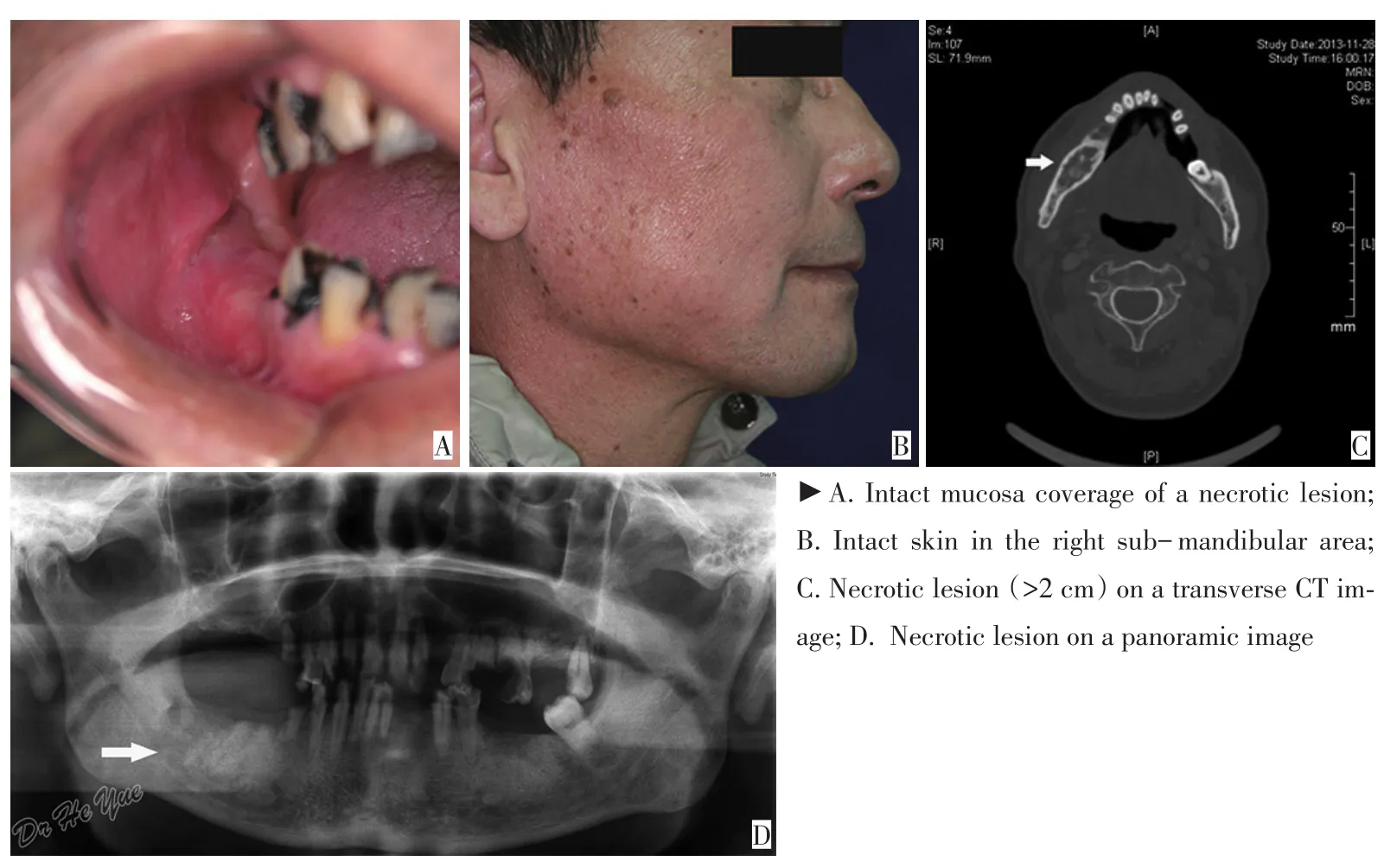
图3 Ⅱ期患者(B2S0)Figure 3 Stage II patients(B2S0)

图5 Ⅲ期患者(B3S0)Figure 5 Stage III patients(B3S0)
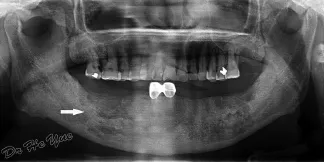
图4 Ⅱ期患者(B2S2)Figure 4 Stage II patients(B2S2)

图6 Ⅲ期患者(B3S2)Figure 6 Stage III patients(B3S2)
2.3 ORNM患者在各期中的分布及治疗效果评价
各期ORNM临床及影像学特点见表2,相应治疗方式见表4。0期8例(8.1%)患者,均接受保守型治疗(消退5例,稳定1例,进展2例)。Ⅰ期14例(14.1%)患者,治疗方式为死骨摘除术(消退9例,改善1例,稳定2例,进展2例)。Ⅱ期的患者最多,共65例(65.6%),给予的处理方案为手术切除(方块切除9例,节段切除56例)。47例(72.3%)患者接受术后重建(腓骨15例,髂骨2例,胸大肌20例,股前外侧皮瓣4例,背阔肌皮瓣3例,前臂皮瓣3例)。18例患者(9例骨坏死方块切除的患者以及节段切除中9例不适宜血管化重建的患者)未接受术后皮瓣重建。Ⅱ期整体治疗效果较好,消退率72.3%(47例)。Ⅲ期(12例,12.1%)为病理性骨折期,代表了放射性颌骨坏死的最严重阶段。下颌骨节段切除为该期最好的治疗方式,术后10例患者接受血管化皮瓣重建(4例骨皮瓣,6例软组织皮瓣),2例患者行单纯切除术。大部分患者(8例,66.7%)的治疗效果较为理想(表5)。

表4 ORNM新的临床分期及相对应的治疗方案Table 4 New ORNM staging system and the corresponding therapeutic regimens

表5 不同分期ORNM患者行相对应治疗后的预后情况Table 5 Therapeutic effects on ORNM patients at different stages after treatment
3 讨论
放射性颌骨坏死是头颈部恶性肿瘤放射治疗后常见的并发症。然而并非每位接受放疗的患者均会发生ORNJ,这可能与不同个体及不同组织对放射线的敏感性差异有关。因此,目前鲜见放射剂量与ORNJ严重程度的相关性研究报道[19]。在过去几十年中,ORNJ的主流定义为受辐照区域的坏死骨质暴露,且无法自行愈合[2,4-5,11,15-17]。然而,这种定义忽略了一种特殊的ORNJ临床表现,即存在明显的影像学改变甚至是病理性骨折,口内黏膜及口外皮肤仍然完整。起源于颌骨中心的骨坏死病损可以很好地解释这种特殊的临床现象[20]。Store等[19]发现并非所有的ORNJ均有口腔内骨质暴露的表现,基于这点其提出了新的定义:ORNJ即为受辐照区域内颌骨组织在影像学上可观察到的骨质破坏,同时排除原发肿瘤复发及放射线诱导的颌骨组织新生肿瘤。本组16例患者在影像学上可见明显的骨质坏死,但其黏膜及皮肤仍然完整。因此,本研究去除了用于诊断ORNJ的“骨质暴露”这一前提条件。
上颌骨ORN的发生率远较下颌骨ORN低。目前鲜见上颌骨ORN分类分期的研究报道[21-22]。与下颌骨ORN相比,上颌骨ORN有较好的临床转归,原因有以下几点:1)不同的解剖结构,上颌骨松质骨较多,且上方为上颌窦,阻止ORN的进一步扩展;2)骨体积较小,主要部分被上颌窦占据;3)良好的血液供应。基于这些原因,许多学者们认为即使是很严重的上颌骨ORN,保守性治疗也足以获得较好地效果[21]。Nabil等[22]将上颌窦纳入病损侵犯区域中,提出了同时适用于上、下颌骨ORN的分期系统。本研究认为上、下颌骨在解剖结构、骨密度及血供等方面均存在差异,同时上、下颌骨ORN的发病率及临床表征也不同[23],因此将上、下颌骨ORN的临床及影像学特征进行合并进而提出一个总的颌骨ORN分类及分期系统是不合理的。本研究重点阐述下颌骨ORN的分类及分期。
关于ORNJ的发病机制存在若干种不同的病因学说机制,其中最为大众所熟知并接受的是Marx等[2]提出的“低细胞、低氧、低血运”三低学说以及De⁃lanian等[13]提出的放射诱导纤维萎缩机制,然而ORNJ真正的发病机制目前尚未明确。不同严重程度的ORNJ患者其临床与影像学的表现也不尽相同[4,15]。在ORNJ的临床治疗及科学研究中,如何将这些不同的临床及影像学特征进行归纳合并进而建立一个能够评估ORNJ严重程度的体系对于外科医师来说是一个巨大的挑战。因此,我们有必要对下颌骨ORN的资料进行总结,提出一个能够指导ORNJ临床治疗及科学研究的新的分类及分期系统。
国外曾有许多学者根据其医疗机构中处理ORNM的经验提出了不同的分期系统[3-5,10,14-17,19,24-26]。在是否应该基于ORNM对于某种治疗方式的反应而建立分期系统这一方面始终存在争议。Marx等[5]认为手术加高压氧处理是治疗ORNM最有效且最常规的方式,所以其根据ORNM对高压氧治疗的效果反应提出了分期系统。同样地,Lyons等[14]将ORNM的分期与其对抗纤维化药物的反应相关联,若无反应者,则较为严重,这一分期系统在他们机构中得到了很好地预后效果支持。然而,上述两种分期方法存在一定的局限性,即不适用于未接受高压氧或抗纤维化药物治疗的患者。ORNM治疗前的正确诊断及评估,恰当地体现出疾病的临床特征是非常必要的,这也正是许多学者将其ORNM分期系统基于疾病的临床及影像学特征的原因[3-4,15-17,24]。本研究也认为这种方式更适用于治疗前诊断及对疾病严重程度的评估,甚至是预后的预判。Hutchinson等[27]提出了分类及分期系统的基本原则:1)疾病的严重程度必须定性及定量;2)对治疗效果具有预测性及指示性;3)能够评估风险;4)可以更为准确地评估危险因素;5)提供不同处理方式间的比较;6)坏死的骨质及随后的相对应治疗需得到评估。
本研究中新的ORNM临床分类及分期是基于疾病的真实临床表征及影像学特征而提出的。评估骨坏死严重程度最好的方式是测量坏死骨质的量和体积以及其占整体颌骨体积的百分比[12]。全景片运用非常广泛,但其二维结构无法区分正常与病损骨质的边界,因而无法提供精确的骨病损长度或面积。CT能够利用其三维成像技术精确地计算出病损骨质的体积及其占整个下颌骨体积的百分比,这也是评估ORNM严重程度最佳的方式。但因其软件及计算方式的复杂性,并未在临床工作中得到广泛的运用,这也可能是Lyons等[14]选择病损骨质的最大长度(2.5 cm)作为衡量ORNM严重程度指标的原因之一。在本研究的分期中选择的最大直径(选自3个不同的方向)比Lyons等[14]的最大长度能更准确地体现出骨质受损情况。以2 cm为骨质受损截点的原因在于其能够指导我们选择不同的治疗方式。如对于骨损最大直径超过2 cm的ORNM,其真实的破坏范围可能更广,且由于颌骨切除直至流血(正常骨质的标志)这一外科标准的存在,其截骨后缺损常>4 cm,这就要求我们选择皮瓣来修复患者颌面部的缺损[28]。
在本研究新的“BS”分类分期中,除了0期,其余各期均涉及黏膜及皮肤的缺损情况。在ORNM中,骨质暴露合并口内黏膜缺损以及口外皮肤瘘管的情况很常见,也容易被理解。但在影像学上明显的死骨形成乃至病理性骨折而口内黏膜及口外皮肤仍然完整的情况相当少见,很多国内外的研究曾忽视了ORNM这种特殊的临床表征。国外曾有研究表明放射线诱导的骨组织坏死可起源于颌骨中心区域,逐步进展至骨皮质[18]。这种骨侵蚀的方式较好地解释了颌骨中明显的死骨形成甚至是病理性骨折而其被覆黏膜及皮肤仍是完整的现象。这一罕见的亚型在Store等[19]的ORNM研究中也被证实。
本研究独创性地将骨组织坏死(B分类)及软组织缺损(S分类)分别进行分类,然后再将各个亚分类合并得出新的分期系统。这种研究思维与UICC所创立的恶性肿瘤TNM分期系统存在一定的相似性。通过将B分类与S分类相结合,能够非常准确而简便地描述出ORNM患者的临床特征及严重程度,同时也为治疗方案的制定提供了具有价值性的指导作用。
颌骨组织的脱矿作用是一个非常缓慢的生化过程。可在影像学上观察到颌骨组织的改变,其骨质必须大量脱矿以及一定范围的累及[29]。有报道骨质脱矿至30%~50%时才能够在影像学上显示出其与正常骨质的边界,进而能够辨别出病损的骨质[30]。放疗后颌骨组织脱矿30%以下的病例很难从影像学上对其进行诊断,患者可能也无明显的主观症状,所以骨坏死的前驱期,即本研究所认为的0期在临床上容易被忽视,也可能是国内外ORNM分期中,0期患者比例明显偏低的原因。在本研究分期系统中,8例0期患者的颌骨组织在影像学上并无明显的骨质改变,但其有ORNM相关的骨质胀痛感(轻度5例,中度3例,其中2例有骨质暴露)。在接受保守治疗后,5例患者病情得到缓解,1例保持稳定,2例病情恶化,发展成为Ⅰ期,证明了本研究分期系统中0期是Ⅰ期的前驱期,若不进行适当的干预,有可能进展成更为严重的状态。由于回顾性分析的原因,本研究未能够统计0期进展成为Ⅰ期所经历的时间跨度。Store等[19]认为0期应该是放疗后短期内颌骨组织的急性反应,能够自行恢复。其对0期进行明确地定义:口腔内骨质暴露而影像学上无明显的骨质改变。这种分期及定义存在一定的局限性:1)若口腔内暴露的骨质是正常有活力的,如何定义?2)忽略了当骨质脱矿少于30%且口腔内黏膜完整的情况。本研究对0期的定义比Store等[19]提出的概念更为合理,包含了上述两种特殊且容易被忽视的情况,同时将ORNM相关的临床症状纳入0期诊断中。本研究组相信有很多的0期患者资料因为目前概念不明确及诊断技术不全面的原因而丢失。因此建议将骨密度及骨活力测试运用于头颈部恶性肿瘤放疗后的随访中,早期发现ORNM,早期干预,阻止疾病向更严重的方向发展。
ORNM的治疗包括保守性的方式及手术切除。保守治疗包括抗生素、高压氧、局部护理、口腔卫生改善等。1980年至1990年间本院曾试行ORNM的高压氧治疗,但因其治疗效果的不明显性及昂贵的费用未能得到进一步的推广。随着功能性外科的提出,为了进一步保存下颌骨的形状与生理作用,手术的选择应由小及大,从简单地死骨移除到死骨摘除术,节段切除术,部分切除术以及最后的半侧切除术。然而,目前ORNM保守治疗与手术治疗的界限并不明确。
Santamaria等[31]曾在研究中对所有的受试对象行保守治疗试图阻止乃至逆转ORNJ的进展,然而效果不尽如人意,约70%~83%患者需要进一步的手术治疗。本研究认为ORNM患者一旦有影像学死骨表现,对死骨进行手术切除是最好的治疗方式。有些学者也认为保守性治疗的作用只是暂时的,手术切除应该成为ORNJ最主要的治疗方式[32]。一方面,经保守性治疗后死骨并不能重新恢复活力;另一方面,死骨的蔓延可能循着栓塞血管的方向,所以死骨侵犯的范围可能远比CT片观察要广得多。提示我们通过手术控制死骨的蔓延,减少其对正常骨质的影响[26]。
本研究0期患者的治疗方案为保守性治疗。对于Ⅰ期患者,死骨摘除术是首选的治疗方式,仅2例患者进展成为Ⅱ期,表明对于大多数Ⅰ期患者而言,死骨摘除术足以很好地控制ORNM的进展。这期的患者往往不需要术后重建。手术切除(方块切除或节段切除)适用于Ⅲ期患者,即骨损最大直径大于2 cm者。对于病损近牙槽窝且有足够的健康组织支撑(避免病理性骨折)者,本研究选择方块切除,亦可称为边缘性切除。对于骨损更为广泛的病例,节段切除术则为更好的选择。手术的切缘由术前CT及MR评估和术中出现的流血骨质而定。是否行修复重建及修复重建方式的选择由术后缺损范围的大小、个体全身情况及辐照区域的受区血管情况而决定[33-34]。
对下颌骨体部缺损行修复重建进而恢复其功能及美观是非常必要的。血管化骨皮瓣,如髂骨肌瓣、腓骨肌皮瓣以及肩胛骨瓣,是ORNM术后缺损的首选,因为其能够恢复骨的外形结构,同时可提供健康的血管化软组织,使放疗后局部组织的损失得到一定程度的缓解。骨移植的意义在于:1)恢复骨的连续性;2)重建牙槽骨的高度;3)防止面型塌陷;4)为后期的牙列修复提供足够的骨量[35]。此外,骨肌瓣中的软组织能够提供健康的、未照射的组织以覆盖移植骨,同时也为受区提供充足的血供[28]。对于更为复杂的口内外瘘病例,修复重建的目的在于保持口内黏膜及口外皮肤的连续性及完整性。骨肌瓣联合运用筋膜瓣修复骨组织及软组织的共同缺损是较为理想的重建方式。骨肌瓣的皮岛能够重建口内的衬里,而筋膜瓣能够修复口外的皮肤缺损[36]。此外,股前外侧及腓骨双岛皮瓣也是较为理想的重建修复选择[37-38]。
对于病理性骨折病例而言,节段切除是唯一的选择,重建的选择与Ⅱ期患者相同。本研究提出的新的分类分期系统旨在评估ORNM的严重程度,认为骨质破坏的程度最能够指导ORNM的分期。基于此本研究相对应的治疗方案主要从去除死骨组织获得健康骨质的角度出发,使得Ⅱ、Ⅲ期患者的治疗方式存在同一性。然而,此分期系统的确能够评定ORNM的严重程度,且软组织缺损的分类为术后重建的选择提供了非常重要的指导作用。对于不适宜行骨瓣修复的患者,单纯软组织修复也能够取得较好地效果,特别是下颌角及升支部的缺损。对于不适宜行皮瓣修复的患者而言,单纯手术切除也是一种可行的选择。
本研究病例中骨组织坏死及软组织缺损均得到很好的解决。然而,ORNM的进展机制仍然是迷题,于外科医师而言也是一个巨大的挑战。曾有研究表明ORNM的进展与死骨组织的充分切除并无直接的关系[39]。这些或许能够解释为何各不同期治疗后的转归并无明显的差异。
总体而言,ORNM的治疗仍然是一个重大的临床课题,特别是在早期ORNM的诊断与干预性治疗方面。一个全面且简便的临床分类分期能够较好地评估ORNM的严重程度,同时为治疗方案的选择提供一定的指导作用。此分类分期系统在本机构对ORNM的临床治疗中体现出了很好的适用性,然而仍然需要后期的前瞻性试验研究对其进行佐证。
[1] Regaud C.Sur la nécrose des os attente par un processus cancéreux et traits par les radiations[J].Compt Rend SocBiol, 1922,87:427
[2] Marx RE.Osteoradionecrosis:a new concept of its pathophysiolo⁃gy[J].J Oral Maxillofac Surg,1983,41(5):283-288.
[3] Morton ME.Osteoradionecrosis:a study of the incidence in the North West of England[J].Br J Oral Maxillofac Surg,1986,24(5): 323-331.
[4] Epstein JB,Wong FLW,Stevenson-Moore P.Osteoradionecro⁃sis:clinical experience and a proposal for classification[J].J Oral Maxillofac Surg,1987,45(2):104-110.
[5] Marx RE.A new concept in the treatment of osteoradionecrosis [J].J Oral Maxillofac Surg,1983,41(6):351-357.
[6] Annane D,Depondt J,Aubert P,et al.Hyperbaric oxygen thera⁃ py for radionecrosis of the jaw:a randomized,placebo-con⁃trolled,double-blind trial from the ORN 96 study group[J].J Clin Oncol,2004,22(24):4893-4900.
[7] Bessereau J,Annane D.Treatment of osteoradionecrosis of the jaw:the case against the use of hyperbaric oxygen[J].J Oral Maxil⁃lofac Surg,2010,68(8):1907-1910.
[8] D'Souza J,Goru J,Goru S,et al.The influence of hyperbaric oxy⁃gen on the outcome of patients treated for osteoradionecrosis:8 year study[J].Int J Oral Maxillofac Surg,2007,36(9):783-787.
[9] Maier A,Gaggl A,Klemen H,et al.Review of severe osteoradio⁃necrosis treated by surgery alone or surgery with postoperative hyperbaric oxygenation[J].Br J Oral Maxillofac Surg,2000,38(3): 173-176.
[10]Tsai CJ,Hofstede TM,Sturgis EM,et al.Osteoradionecrosis and radiation dose to the mandible in patients with oropharyngeal can⁃cer[J].Int J Radiat Oncol Biol Phys,2013,85(2):415-420.
[11]Reuther T,Schuster T,Mende U,et al.Osteoradionecrosis of the jaws as a side effect of radiotherapy of head and neck tumor pa⁃tients-a report of a 30 year retrospective review[J].Int J Oral Maxillofac Surg,2003,32(3):289-295.
[12]Chrcanovic BR,Reher P,Sousa AA,et al.Osteoradionecrosis of the jaws-a current overview-part 1:Physiopathology and risk and predisposing factors[J].Oral Maxillofac Surg,2010,14(1):3-16.
[13]Delanian S,Lefaix JL.The radiation-induced fibroatrophic pro⁃cess:therapeutic perspective via the antioxidant pathway[J].Ra⁃diother Oncol,2004,73(2):119-131.
[14]Lyons A,Osher J,Warner E,et al.Osteoradionecrosis-a review of current concepts in defining the extent of the disease and a new classification proposal[J].Br J Oral Maxillofac Surg,2014,52(5): 392-395.
[15]Schwartz HC,Kagan R.Osteoradionecrosis of the mandible scien⁃tific basis for clinical staging[J].Am J Clin Oncol,2002,25(2): 168-171.
[16]Karagozoglu KH,Dekker HA,Rietveld D,et al.Proposal for a new staging system for osteoradionecrosis of the mandible[J]. Med Oral Patol Oral Cir Bucal,2014,19(5):433-437.
[17]Notani K,Yamazaki Y,Kitada H,et al.Management of mandibu⁃lar osteoradionecrosis corresponding to the severity of osteoradio⁃necrosis and the method of radiotherapy[J].Head Neck,2003,25 (3):181-186.
[18]Store G,Larheim TA.Mandibular osteoradionecrosis:a compari⁃son of computed tomography with panoramic radiography[J]. Dentomaxillofac Radiol,1999,28(5):295-300.
[19]Store G,Boysen M.Mandibular osteoradionecrosis:clinical behav⁃iour and diagnostic aspects[J].Clin Otolaryngol Allied Sci,2000, 25(5):378-384.
[20]van Merkesteyn JP,Balm AJ,Bakker DJ,et al.Hyperbaric oxygen treatment of osteoradionecrosis of the mandible with repeated pathologic fracture.Report of a case[J].Oral Surg Oral Med Oral Pathol,1994,77(5):461-464.
[21]Cheng SJ,Lee JJ,Ting LL,et al.A clinical staging system and treatment guidelines for maxillary osteoradionecrosis in irradiated nasopharyngeal carcinoma patients[J].Int J Radiat Oncol BiolPhys,2006,64(1):90-97.
[22]Nabil S,Ramli R.The use of buccal fat pad flap in the treatment of osteoradionecrosis[J].Int J Oral Maxillofac Surg,2012,41(11): 1422-1426.
[23]Armin BB,Hokugo A,Nishimura I,et al.Brachytherapy-mediat⁃ed bone damage in a rat model investigating maxillary osteoradio⁃necrosis[J].Arch Otolaryngol Head Neck Surg,2012,138(2):167-171.
[24]Clayman L.Clinical controversies in oral and maxillofacial sur⁃gery:part two.Management of dental extractions in irradiated jaws:a protocol without hyperbaric oxygen therapy[J].J Oral Maxillofac Surg,1997,55(3):275-281.
[25]Glanzmann C,Grätz KW.Radionecrosis of the mandibula:a ret⁃rospective analysis of the incidence and risk factors[J].Radiother Oncol,1995,36(2):94-100.
[26]Coffin F.The incidence and management of osteoradionecrosis of the jaws following head and neck radiotherapy[J].Br J Radiol, 1983,56(671):851-857.
[27]Hutchinson IL.Complication of radiotherapy in the head and neck:an orofacial surgeon's view.In:Tobias JS,Thomas PRM (eds),Current radiation oncology[M].London:Hodder Arnold, 1995:144-177.
[28]Buchbinder D,St Hilaire H.The use of free tissue transfer in ad⁃vanced osteoradionecrosis of the mandible[J].J Oral Maxillofac Surg,2006,64(6):961-964.
[29]Epstein JB,Rea G,Wone FLW,et al.Osteonecrosis:study of the relationship of dental extraction in patients receiving radiotherapy [J].Head Neck Surg,1987,10(1):48-54.
[30]Malska WI.Microdensiometric analysis of the influence of x-irra⁃diation on mature bone in humans[J].Acta Med Pol,1971,12(3): 357-358.
[31]Santamaria E,Wei FC,Chen HC.Fibula osteoseptocutaneous flap for reconstruction of osteoradionecrosis of the mandible[J]. Plast Reconstr Surg,1998,101(4):921-929.
[32]Coskunfirat OK,Wei FC,Huang WC,et al.Microvascular free tissue transfer for treatment of osteoradionecrosis of the maxilla [J].Plast Reconstr Surg,2005,115(1):54-60.
[33]Chrcanovic BR,Reher P,Sousa AA,et al.Osteoradionecrosis of the jaws-a current overview-Part 2:dental management and therapeutic options for treatment[J].Oral Maxillofac Surg,2010, 14(2):81-95.
[34]Hao SP,Chen HC,Wei FC,et al.Systematic management of os⁃teoradionecrosis in the head and neck[J].Laryngoscope,1999,109 (8):1324-1327.
[35]Marx RE,Ames JR.The use of hyperbaric oxygen therapy in bony reconstruction of the irradiated and tissue deficient patients [J].J Oral Maxillofac Surg,1982,40(7):412-420.
[36]Baumann DP,Yu P,Hanasono MM,et al.Free flap reconstruc⁃tion of osteoradionecrosis of themandible:a 10-year review and defect classification[J].Head Neck,2011,33(6):800-807.
[37]Jones NF,Vögelin E,Markowitz BL,et al.Reconstruction of com⁃posite through-and-through mandibular defects with a doubleskin paddle fibular osteocutaneous flap[J].Plast Reconstr Surg, 2003,112(3):758-765.
[38]Yu P.One-stage reconstruction of complex pharyngoesophageal, tracheal,and anterior neck defects[J].Plast Reconstr Surg,2005, 116(4):949-956.
[39]Zaghi S,Miller M,Blackwell K,et al.Analysis of surgical margins in cases of mandibular osteoradionecrosis that progress despite ex⁃tensive mandible resection and free tissue transfer[J].Am J Otolar⁃yngol,2012,33(55):576-580.
(2015-06-19收稿)
(2015-08-18修回)
(编辑:邢颖)
Proposed"BS"classification of osteoradionecrosis of the mandible and the corresponding therapeutic strategy
Yue HE1,Zhonglong LIU1,Tianguo DAI1,Zhonghe WANG2,Zhiyuan ZHANG1
1Department of Oral Maxillofacial and Head and Neck Oncology,2Department of Radiotherapy,Shanghai Ninth People's Hospital, College of Stomatology,Shanghai Jiao Tong University School of Medicine,Shanghai Key Laboratory of Stomatology,Shanghai 200011,China
This study was supported by the National Natural Science Foundation of China(No.81271112),Development Foundation supported by the Shanghai Municipal Human Resources and Social Security Bureau(No.201312),and SMC Rising Star(A)Scholar Project supported by Shanghai Jiao Tong University
Objective:To introduce a novel clinical classification that can be applied to osteoradionecrosis treatment in an easy and considerably acceptable manner through a retrospective analysis of patients with osteoradionecrosis of the mandible(ORNM). Methods:The clinical data of 99 ORNM patients admitted to shanghai Ninth People's Hospital between 2000 and 2013 were summarized.A novel classification was established based on bone necrosis and soft tissue lesions.The new staging system was developed based on"B"and"S"classifications.Corresponding strategies and methods of ORNM treatment at different stages were also proposed. Results:A new staging system with four different stages(i.e.,stage 0:8 cases;stageⅠ:14 cases;stageⅡ:65 cases;and stageⅢ:12 cases)was proposed.Conservative treatment was applied to stage 0 patients,whereas sequestrectomy was performed in stageⅠcases. Marginal or segmental resection of the mandible was selected for stageⅡpatients;osteocutaneous flap or just soft tissue flap was also reconstructed.Conclusion:This new classification and staging system is easier to use and more acceptable for clinical evaluation than other systems.
osteoradionecrosis of the mandible,radiotherapy,clinical classification and staging systems,"BS"classification,therapeutic strategy

10.3969/j.issn.1000-8179.2015.16.862
①上海交通大学医学院附属第九人民医院口腔颌面-头颈肿瘤科,上海市口腔医学重点实验室(上海市200011);②口腔放疗科
*本文课题受国家自然科学基金(编号:81271112)、上海人才发展资金项目(编号:201312)和上海交通大学晨星计划“A”类计划资助
张志愿 zhzhy0502@163.com
张志愿 专业方向为口腔颌面部肿瘤的临床诊治与基础研究。
E-mail:zhzhy0502@163.com

