橙汁模拟体系非酶褐变产物及评价标准
韩 智,李 申,马亚琴*,窦华亭*,龚 蕾,朱攀攀
(西南大学柑桔研究所,国家柑桔工程技术研究中心,重庆 400712)
橙汁模拟体系非酶褐变产物及评价标准
韩 智,李 申,马亚琴*,窦华亭*,龚 蕾,朱攀攀
(西南大学柑桔研究所,国家柑桔工程技术研究中心,重庆 400712)
以橙汁中糖、氨基酸、抗坏血酸、柠檬酸为变量构建不同的非酶褐变模拟体系,通过研究体系贮藏期间3-羟基-2-吡喃酮(3-hydroxy-2-pyrone,3OH2P)、5-羟甲基糠醛(5-hydroxymethylfurfural,5-HMF)、糠醛(furfural,2-F)3 种褐变产物的变化,确定褐变产物的可能来源;通过分析比较褐变度(A420nm)、褐变指数(browning index,BI)、总色差值(ΔE)3 种非酶褐变评价标准的相关性,确定不同评价标准是否有一致性。结果表明:果糖降解是生成5-HMF的主要途径,3OH2P来源于抗坏血酸的降解,糖能促进2-F的生成;在含糖的模拟体系中,A420nm、BI、ΔE相互之间均呈显著正相关(P<0.05),这3 种评价标准具有一致性;然而在不含糖的体系中,A420nm与BI、Δ E均无显著相关性(P>0.05),这3 种评价标准存在差异性。
模拟体系;橙汁;非酶褐变;评价标准;相关性
橙汁是全球消费量最大的果汁饮料,也是世界上最受欢迎的饮料之一,其品质主要取决于色泽和风味,特别是色泽,直接决定了消费者的购买欲望[1]。非酶褐变是导致橙汁色泽劣变的直接原因,对非酶褐变基础科学问题的研究有助于产业健康发展。
科学评价非酶褐变程 度是研究果汁褐变相关问题的基础。美拉德反应中间产物在420 nm波长处有最大吸收,常利用420 nm波长处吸光度(A420nm)确定果汁非酶褐变程度[2]。在苹果汁[3]、梨汁[4]、香蕉汁[5]、桃汁[6]、荔枝汁[7]、龙眼汁[8]等果汁的非酶褐变评价中,A420nm得到普遍使用。然而橙汁非酶褐变产物复杂,仅用A420nm表示橙汁的褐变程度缺乏客观性和科学性[9-10]。有研究[11-12]表明色差仪的色泽参数经过公式计算而得来的褐变指数(browning index,BI)、ΔE能很好地表示橙汁褐变程度。研究A420nm、BI、ΔE这3 种评价标准的相关性对科学评价非酶褐变具有十分重要的意义。
A420nm、BI、ΔE这3种评价标准是基于颜色变化从而达到间接评价褐变的目的,这种颜色差异是由褐变产物浓度变化所造成的。3-羟基-2-吡喃酮(3-hydroxy-2-pyrone,3OH2P)、5-羟甲基糠醛(5-hydroxymethylfurfural,5-HMF)、糠醛(furfural,2-F)被认为是橙汁的主要褐变产物[13]。已知3OH2P、2-F的形成与抗坏血酸降解相关,5-HMF则与糖降解相关[14-17]。不同褐变产物的具体来源、不同褐变产物与褐变评价标准的相关性研究对深入探究橙汁非酶褐变标准有重要意义。
通过模拟体系研究复杂食品的非酶褐变被证明是一种科学的方法,能得出有指导意义的结论[18]。本实验通过构建不同橙汁模拟体系,对褐变产物的质量浓度变化、非酶褐变评价标准等内容进行分析,初步探究非酶褐变产物来源及不同褐变标准是否具有一致性,以期为橙汁非酶褐变的后续研究作一定参考。
1 材料与方法
1.1 材料与试剂
果糖、葡萄糖、蔗糖、天冬氨酸、精氨酸、丝氨酸、丙氨酸、抗坏血酸、柠檬酸(均为分析纯) 北京百灵威科技有限公司;磷酸二氢钾(色谱纯) 成都市科龙化工试剂厂;乙腈(色谱纯) 美国Sigma公司;5-HMF、2-F标准品 美国ChromaDex公司;3OH2P(对照品) 烟台凯博医药科技有限公司。
1.2 仪器与设备
Ultimate 3000高效液相色谱仪 戴安(中国)有限公司;Color i5色差仪 美国Gretag Macbeth公司;TU-1901紫外-可见分光光度计 北京普析通用仪器有限责任公司;FE20 pH计 梅特勒-托利多(上海)有限公司;FA2004B电子分析天平 上海精密科学仪器有限公司;SPX-150-Z 恒温培养箱 上海博泰实验设备有限公司。
1.3 方法
1.3.1 模拟体系的构建
参照橙汁基本营养物质组成,构建由4 种氨基酸、3 种简单糖类、2 种酸组成的橙汁标准模拟体系,命名为M1[15]。为深入研究褐变产物来源及不同褐变评价标准的相关性,通过改变体系理化成分含量,构建其他5 种体系,分别命名为M2、M3、M4、M5、M6,模拟体系的具体构成如表1所示。所有模拟体系在50 ℃恒温条件下贮藏,每10 d测定一次指标。
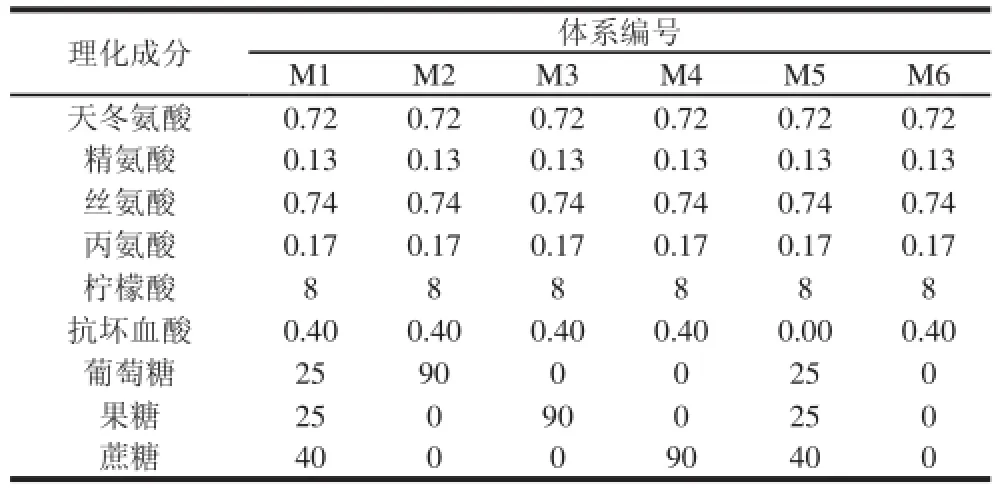
表1 橙汁模拟体系表Table1 Composition of model system of orange juice g/L
1.3.2 A420nm的测定
取适量待测样品与等量丙酮混合均匀,测定420 nm波长处吸光度[2]。
1.3.3 BI、ΔE的测定
利用Color i5 色差仪测定模型溶液的色差值L*、a*、b*,并由公式(1)计算ΔE值,由(2)计算BI[6]。
1.3.4 3OH2P、5-HMF、2-F的测定
采用高效液相色谱法,色谱条件参照Shinoda等[15]的方法并稍作修改。色谱柱:WATERS C18(250 mm×4.6 mm,5 μm);流动相:乙腈-5%乙酸(2∶98,V/V);检测波长:283 nm;流速:1.0 mL/min;柱温:30 ℃;进样量:20 μL。
1.4 数据分析
2 结果与分析
2.1 非酶褐变产物的变化
2.1.1 模拟人体系中3OH2P的变化
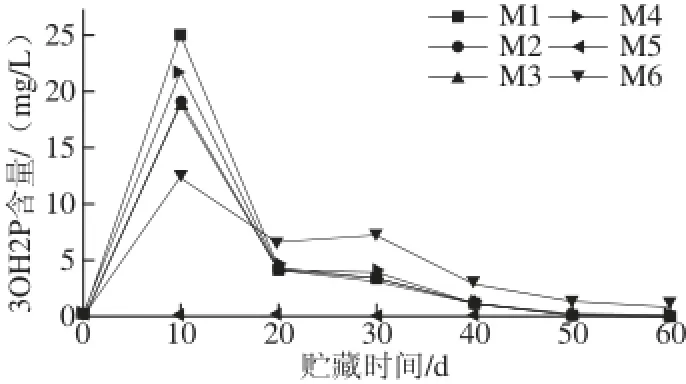
图1 模拟体系中3OH2P含量的变化Fig.1 Changes of 3OH2P content in all model systems
由图1可知,M5(缺抗坏血酸)在整个贮藏期内均无3OH2P形成,说明抗坏血酸是生成3OH2P的必要条件。抗坏血酸通过有氧降解途径脱氢生成脱氢抗坏血酸,然后脱水、脱羧形成酮木糖,最后脱水形成3OH2P[14]。在所有含抗坏血酸的模拟体系中,3OH2P均呈现先快速上升后急速下降的趋势,这可能是因为在贮藏前期,抗坏血酸迅速降解生成3OH2P,后快速降解。然而Hsu等[16]发现抗坏血酸-乙醇溶液的降解产物3OH2P的含量随贮藏时间累积升高,并认为3OH2P是抗坏血酸的终端产物。在本实验条件下,3OH2P变化趋势并不是Hsu等[16]描述的,其原因可能是3OH2P在酸性条件下与共存的糖、氨基酸发生相互作用。与M6(不含糖)相比,所有含糖体系在贮藏50 d后3OH2P完全降解,这说明糖及其降解产物在贮藏后期可能促进3OH2P的降解。
2.1.2 模拟人体系中5-HMF的变化
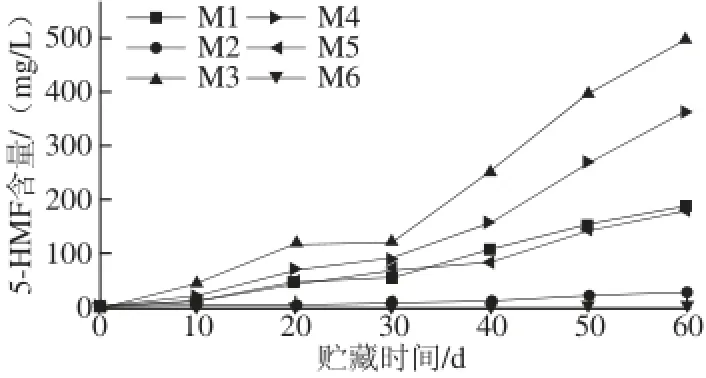
图2 模拟体系中5-HMF含量的变化Fig.2 Changes of 5-HMF content in all model systems
由图2可知,在M 6(缺少糖)中并未检测到5-HMF,而其他体系均有5-HMF的积累,这说明在这6 种模型溶液中,糖是5-HMF生成的必要条件,抗坏血酸和氨基酸并不能生成5-HMF。5-HMF的形成可能与糖受热降解有关,己糖(葡萄糖、果糖)经历脱水、裂解、异构化等化学反应,最终生成5-HMF;而蔗糖在酸性环境下水解为还原糖后再形成5-HMF[17]。
在第10~60天中,M2(含90 g/L葡萄糖)中5-HMF从0.98 mg/L增长为29.15 mg/L,而M3(含90 g/L果糖)中5-HMF从40.09 mg/L增长为495.96 mg/L。在50 ℃条件下贮藏60 d后,等量果糖、葡萄糖、蔗糖形成5-HMF能力不同,果糖为葡萄糖的17 倍,蔗糖为葡萄糖的12 倍。在酸性环境下(pH 2~6),果糖的反应活性比葡萄糖高5 倍,果糖形成呋喃果糖基阳离子的能力强于葡萄糖,且进行烯醇化反应比葡萄糖更快,更容易生成5-HMF[19-20]。
2.1.3 模拟体系中2-F的变化

图3 模拟体系中2-F含量的变化Fig.3 Changes of 2-F content in all model systems
由图3可知,M5(缺少抗坏血酸)在前30 d并无2-F生成,但随后显著升高(P<0.05)。在10~30 d贮藏期内,与标准模拟体系(M1)相比,移除糖类(M6)后,2-F含量在贮藏10、20、30 d时分别下降了41%、52%、64%,这说明糖的存在能促进2-F的生成。从图3中M2、M3、M4可以看出,不同种类糖促进2-F生成的能力不同,其能力大小为蔗糖>葡萄糖>果糖。M5中并不存在抗坏血酸降解反应,因此30 d后形成2-F最可能与贮藏后期生成的醛糖酸有关。已有研究[21-24]表明橙汁及其模拟体系中抗坏血酸的降解是生成2-F的主要途径;戊糖、醛糖酸的降解也是形成2-F的途径之一;2-F还可以与氨基化合物继续反应并参与美拉德后期反应,最终生成黑色素。
2.2 非酶褐变评价标准的变化
2.2.1 A420nm的变化
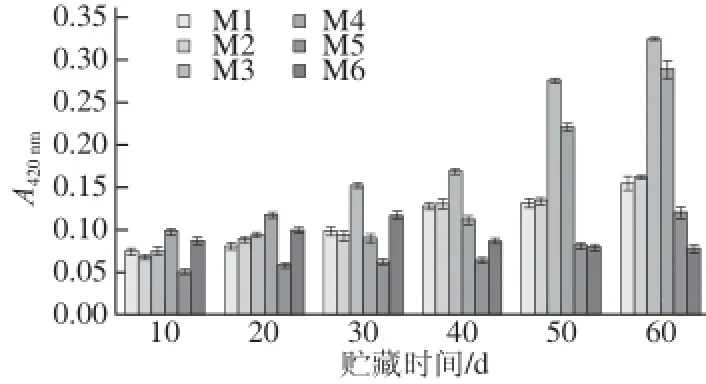
图4 模拟体系A42200nnmm的变化Fig.4 Changes of A420nmin all model systems
通过对图4分析得出,在相同贮藏时间内M 3(含90 g/L果糖)的褐变度均显著高于其他模拟体系(P<0.05);M1~M5的褐变度随贮藏时间延长显著上升(P<0.05);M6(缺糖)的褐变度随时间变化不显著,呈现先升后降趋势。
贮藏60 d后,M2(含90 g/L葡萄糖)、M3(含90 g/L果糖)、M4(含90 g/L蔗糖)的褐变度分别为M1的105%、209%、186%,这表明等量葡萄糖、果糖、蔗糖在非酶褐变中的贡献率不同,贡献率由大到小为果糖>蔗糖>葡萄糖。将M5(缺抗坏血酸)与M1(标准模拟体系)对比,发现移除抗坏血酸能使褐变度降低30%~50%,说明抗坏血酸降解是非酶褐变主要来源之一。
2.2.2 Δ E的变化
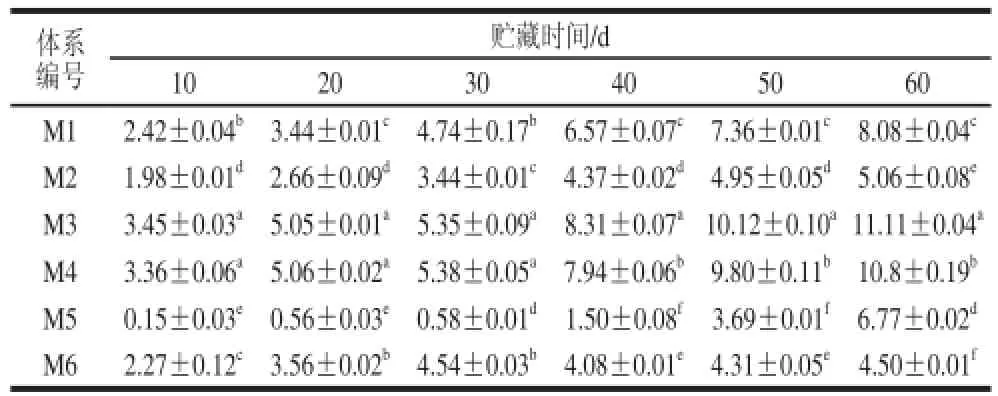
表2 模拟体系ΔE变化情况Table2 Changes of total color difference in all model systems
由表2可以看出,在相同贮藏时间内,M3(含90 g/L果糖)、M4(含90 g/L蔗糖)的ΔE均显著高于其他4 种模拟体系(P<0.05),而M5(缺抗坏血酸)的ΔE显著低于其他体系(P<0.05)。这表明在贮藏过程中M3、M4发生非酶褐变所产生的色泽变化是最大的,而M5(缺抗坏血酸)产生非酶褐变导致的色泽变化是最不明显的。Limbo等[25]用ΔE=1.5作为视觉能否分辨的界限,当ΔE<1.5时,色泽的变化在视觉上是无法察觉的。在所有模拟体系中,仅有M5(缺抗坏血酸)在前40 d贮藏期内色泽变化不易察觉,其他所有体系在观测期内色泽变化均明显。
2.2.3 褐变评价标准相关性分析
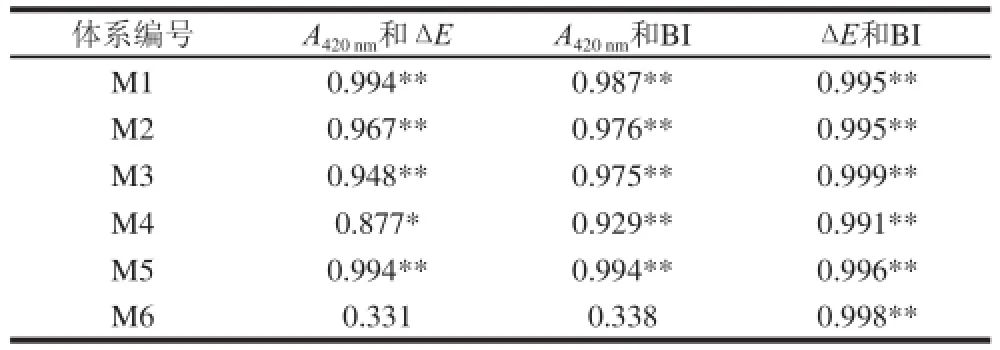
表3 不同模拟体系褐变评价标准相关性分析Table3 Correlation analysis of browning evaluation criteria in different model systems
由表3可知,除M6(缺糖)外,其他所有含糖体系的A420nm与BI、ΔE均显著相关(P<0.05)。BI与ΔE在所有模拟体系中均具有极显著相关性(P<0.01)。在M6中,A420nm与BI、A420nm与ΔE无显著相关性(P>0.05),这可能与A420nm的评价原理相关。A420nm与美拉德反应中期产物质量浓度呈正比,糖是参与美拉德反应的重要底物之一,与其他体系相比,M6缺少糖,因此在此体系中可能并未累积美拉德反应产物。而A420nm的变化可能与抗坏血酸降解、氨基酸脱水缩合的产物相关,这表明用A420nm表示非酶褐变程度存在一定的局限性。ΔE与BI在所有体系中均表现为极显著性相关,可能是因为ΔE和BI均是通过色差仪L*、a*、b*值计算得来,其测定原理一致,因此在不同体系中均具有极显著相关性。
由相关性分析可知,在含糖橙汁模拟体系中,这3 种褐变评价指标具有相同的评价效果。但是,由于褐变评价原理不同,在缺少糖的模拟体系中,A420nm与BI、Δ E评价结果不同。
2.2.4 褐变产物与褐变指标相关性分析
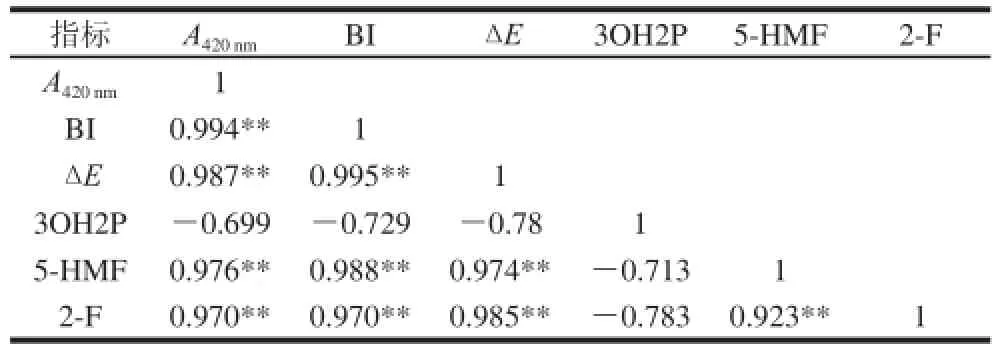
表4 标准模拟体系(M1)褐变产物与褐变评价指标相关性Table4 Correlation analysis between browning products and evaluation criteria in standard model system (M1)
如表4所示,3OH2P与3 种褐变评价指标均无显著相关性(P>0.05),而5-HMF、2-F与3 种褐变评价标准均呈极显著正相关(P<0.01)。由此可知,相比于3OH2P,5-HMF和2-F能更好地反映非酶褐变程度,可能是导致橙汁发生褐变现象的主要产物,可作为橙汁褐变指示物。
3 结 论
通过模拟体系研究发现5-HMF主要来源于果糖的降解,抗坏血酸和氨基酸的降解并不产生5-HMF;3OH2P来源于抗坏血酸降解,糖和氨基酸的降解并不生成3OH2P;2-F主要来源于抗坏血酸的降解,糖能够促进2-F的生成。研究还发现等量果糖、葡萄糖、蔗糖对非酶褐变贡献不同,从大到小为果糖>蔗糖>葡萄糖,这表明橙汁中果糖相对含量越高,橙汁可能越容易褐变。
通过对不同褐变评价标准的相关性分析发现,A420nm、ΔE、BI在含糖的模拟体系中均呈显著正相关(P<0.05),表明它们具有一致性;而在不含糖体系中,A420nm与ΔE、A420nm与BI均无显著相关性(P>0.05),表明它们具有差异性。在利用模拟体系研究橙汁非酶褐变问题时,应使用不同评价标准对褐变程度进行评价,以此验证研究结果的科学性。另外,在标准模拟体系中,5-HMF、2-F与3 种评价标准均极显著正相关(P<0.01),说明5-HMF、2-F可能是引起橙汁褐变的关键产物,可考虑作为非酶褐变指示物。
[1] WIBOWO S, GRAUWET T, SANTIAGO J S, et al. Quality changes of pasteurised orange juice during storage: a kinetic study of specifi c parameters and their relation to colour instability[J]. Food Chemistry, 2015, 187: 140-151.
[2] VALDRAMIDIS V P, CULLEN P J, TIWARI B K, et al. Quantitative modelling approaches for ascorbic acid degradation and non-enzymatic browning of orange juice during ultrasound processing[J]. Journal of Food Engineering, 2010, 96(3): 449-454.
[3] 郭善广, 仇农学. 苹果浓缩汁非酶褐变动力学及影响因素[J]. 食品科学, 2010, 31(23): 79-83.
[4] 徐芹. 砀山酥梨果汁褐变机理及控制技术研究[D]. 南京: 南京农业大学, 2008.
[5] 刘小玲, 张文灿, 姜元欣, 等. 香蕉全果原汁贮藏期间的非酶褐变分析[J]. 食品科学, 2010, 31(18): 411-415.
[6] 阮卫红, 邓放明, 毕金峰, 等. 桃汁热处理过程中非酶褐变动力学研究[J]. 食品科学, 2014, 35(1): 50-55. doi: 10.7506/spkx1002-6630-201401010.
[7] 万鹏, 刘亮, 潘思轶, 等. 热处理对荔枝果汁品质的影响[J]. 食品科学, 2010, 31(7): 22-27.
[8] 刘畅. 内源因子对龙眼汁非酶褐变影响研究[D]. 武汉: 华中农业大学, 2008.
[9] MATIACEVICH S, PILARBUERA M. A critical evaluation of fl uorescence as a potential marker for the Maillard reaction[J]. Food Chemistry, 2006, 95(3): 423-43 0.
[10] 黎婕, 陈中, 林伟锋, 等. 分光光度法分析柚子果肉汁的非酶褐变[J].食品工业科技, 2012, 33(21): 90-92; 95.
[11] KOCA N, BURDURLU H S, KARADENIZ F. Kinetics of nonenzymatic browning reaction in citrus juice c oncentrates during storage[J]. Turkish Journal of Agriculture and Forestry, 2004, 27(6): 353-360.
[12] WANG Siyuan, LIN Tiantian, MAN Guowei, et al. Effects of antibrowning combinations of ascorbic acid, citric acid, nitrogen an d carbon dioxide on the quality of banana smoothies[J]. Food and Bioprocess Technology, 2014, 7(1): 161-173.
[13] BHARATE S S, BHARATE S B. Non-enzymatic browning in citrus juice: chemical markers, their detection and ways to improve product quality[J]. Journal of Food Science and Technology, 2014, 51(10): 2271-2288.
[14] YUAN Jianping, CHEN Feng. Degradation of ascorbic acid in aqueous solution[J]. Journal of Agricultural and Food Chemistry, 1998, 46(12): 5078-5082.
[15] SHINODA Y, MURATA M, HOMMA S, et al. Browning and decomposed products of model orange juice[J]. Bioscience, Biotechnology, and Biochemistry, 2004, 68(3): 529-536.
[16] HSU H, TSAI Y, FU C, et al. Degradation of ascorbic acid in ethanolic solutions[J]. Journal of Agricultural and Food Chemistry, 2012, 60(42): 10696-10701.
[17] 张玉玉, 宋弋, 李全宏. 食品中糠醛和5-羟甲基糠醛的产生机理、含量检测及安全性评价研究进展[J]. 食品科学, 2012, 33(5): 275-280.
[18] 韩希凤, 李书启. 利用模拟体系研究大枣浓缩汁的非酶褐变机制[J].食品工业科技, 2015, 36(7): 105-108; 117.
[19] PEREZ LOCAS C, YAYLAYAN V A. Isotope labeling studies on the formation of 5-(hydroxymethyl)-2-furaldehyde (HMF) from sucrose by pyrolysis-GC/MS[J]. Journal of Agricultural and Food Chemistry, 2008, 56(15): 6717-6723.
[20] 张玉玉, 张兴, 章慧莺, 等. 3 种单糖模拟体系中5-羟甲基糠醛的形成动力学分析[J]. 食品科学, 2014, 35(17): 41-47. doi: 10.7506/ spkx1002-6630-201417009.
[21] KANNER J, HAREL S, FISHBEIN Y, et al. Furfural accumulation in stored orange juice concentrates[J]. Journal of Agricultural and Food Chemistry, 1981, 29(5): 948-949.
[22] LI Zhongfu, SAWAMURA M, YANO H. Effect of oxygen on the browning and formation of furfural in Yuzu juice[J]. Agricultural and Biological Chemistry, 1989, 53(7): 1979-1981.
[23] HUYGHUES-DESPOINTES A, YAYLAYAN V A. Retro-aldol and redox reactions of Amadori compounds: mechanistic studies with variously labeled D-[13C] glucose[J]. Journal of Agricultural and Food Chemistry, 1996, 44(3): 672-681.
[24] SHINODA Y, KOMURA H, HOMMA S, et al. Browning of model orange juice solution: factors affecting the formation of decomposition products[J]. Bioscience, Biotechnology, and Biochemistry, 2005, 69(11): 2129-2137.
[25] LIMBO S, PIERGIOVANNI L. Shelf life of minimally processed potatoes. Part 1. Effects of high oxygen partial pressures in combination with ascorbic and citric acids on enzymatic browning[J]. Postharvest Biology and Technology, 2006, 39(3): 254-264.
Reaction Products and Evaluation Criteria of Non-Enzymatic Browning in Model Orange Juice
HAN Zhi, LI Shen, MA Yaqin*, DOU Huating*, GONG Lei, ZHU Panpan
(National Citrus Engineering Research Center, Citrus Research Institute, Southwest University, Chongqing 400712, China)
A model solution of orange juice containing sugars, amino acids, ascorbic acid and citric acid was prepared. The formation of non-enzymatic browning reaction products including 3-hydroxy-2-pyrone(3OH2P), 5-hydroxymethylfurfural (5-HMF) and furfural (2-F) was examined during storage, and meanwhile the correlation analysis of browning evaluation criteria including absorbance value at 420 nm (A420nm), browning index (BI) and total color difference(ΔE) were also measured. The results indicated that 5-HMF and 3OH2P mainly derived from fructose and ascorbic acid, respectively, while the formation of 2-F was stimulated by sugars. Signifi cant positive correlations (P < 0.05) were found among A420nm, BI and Δ E in system containing sugars, but no signifi cant relationship (P > 0.05) was found in system lacking sugars.
model system; orange juice; non-enzymatic browning; evaluation criteria; correlation analysis
TS255.44 ;TS201.2
A
1002-6630(2015)22-0117-05
10.7506/spkx1002-6630-201522021
2015-05-27
国家现代农业(柑橘)产业技术体系建设专项(CARS-27-05B);中央高校基本科研业务费专项(XDJK2015B004)
韩智(1990—),男,硕士研究生,研究方向为食品化学与营养。E-mail:han2299@126.com
*通信作者:马亚琴(1978—),女,副研究员,博士,研究方向为食品科学。E-mail:myaya211@163.com
窦华亭(1961—),男,研究员,博士,研究方向为食品科学。E-mail:hdou33880@yahoo.com

