两步盐析联合双水相萃取提取纯化蓝藻中藻蓝蛋白
张发宇,赵冰冰,陈 裕,袁梦媛,汪家权*
(合肥工业大学资源与环境工程学院,安徽 合肥 230009)
两步盐析联合双水相萃取提取纯化蓝藻中藻蓝蛋白
张发宇,赵冰冰,陈 裕,袁梦媛,汪家权*
(合肥工业大学资源与环境工程学院,安徽 合肥 230009)
以巢湖新鲜蓝藻为处理对象,采取冻融破壁的方式获取藻蓝蛋白的粗提液,采取两步盐析联合双水相萃取的方法提取纯化藻蓝蛋白。运用0.618法选点实验研究了两步盐析中(NH4)2SO4饱和度对提取纯化影响,构建了聚乙二醇(polyethylene glycol,PEG)-(NH4)2SO4的双水相体系,综合考虑PEG相对分子质量、PEG质量分数、(NH4)2SO4质量分数、pH值和藻蓝蛋白质量浓度对提取纯化藻蓝蛋白的影响。结果表明:室温25 ℃条件下,一步盐析时(NH4)2SO4的最佳饱和度为21%,二步盐析时(NH4)2SO4的最佳饱和度为30%。两步盐析后得到的藻蓝蛋白构建成PEG-(NH4)2SO4的双水相体系后,当PEG相对分子质量1 000、PEG 1 000质量分数10%、(NH4)2SO4质量分数25%时,藻蓝蛋白的纯度可达3.45。
两步盐析;双水相萃取;提取纯化;藻蓝蛋白
富营养化是指由于人类的活动,水体中营养物质增加(一般是氮、磷的化合物),引起浮游植物过量生长和整个水体生态平衡的改变,因而造成危害的一种污染现象[1]。其结果是引起水质恶化、溶解氧耗竭、透明度降低、渔业减产、阻塞航道,对人和动物产生毒性等。这种现象在江河湖泊中称为“水华”,在海洋 则称为“赤潮”。水华的发生不仅制约了湖泊水资源的可利用行,而且直接危害人类的健康生存和社会经济的可持续发展[2]。
湖泊中富营养化主要表现形式为蓝藻爆发,水华污染严重。目前,对水华蓝藻资源化研究较多是蓝藻产沼气和用作低端肥料[3],产品附加值低,经济效益不高,要实现新鲜蓝藻的资源化,从中提取高附加值藻蓝蛋白的资源化路线,最为符合目前经济社会需求。很多研究表明高纯度藻蓝蛋白具有良好的功效,如抗炎性[4]、抗癌性[5]、抗衰老性[6]、抗氧化性[7-8]、免疫荧光性[9-10]等。水华蓝藻中藻蓝蛋白的含量达5%以上[11],从水华蓝藻中提取纯化纯天然的藻蓝蛋白既能达到消除污染的目的,又可实现经济效益的最大化。
提取纯化藻蓝蛋白的研究[12-19]较多,实验选择以反复冻融破壁的方式获得藻蓝蛋白粗提液,在此基础上研究盐析法联合双水相萃取法提取纯化藻蓝蛋白的最优组合条件。根据前期破壁蓝藻获取藻蓝蛋白的实验结果[20],选用了反复冻融破壁提取藻蓝蛋白粗提液。另外,因为盐析法具有应用成熟、材料来源广泛、易于工业化等优点。双水相萃取不仅条件温和、容易放大、可连续操作,还能使目标蛋白的纯度得到较大提升,现已被广泛用于蛋白质、核酸、氨基酸、多肽、细胞器等产品的分离和纯化[21-22]。因此选用盐析法联合双水相萃取法提取纯化藻蓝蛋白。
1 材料与方法
1.1 材料与试剂
新鲜蓝藻藻泥采自巢湖西湖区水华暴发表层20 cm水体,含水量约为96.2%,采集日期为2013年8月9日,采样期间天气晴朗,室外气温37~38 ℃。蓝藻采集后运回实验室放入冰柜内贮存备用。
(NH4)2SO4、NaOH 广东西陇化工股份有限公司;NaCl 天津市致远化学试剂有限公司;硫酸 上海振企化学试剂有限公司;乙醇 上海苏懿化学试剂有限公司;所有试剂均为国产分析纯。
1.2 仪器与设备
UV/VΙS-1950型紫外-可见分光光度仪 北京普析通用公司;85-2A型恒温搅拌器 江苏金城国胜仪器厂;KDC-160HR型低温高速离心机 安徽中科中佳仪器公司;BC/BD-718DTF型冷柜 天长市天一电器有限公司。
1.3 方法
主要表现为呼吸道症状和神经症状。雏鸡表现明显的呼吸困难,呼吸时张口伸颈,气喘,发出“呼噜”声,咳嗽,口中有粘液,有摇头和吞咽动作,并出现死亡。一周左右大部分病鸡出现好转,少数鸡出现扭颈、歪头,头向后仰,共济失调等神经症状,安静时恢复常态,稍遇刺激,反复发作,成年产蛋鸡表现轻微,产蛋率下降10%~30%,同时蛋的品质下降。
1.3.1 各指标的计算
藻蓝蛋白在620 nm波长处有特征吸收峰,蛋白在280 nm波长处有最大吸收峰,藻蓝蛋白的纯度(P)测量参考Herrera等[23]推荐的公式,藻蓝蛋白质量浓度(ρ)、得率(Q)参考Soni等[24]的推荐公式,藻蓝蛋白在双水相中的分配系数(K)、在上相中的回收率(Y)参见文献[25]。
藻蓝蛋白纯度见公式(1):

藻蓝蛋白质量浓度见公式(2):
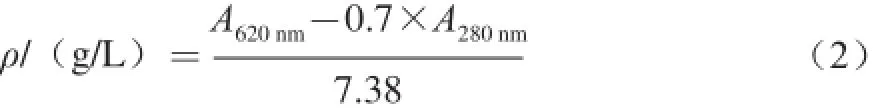
藻蓝蛋白得率见公式(3):
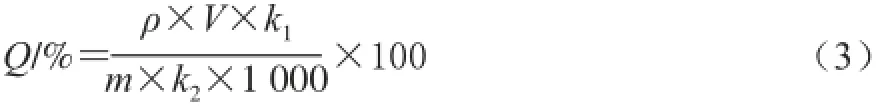
藻蓝蛋白分配系数见公式(4):


式(1)~(5)中:A280nm、A620nm、A650nm分别为波长280、620、650 nm处的吸光度;V为藻蓝蛋白体积/mL;m为藻泥质量/g;k1为藻蓝蛋白稀释倍数;k2为藻泥中蓝藻干物质的质量分数/%;Ct、Cb分别为双水相体系中上下相的藻蓝蛋白质量浓度/(g/L);R为双水相中上下相的体积比。
1.3.2 藻蓝蛋白粗提液的制备
取冷冻保存的含水率为9 6.2%的巢湖新鲜水华蓝藻,反复冻融3次。取解冻后的蓝藻于4 ℃、8 000 r/min离心20 min,上清液过4 层普通纱布,即可得到藻蓝蛋白粗提液。
1.3.3 两步(NH4)2SO4盐析
根据0.618法的原理,在10%~60%的(NH4)2SO4饱和度范围内,进行一步盐析:分别向1.3.2节中所取得藻蓝蛋白粗提液中缓慢加入(NH4)2SO4,以防止溶液局部质量浓度过高导致蛋白质变性。(NH4)2SO4的饱和度调节至17%、19%、20%、21%、22%、24%、29%、41%共8 组。溶解后4 ℃、8 000 r/min离心20 min,倾倒上清液,测定藻蓝蛋白纯度和得率。根据0.618法的原理,在(NH4)2SO4饱和度为21%~70%范围内,进行二步盐析:将1.3.2节取得藻蓝蛋白粗提液经一次盐析,即(NH4)2SO4饱和度调至21%,离心,取上清液备用。分别将备用液中(NH4)2SO4的饱和度追加至28.16%、29.28%、29.8%、30.4%、30.92%、32.56%、35.32%、39.72%、51.28%共9 组。溶解后4 ℃、8 000 r/min离心10 min,沉淀用磷酸缓冲溶液(0.002 5 mol/L)溶解后测藻蓝蛋白纯度和得率。
1.3.4 光谱图绘制
藻蓝蛋白粗提液经250~700 nm波长范围扫描,发现藻蓝蛋白在620 nm波长处有特征吸收峰,在280 nm波长处有最大吸收峰,经计算藻蓝蛋白粗提液纯度0.426,光谱图如图1所示。

图1 藻蓝蛋白紫外-可见吸收光谱图Fig.1 UV-visible absorption spectrum of phycocyanin
1.3.5 正交试验因素与水平设计
两步盐析实验的基础上,获得了纯度为1.969的藻蓝蛋白溶液。考虑该溶液中有部分(NH4)2SO4剩余,因此直接建立起聚乙二醇(polyethylene glycol,PEG)-(NH4)2SO4双水相体系,综合考虑PEG相对分子质量、PEG质量分数、(NH4)2SO4质量分数、pH值和藻蓝蛋白质量浓度的影响,以藻蓝蛋白纯度为衡量指标,了解双水相分层的情况,以此探索双水相体系的效果,按照L16(54)建立正交试验,影响因素及水平如表1所示。
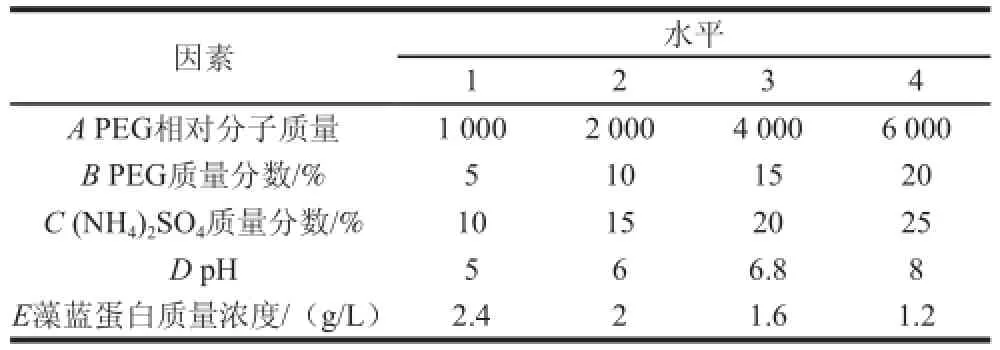
表1 PEG-((NNHH4)2SSOO4正交试验影响因素及水平Table1 Factors and levels used in orthogonal array experiments on aqueous PEG--((NNHH4)2SSOO4two-phase systteemm
2 结果与分析
2.1 一步盐析单因素试验结果
在室温25 ℃条件下,在10%~60%的(NH4)2SO4饱和度范围内,依据1.3.3节步骤进行实验,与一些盐析法较粗放选取单因素试验点相比[26],最终根据0.618法的原理精细选取了(NH4)2SO4饱和度为17%~41%,即图2中1~8实验序号点,测定上清液中藻蓝蛋白纯度和得率。

图2 一步盐析((NNHH4)2SSOO4饱和度对藻蓝蛋白纯度和得率的影响Fig.2 Effect of different degrees of ammonium sulfate saturation on phycocyanin purity and yield in the fi rst salting-out prec ipitation
图2 为一步盐析时,藻蓝蛋白纯度和得率在(NH4)2SO4饱和度为10%~60%之间的变化情况。当(NH4)2SO4饱和度在10%~21%时,上清液中藻蓝蛋白纯度和得率均呈上升趋势,在(NH4)2SO4饱和度为21%即实验序号为第4点时,藻蓝蛋白纯度和得率分别达到和接近最大值,分别为0.519和3.47%,当(NH4)2SO4饱和度大于24%后纯度明显下降,得率逐步下降。因此,一步盐析时(NH4)2SO4的最佳饱和度为21%。
2.2 二步盐析单因素试验结果
在室温25 ℃条件下,依据1.3.3节步骤进行实验,精细追加(NH4)2SO4的饱和度至28.16%~51.28%共9个实验序号点,得到的藻蓝蛋白沉淀经溶解后测藻蓝蛋白纯度和得率。

图3 二步盐析((NNHH4)2SSOO4饱和度对藻蓝蛋白纯度和得率的影响Fig.3 Effect of different degrees of ammonium sulfate saturation on phycocyanin purity and yield in the second salting-out precipitation
图3 表明,当(NH4)2SO4饱和度为21%~29.8%时,沉淀中藻蓝蛋白的纯度和得率均呈上升趋势,在(NH4)2SO4饱和度为29.8%时,沉淀中藻蓝蛋白的纯度和得率分别达到和接近最大值,为1.969和2.95%。当(NH4)2SO4饱和度大于29.8%时纯度开始下降。因此,二步盐析可选取(NH4)2SO4饱和度为30%即实验序号为第3点时,即可得到最优提取纯化效果。
2.3 正交试验结果
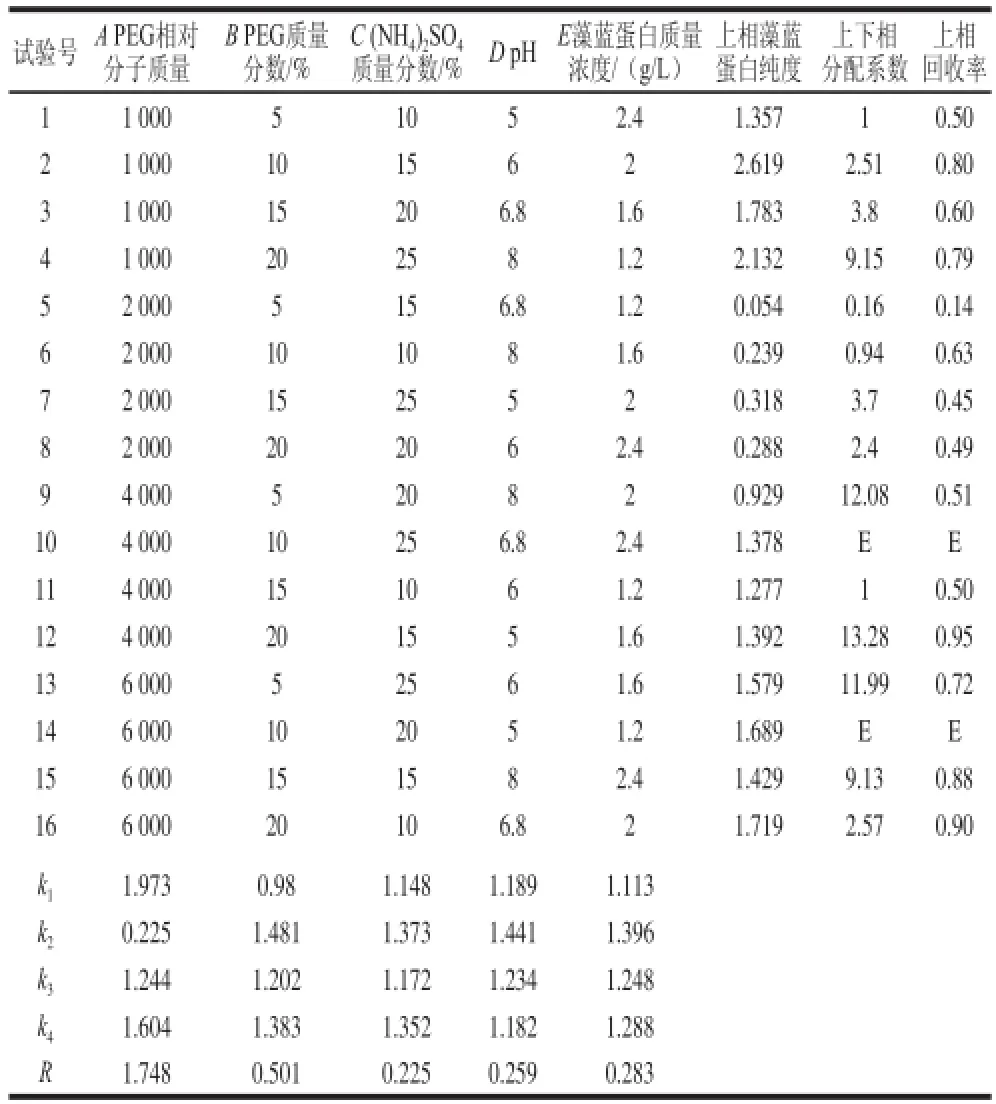
表2 PEC-(NH4)2SOSO4双水相正交试验结果Table2 Results of orthogonal array experiments of aqueous PEGG--((NNHH4)2SSOO4two-phase system
由表2可以看出,各因素对纯度的影响大小为PEG相对分子质量>PEG质量分数>藻蓝蛋白质量浓度>pH值>(NH4)2SO4质量分数。主要影响因素是PEG相对分子质量,其他4 个因素影响并不明显。PEG-(NH4)2SO4双水相最优萃取条件为PEG相对分子质量1 000、PEG质量分数10%、藻蓝蛋白质量浓度2 g/L、pH 6、(NH4)2SO4质量分数15%,上相中得到纯度为2.619的藻蓝蛋白液。另外发现当选用PEG 1 000-(NH4)2SO4构建双水相体系时,上相藻蓝蛋白的纯度基本上均有上升,分配系数较大,并且藻蓝蛋白的回收率较大,能起到较好的提取纯化藻蓝蛋白的作用。
2.4 PEG 1 000-(NH4)2SO4双水相萃取实验结果
由2.3节正交试验可知,构建PEG 1 000-(NH4)2SO4双水相体系对提取纯化藻蓝蛋白有很好的效果,为此进一步进行PEG 1 000-(NH4)2SO4单因素试验,了解PEG 1 000与(NH4)2SO4质量分数对纯化后藻蓝蛋白纯度的影响。
因此,选取新一批巢湖蓝藻藻泥,进行冻融破壁处理,按照一步盐析和两步盐析方法,得到纯度为2.653的藻蓝蛋白液。构建PEG 1 000-(NH4)2SO4双水相体系,选取(NH4)2SO4质量分数为20%不变,进行PEG 1 000质量分数变化对萃取藻蓝蛋白纯度的影响实验。结果表明,(NH4)2SO4质量分数20%、PEG 1 000质量分数10%时,一次双水相萃取后,藻蓝蛋白纯度达3.38,实验结果如图4所示。

图4 PEG 1 000质量分数变化对藻蓝蛋白纯度的影响Fig.4 Effect of different PEG 1 000 mass fractions on phycocyanin purity
另外,选定PEG 1 000质量分数为10%不变,进行(NH4)2SO4质量分数对萃取纯度的影响实验。结果表明,(NH4)2SO4质量分数25%、PEG 1 000质量分数10%时,一次双水相萃取后,藻蓝蛋白的纯度达3.45,实验结果如图5所示。
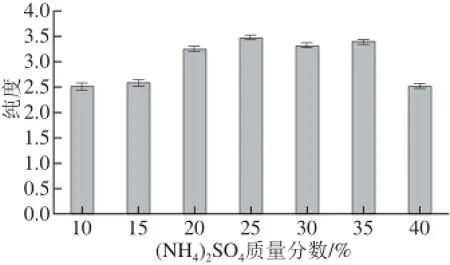
图5 ((NNHH4)2SSOO4质量分数变化对藻蓝蛋白纯度的影响Fig.5 Effect of different ammonium sulfate mass fractions on phycocyanin purity
3 结 论
在两步盐析过程中,运用0.618法选取实验点,得出了两步盐析过程中,最佳(NH4)2SO4饱和度分别为21%和30%。运用正交试验法,合理初选了PEG-(NH4)2SO4的双水相体系,该体系对提取纯化藻蓝蛋白有较大作用。得出结论为:藻蓝蛋白粗提液经最佳(NH4)2SO4饱和度条件下的两步盐析后纯度可达2.653。后构建PEG 1 000-(NH4)2SO4双水相体系,当(NH4)2SO4质量分数25%、PEG 1 000质量分数10%时,上相中藻蓝蛋白的纯度可达3.45。实验过程中发现了不同批次蓝藻藻泥,获取的藻蓝蛋白含量不同,相应的实验结果也有所差别,建立藻泥含固或量含藻蓝蛋白量与盐析及双水相参数关系就变得十分重要,并且双水相中上相的PEG去除或回收也是当前亟需解决的问题。在巢湖蓝藻水华现象日益加剧的情况下,蓝藻资源化应用研究,尤其是蓝藻中藻蓝蛋白高附加值资源化的研究紧迫并富有意义,它本身就符合循环经济的理念。在提取纯化工艺上,两步盐析联合双水相萃取能起到较好的效果,为后期实验的开展以及生产线的建设提供了参考。
[1] 刘建康, 高级水生生物学[M]. 北京: 科学出版社, 1999: 326-330.
[2] 孔繁翔, 宋立荣. 蓝藻水华形成过程及其环境特征研究[M]. 北京:科学出版社, 2011: 2-50.
[3] 韩士群, 严少华, 王震宇, 等. 太湖蓝藻无害化处理资源化利用[J].自然资源学报, 2009, 24(3): 431-437.
[4] ROMAY C, GONZALEZ R, LEDON N, et al. C-phycocyanin: a biliprotein with antioxidant, anti-inflammatory and neuroprotective effects[J]. Current Protein and Peptide Science, 2003, 4(3): 207-216.
[5] 王勇, 钱峰, 钱凯先. 藻蓝蛋白抗癌活性研究[J]. 浙江大学学报, 2001, 35(6): 672-675.
[6] 赵艳景, 汤云成. 条斑紫菜藻蓝蛋白的分离纯化及其抗衰老作用研究[J]. 食品科学, 2012, 33(17): 94-97.
[7] 汪兴平, 谢笔均, 潘思轶, 等. 葛仙米藻蓝蛋白抗氧化作用研究[J].食品科学, 2007, 28(12): 458-461.
[8] 杨立红, 王晓洁, 钟旭升, 等. 鱼腥藻藻蓝蛋白的抗氧化作用[J]. 食品科学, 2006, 27(12): 208-212.
[9] 李济平. 藻蓝蛋白对免疫系统的活性的研究[J]. 中国公共卫生, 2000, 16(7): 647-648.
[10] 吴萍. 藻胆蛋白与荧光免疫分析[J]. 生理科学进展, 2000, 31(1): 82-84.
[11] 范良民. 滇池蓝藻成分分析及利用途径探讨[J]. 云南环境科学, 1999, 18(2): 46-47.
[12] 胡一兵, 胡鸿钧, 李夜光, 等. 从一种富含藻胆蛋白的螺旋藻中大量提取和纯化藻蓝蛋白的研究[J]. 武汉植物学研究, 2002, 20(4): 299-302.
[13] 温少虹, 赵呈龙, 张莉萍. 紫球藻B-藻红蛋白的分离纯化[J]. 中国海洋药物, 2002, 82(3): 33-35.
[14] CAMREN S S, TERESA P N, ROXANA O R, et al. Extraction and purifieation of phycocyanin from Calothrix sp.[J]. Process Biochemistry, 2004, 39(12): 2047-2052.
[15] 刘杨, 王雪青, 庞广昌, 等. 钝顶螺旋藻藻蓝蛋白的富集分离及其稳定性研究[J]. 食品科学, 2008, 29(7): 39-42.
[16] 郭静, 王峰, 崔正刚, 等. 膨胀床-固定床层析偶联方式分离纯化藻蓝蛋白[J]. 食品科学, 2013, 34(10): 107-111. doi: 10.7506/spkx1002-6630-201310023.
[17] 吴蕾, 庞广昌, 陈庆森. 螺旋藻藻蓝蛋白的规模化提取和色谱纯化技术研究进展[J]. 食品科学, 2008, 29(4): 461-463.
[18] KALEDONA M, MAGDALENA T, ALEKSEY T, et al. Improved procedure for separation and purification of Arihronema africanum phycobili proteins[J]. Biotechnology Letters, 2007, 29(4): 647-651.
[19] JORGE B, MARCO R. Simplified two-stage method to B-phycoerythrin recovery from Porphyridium cruentumn[J]. Joumal of Chromatography B, 2006, 844(1): 39-44.
[20] 陈裕, 张发宇, 赵冰冰, 等. 冻融超声波联合破壁法提取巢湖蓝藻中藻蓝蛋白的研究[J]. 低碳世界, 2015, 6(9): 17-18.
[21] 姜彬, 冯志彪, 陈一. PEG/盐双水相体系萃取小麦酯酶的研究[J]. 食品工业科技, 2008, 29(9): 200-202.
[22] 岳岑, 冯维希, 黄文, 等. 双水相萃取法提取条斑紫菜R-藻红蛋白工艺[J]. 食品科学, 2011, 32(16): 41-44.
[23] HERRERA A, BOUSSΙBA S, NAPOLENONE V, et al. Recovery of phycocyanin from the cyanobacterium Spirulina maxima[J]. Journal of Applied Phycology, 1989, 1(1): 325-331.
[24] SONΙ B, KALAVADΙA B, TRΙVEDΙ U, et al. Extraction, purification and characterization of phycocyanin form Oscillatoria quadripunctulata: isolate form the rocky shores of Bet-Dwarka, Gujarat, Ιndia[J]. Process Biochemistry, 2006, 41(9): 2017-2023.
[25] 丙潇潇. 藻胆蛋白的双水相绿色提取技术研究[D]. 哈尔滨: 哈尔滨工业大学, 2009.
[26] 韩士群, 李辉东, 严少华, 等. 太湖蓝藻藻蓝蛋白的提取及纯化[J].江苏农业学报, 2012, 28(4): 777-782.
Extraction and Purifi cation of Phycocyanin by the Combined Use of Two-Step Salt Precipitation and Aqueous Two-Phase Extraction from Blue Algae
ZHANG Fayu, ZHAO Bingbing, CHEN Yu, YUAN Mengyuan, WANG Jiaquan*
(School of Resources and Environmental Engineering, Hefei University of Technology, Hefei 230009, China)
The crude extracts of phycocyanin from fres h blue algal were obtained by freeze-thaw method. The purifi cation of phycocyanin was performed by the combined use of two-step salting-out precipitation and aqueous two-phase extraction. The effect of different saturation degrees of (NH4)2SO4in two-step salt precipitation on purifi cation effi ciency was investigated using the 0.618 method, and the aqueous two-phase system of polyethylene glycol (PEG)-(NH4)2SO4was established after comprehensively considering the effect of PEG molecular weight, PEG mass fraction, (NH4)2SO4mass fraction, pH and phycocyanin mass concentration on purifi cation effi ciency. The results showed that the optimum (NH4)2SO4saturation was 21% in the fi rst step and 30% in the second step salt precipitation at 25 ℃. Using the aqueous two-phase system containing 10% PEG 1 000 and 25% (NH4)2SO4, the purity of purifi ed phycocyanin was 3.45.
two-step salting-out precipitation; aqueous two-phase extraction; extraction and purifi cation; phycocyanin
TQ464.7
A
1002-6630(2015)22-0006-05
10.7506/spkx1002-6630-201522002
2015-03-15
“十二五”国家科技重大专项(2012ZX07103-004)
张发宇(1983—),男,讲师,博士研究生,研究方向为水处理技术。E-mail:13655551436@139.com
*通信作者:汪家权(1957—),男,教授,博士,研究方向为水处理技术。E-mail:jiaquan.wang@163.com

