紫贻贝蛋白酶解过程中呈味物质释放规律和呈味肽结构
赵 阳 陈海华 王雨生,2 刘朝龙 赵春霞
(1.青岛农业大学食品科学与工程学院,山东 青岛 266109;2.青岛农业大学学报编辑部,山东 青岛 266109)
风味是影响食品品质的重要指标之一,酶解动物蛋白因具有自然、醇厚、浓郁的特征风味,已经逐步代替化学调味料,成为制备高档复合调味品的重要基料[1]。紫贻贝又称海红,在中国资源丰富,年产量达50万t[2]。紫贻贝的蛋白酶解液含有丰富的呈味氨基酸、呈味肽、有机酸等呈味物质,营养丰富、海鲜风味纯正自然。本课题组[2]在前期研究中,已通过响应面优化了酶解紫贻贝最佳工艺条件,制得呈味物质含量较高、整体风味良好的紫贻贝酶解液,并对其中呈味物质进行了成分分析。结果发现,酶解液中呈味物质的含量随酶解条件的改变表现出规律变化,且酶解液的风味特征与呈味肽的结构之间存在一定联系。
关于水产蛋白,尤其是贝类蛋白酶解过程中呈味物质释放规律的研究较少。肖如武等[3]研究表明,马氏珍珠贝肉蛋白的酶解过程中,酶解液中游离氮基酸和可溶性氮含量增加,肽分子量降低,鲜味增强、苦味先增强后减弱。崔春[4]研究表明,海鱼蛋白酶解过程中,酶解液中游离氨基酸含量持续增加,多肽、总酸、总糖含量先增加后降低。赵珊珊等[5]研究表明,不同酶解工艺条件下,游离氨基酸、呈味肽的释放量和释放速率不同。呈味肽结构的研究,主要集中于肉味肽的分子量分布和氨基酸测序。研究呈味肽的结构,须对其进行分离纯化,其方法主要有硫酸铵盐析、超滤法、阴离子交换树脂分离、凝胶柱层析、高效液相质谱法等,氨基酸测序方法以基质辅助激光解析—三级四级杆/飞行时间质谱法为主。目前国内外大多研究中所采用的多肽分离纯化方法较为单一,借助多种方法对多肽进行逐级分离纯化的研究较少。伍彬[6]采用超滤法、大孔吸附树脂和高效凝胶过滤色谱分离纯化并鉴定了虾头自溶产物中的低分子量肽,结果表明鲜味肽和甜味肽分子量主要集中在1~3kDa。肖如武[1]采用超滤技术、大孔吸附树脂、凝胶柱层析分离纯化了蓝蛤肉酶解产物肽,最终得到纯度较高的鲜味肽,其鲜味强度为谷氨酸钠的3倍。张艳萍等[7]对紫贻贝酶解物中的降血压肽结构进行测定,结果表明,相对分子质量<1kDa肽占降血压肽总量的90.42%。以上研究,均未对呈味肽的释放规律和结构之间的内在联系作出深入探讨。
本试验拟研究紫贻贝酶解液中呈味物质的释放规律,测定呈味肽结构,以探讨其构效关系。以不同条件下制备的紫贻贝酶解液为研究对象,测定其总酸、总糖、三甲胺等呈味物质含量,以及肽分子量分布、氨基酸组成,结合酶解液的感官评分,研究各种呈味物质的释放规律,并以酶解液各级纯化产物的鲜味评分作为指标,借助多级超滤、凝胶柱层析和反相高效液相色谱法对海鲜风味肽进行逐步分离纯化,采用超高分辨四极杆—飞行时间质谱确定海鲜风味肽的氨基酸序列,以期为紫贻贝蛋白呈味肽的制备、分离纯化、结构研究及其在调味品中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
紫贻贝:青岛城阳水产批发市场购买;
中性蛋白酶:5×104U/g,石家庄市兴达酶制剂有限公司;
木瓜蛋白酶:8×105U/g,郑州坤利食品添加剂有限公司;
葡聚糖凝胶 G-25(Sephadex G-25):瑞典 Pharmacia公司;
乙腈:色谱纯,天津恒兴化学试剂;
三氟乙酸(TFA):色谱纯,天津光复精细化工研究所;
肽分子量标准品:谷胱甘肽(分子量0.31kDa),血管紧张素(分子量1.30kDa),胰岛素(分子量 5.81kD),溶菌酶(分子量14.00kDa),美国Sigma公司。
其它试剂:均为分析纯。
1.2 试验仪器与设备
超高分辨四极杆—飞行时间质谱仪:UHR-Q-TOF型,德国Bruker公司;
高效液相色谱:LC-20A型,日本岛津公司;
全自动氨基酸分析仪:L-8900型,日立高新技术公司;
酸度计:DELTA320型,瑞士Mettler-Toledo集团;
超滤装置:EZ-FitTM型,美国 Millipore公司;
电脑紫外检测器:HD-5型,上海青浦沪西仪器厂;
自动部分收集器:BSC-100型,上海青浦沪西仪器厂;
低速离心机:LXJ-IIB型,上海安亭科学仪器厂。
1.3 方法
1.3.1 紫贻贝酶解液的制备 根据文献[2]制备紫贻贝酶解液(mussel protein hydrolyses,MPHs)。取冷冻紫贻贝肉于磷酸缓冲液(pH 5.5,6.0,6.5,7.0,7.5;0.2mol/L)中,按固液比1∶3(m∶V)进行匀浆,按酶活1∶1的比例加入一定量中性蛋白酶和木瓜蛋白酶,适宜温度酶解一定时间后,沸水浴灭酶20min,冷却,4 000r/min离心20min,取上清液定容至500mL,即得MPHs。其中:分别在酶解时间2h、酶解温度50℃、酶解pH 6.5的条件下,固定其中的2个因素,在酶解时间1~3h、酶解温度40~60℃、酶解pH 5.5~7.5的范围内,改变另外1个因素进行试验。
1.3.2 紫贻贝酶解液中呈味物质的测定
(1)总酸的测定:根据ASTM D2942-02(2013)Standard Test Method for Total Acid Acceptance of Halogenated Organic Solvents(Nonreflux Methods)及 GB/T 12456—2008《食品中总酸的测定》规定的方法测定酶解液中总酸含量。
(2)总糖的测定:根据文献[8]及 GB/T 9695.31—2008《肉制品 总糖含量测定》,采用苯酚—硫酸法测定酶解液中总糖含量。
(3)三甲胺(trimethylamine,TMA)的测定:采用比色法[9]。
1.3.3 紫贻贝酶解液中的肽分子量分布和氨基酸分析
(1)肽分子量分布:根据文献[10],采用HPLC法测定紫贻贝酶解液中呈味物质的相对分子质量。色谱条件:Shodex KW-802.5(7.8mm×300mm)色谱柱;流动相:乙腈—水—三氟乙酸,三者体积比 45∶55∶0.1;流速:0.5 mL/min;检测波长:220nm;柱温:30℃。相对分子质量校正曲线所用标准品:谷胱甘肽(分子量0.31kDa),血管紧张素(分子量1.30kDa),胰岛素(分子量5.81kD),溶菌酶(分子量14.00kDa)。根据混合标准样的洗脱时间得到标准曲线方程:

式中:
Mw——相对分子质量,Da;
t——出峰时间,min。
取适量酶解物,溶解后经0.45m微孔滤膜过滤,进样分析。根据肽标准曲线测定紫贻贝酶解液中肽的分子量。
(2)氨基酸分析:总氨基酸组成、游离氨基酸组成:分别按照GB/T 5009.124—2003《食品中氨基酸的测定》、文献[11],采用全自动氨基酸分析仪测定。肽基氨基酸含量按式(2)计算:

式中:
X——肽基氨基酸含量,mg/mL;
X1——总氨基酸含量,mg/mL;
X2——游离氨基酸含量,mg/mL。
1.3.4 紫贻贝海鲜风味肽的分离纯化
(1)紫贻贝海鲜风味肽的超滤分离:取适量在50℃、pH 6.5条件下酶解2h后的紫贻贝酶解液,采用截留分子量为10kDa的超滤膜在0.4MPa、(4±0.5)℃条件下进行分离,当截留液体积减少到原样品液体积的10%时停止,取透过液进行下一级超滤处理,利用截留分子质量分别为5,3,1kDa的超滤膜依次进行上述操作,收集各级超滤组分,冷冻干燥后进行鲜味分析。
(2)凝胶柱层析法分离纯化紫贻贝海鲜风味肽:将超滤分离所得的鲜味最高的组分配成质量浓度为40mg/mL的溶液,用Sephadex G-25凝胶柱层析(26mm×400mm)进行分离。进样量为1.0mL,洗脱液为去离子水,流速为2.0mL/min,检测220nm处的吸光值。对各分离组分峰进行收集,冷冻干燥后,进行风味分析,收集海鲜风味最佳的峰冻干后备用。
(3)反相高效液相色谱法分离纯化紫贻贝海鲜风味肽:将凝胶层析分离得到的呈味组分溶解于90%的乙腈中,0.22μm滤膜过滤后,参照文献[12],采用岛津 LC-20A高效液相色谱,Zorbax SB-C18(5μm,4.6mm×250mm)反相色谱柱验证纯度。
分离条件:进样量10μL,流速0.5mL/min,A流动相,含0.1%三氟乙酸的超纯水;B流动相,含0.1%三氟乙酸的乙腈;以10%B流动相等度洗脱;检测波长220,280nm。
1.3.5 超高分辨四极杆—飞行时间质谱仪测定海鲜风味肽氨基酸序列 将反相高效液相色谱分离得到的海鲜风味肽溶解于50%乙腈溶液中(含有1‰甲酸),采用超高分辨四极杆—飞行时间质谱仪测定氨基酸序列。
操作条件:离子源:ESI;扫描模式:正离子,全扫描;扫描范围(m/z)103~1 000;碎裂电压:100V;毛细管电压:4.5kV;干燥气温度:350℃;干燥气流速:11L/min;雾化气:2.90×105Pa。

图1 酶解条件对紫贻贝酶解液中总酸和总糖的影响Figure 1 Effect of enzymatic conditions on the total acid and total saccharides of Mytilus edulis enzymolysate
1.3.6 感官评定 由8位经过适当培训的感官评价员组成品尝小组,根据文献[13]、[14]的方法进行感官评定。对紫贻贝酶解液的各级超滤液鲜味、苦味进行评分,采用5分制,0~5分由低到高,分别代表风味程度“很弱、较弱、一般、较强、很强”。采用TDA(taste dilution analysis)法对海鲜风味肽进行评定,其中不少于6名感官评定员能够准确评价的最高样品浓度,即为样品在水中的呈味阈值。
2 结果与分析
2.1 呈味物质的释放规律
2.1.1 酶解条件对酶解液中总酸和总糖含量的影响 贝类中的酸主要包括乳酸、丙酸、琥珀酸等有机酸,具有提高酶解液缓冲能力、增强呈味特性的作用[5]。酶解液中的总糖包括以游离形式存在的葡萄糖、半乳糖、果糖等,各种糖的含量均远低于其呈味阈值,故其对酶解液甜味的影响不大[5]。但糖与其他物质之间的相互作用可能影响酶解液的整体风味[13]。由图1可知,随着酶解时间的延长、酶解温度的升高,紫贻贝酶解液的总酸含量均呈先升高后降低的趋势,分别在酶解时间1h、酶解温度50℃时达到最大值。随着酶解时间的延长、酶解温度的升高,总糖含量基本不变。随着酶解pH的升高,总酸及总糖含量均呈降低的趋势,当pH为5.5时,总酸、总糖含量最高,这说明较低酶解pH更利于紫贻贝肉中各种酸和糖的释放。
2.1.2 酶解条件对酶解液中三甲胺含量的影响 三甲胺可与组织中的脂肪共同作用产生腥味,且呈味阈值较低,从而对酶解液的风味产生一定的影响[14]。由图2可知,随酶解时间的延长,紫贻贝酶解液中三甲胺含量呈逐渐上升的趋势,酶解时间超过1h后,三甲胺含量的增加趋缓。随着酶解温度、酶解pH的升高,酶解液中三甲胺含量均呈先升高后降低的趋势,在酶解温度为50℃、pH为6.0时,三甲胺含量达到最大值。同时由图2可知,紫贻贝酶解液中三甲胺含量低于1.2mg/100g。而在新鲜鱼中,三甲胺可接受的最大量为10~15mg/100g[9]。因此紫贻贝酶解液中三甲胺含量在可接受范围之内,其腥味不影响酶解液的整体风味。

图2 酶解条件对紫贻贝酶解液中三甲胺含量的影响Figure 2 Effect of enzymatic conditions on TMA content of Mytilus edulis enzymolysate
2.1.3 酶解条件对酶解液肽分子量分布的影响 由图3可知,随着酶解时间的延长,分子量≥10kDa的肽比例降低,分子量5~10kDa的肽比例无明显变化,分子量1~5kDa的肽比例先升高后趋缓,分子量<1kDa的肽比例不断升高。这说明酶解过程中,肽逐渐分子量逐渐降低。随着酶解温度的升高,分子量<1kDa的肽比例呈先上升后下降的趋势,而1~5kDa、分子量≥10kDa的肽比例均呈先下降后上升的趋势,5~10kDa的肽比例无明显变化。随着酶解pH的升高,分子量<1kDa的肽比例降低,分子量1~10kDa的肽比例先升高后降低,分子量≥10kDa的肽比例升高。这说明pH较低时,有利于低分子量肽的生成。酶解过程中产生的肽类物质对酶解液风味的影响,主要是部分寡肽与其他呈味物质发生相乘作用,使酶解液风味饱满、口感协调[15]。紫贻贝酶解液中的呈味肽,很可能是分子量较低的肽。

图3 不同酶解条件下紫贻贝酶解液中肽分子量的分布Figure 3 Effect of enzymatic conditions on molecular weight distribution of peptide in Mytilus edulis enzymolysate
2.1.4 酶解过程中氨基酸的释放 酶解过程中,紫贻贝蛋白逐渐被水解成小分子肽和游离氨基酸。酶解液中的肽类具有复杂的呈味功能,其中鲜味肽、苦味肽、甜味肽能够赋予酶解液协调、细腻、醇厚浓郁的整体味感;游离氨基酸主要包括鲜味氨基酸(谷氨酸、天门冬氨酸)、甜味氨基酸(苏氨酸、丙氨酸、甘氨酸等)、苦味氨基酸(缬氨酸、亮氨酸、苯丙氨酸、精氨酸等),呈味氨基酸的含量和比例也是影响酶解液风味的重要因素之一。
紫贻贝酶解液中,氨基酸主要有两种类型:① 游离氨基酸;② 仍存在于未被水解的肽中。由图4可知,随酶解时间的延长,样品中氨基酸种类不发生变化,但释放的总氨基酸、游离氨基酸、肽含量变化明显。与未经酶解的样品相比,酶解后的样品中总氨基酸、游离氨基酸、肽基氨基酸含量明显升高,且所有氨基酸的含量均迅速增加。酶解1h样品的总氨基酸、游离氨基酸、肽基氨基酸含量分别为是11.190,4.798,6.389mg/mL,比酶解前氨基酸总量分别增加了276.8%,229.5%,321.9%。随着酶解时间的延长,氨基酸总量增加速度减缓,酶解2h后,总氨基酸、游离氨基酸总量增加缓慢,肽基氨基酸含量开始降低。
随着酶解时间的延长,鲜味氨基酸、甜味氨基酸及苦味氨基酸含量均明显提高。其中,大部分苦味氨基酸及甜味氨基酸的含量低于其呈味阈值,因此其含量的增加基本不影响酶解液的苦味和甜味;鲜味氨基酸含量与其呈味阈值接近,并能与盐、有机酸发生相乘作用而明显增加酶解液的鲜味[15]。鲜味肽、甜味肽、苦味肽含量呈先上升后下降的趋势。
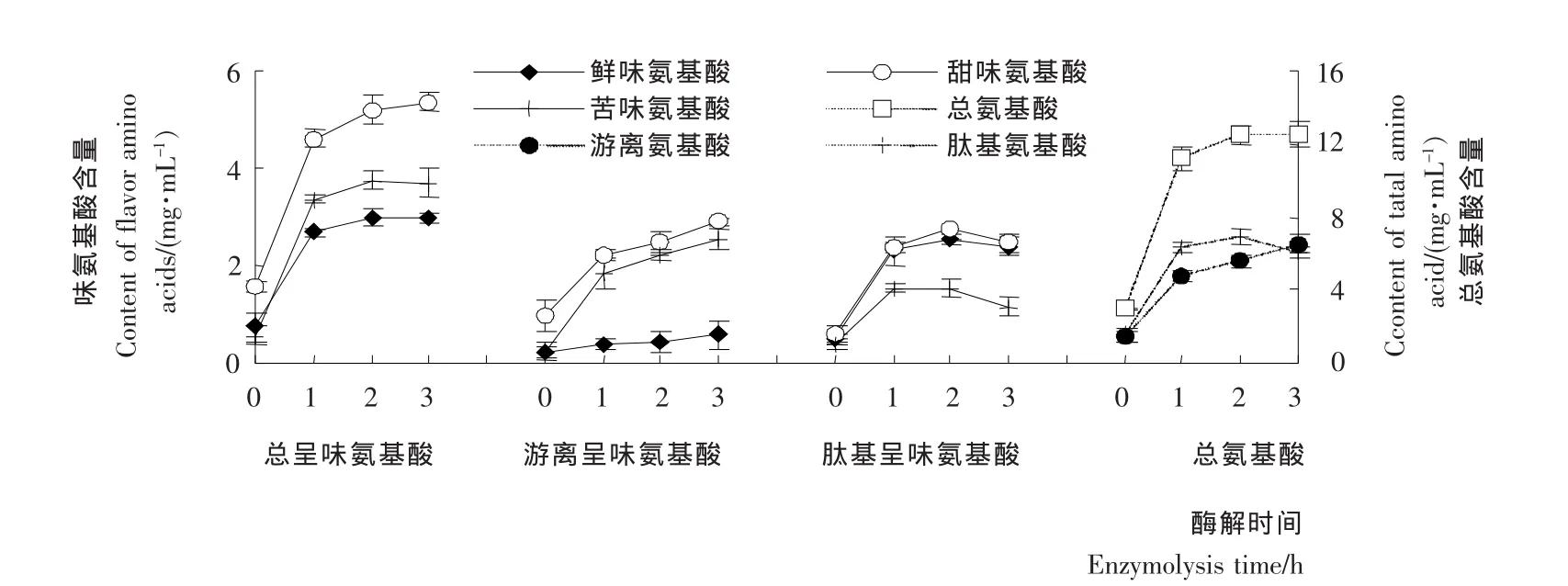
图4 不同酶解时间后紫贻贝酶解液的氨基酸组成和含量Figure 4 Effect of enzymatic time on the composition and content of amino acids in Mytilus edulis enzymolysate
综合比较紫贻贝酶解液的肽得率、肽分子量分布、氨基酸分析结果可知,不同酶解条件下制备的酶解液中,分子量<1kDa的肽均占较大比例,且随着酶解条件的变化,肽得率、肽基呈味氨基酸含量变化趋势大致相同。赵谋明等[4]指出,分子量<1kDa的肽具有特殊的呈味特性。由此推测,紫贻贝酶解液中具有海鲜特征风味的呈味肽,大部分是分子量<1kDa的肽。酶解条件为2.0h、50℃、pH 6.5时,紫贻贝酶解液的肽得率、水解度和低分子量肽的比例较高,呈味物质和氨基酸的释放较充分。在此条件下大量制备紫贻贝酶解液,进行风味肽的分离纯化。
2.2 紫贻贝酶解液中海鲜风味肽的分离纯化
2.2.1 紫贻贝海鲜风味肽的超滤分离 超滤膜可将紫贻贝酶解液中的肽与蛋白质等其他物质进行分离,同时将海鲜风味肽与其他分子量的肽进行分离[1]。由图5可知,与其他分子量肽段相比,酶解原液的鲜味最低、苦味最高。超滤可明显提升酶解液的风味,使鲜味评分升高,苦味评分降低。鲜味值随着截留分子量的减少而呈逐渐增大的趋势,其中1 kDa滤膜透过液的鲜味值最高,且相对原酶解液有显著提高。苦味值随截留分子量的减少而呈逐渐减小的趋势,其中,10kDa超滤膜对于酶解液超滤祛苦的效果最明显,而1kDa滤膜透过液的苦味值最低,且明显低于原酶解液。这可能是由于酶解液中引起苦味的疏水性短肽分子量较大,截留分子量逐级减小的超滤膜可以将它们有效去除。与此同时,逐级超滤对鲜味物质起到了一定的浓缩作用,使得超滤液的鲜味值逐渐升高[14]。

图5 各级滤膜透过液的风味分析Figure 5 Flavor analysis of Mytilus edulis enzymolysate under various ultrafiltration conditions
超滤液的风味分析结果表明,鲜味肽大量存在于1kDa滤膜透过液中,这证实了海鲜风味肽是分子量<1kDa的肽这一推测。这与伍彬等[6]的研究结果一致。由于1kDa滤膜透过液与3kDa滤膜透过液的风味相差较小,综合鲜味和苦味的评分,大量制备3kDa滤膜透过液用作下一步分离纯化。
2.2.2 紫贻贝海鲜风味肽的凝胶柱层析分离 由图6可知,3kDa滤膜透过液在洗脱时得到4个峰Ⅰ、Ⅱ、Ⅲ、Ⅳ,其中峰-Ⅱ的风味最佳,鲜味浓郁、苦味极低;而峰-Ⅰ、峰-Ⅲ和峰-Ⅳ的鲜味不明显,且苦味较高。故对峰-Ⅱ进行大量收集,用于反相高效液相色谱分析。
2.2.3 紫贻贝海鲜风味肽的反相高效液相色谱分析 由图7可知,经反相高效液相色谱分析后,峰-Ⅱ组分仍然包括3个样品峰-V、峰-VI、峰-VII,峰-VI和峰-VII在220nm和280 nm处的强度均明显低于峰-V。经风味分析可知,峰-V的鲜味值为4.8,明显高于峰-VI和峰-VII(2.0和1.5),故选取峰-V进行收集,用于紫贻贝海鲜风味肽的结构鉴定及构效分析。
2.2.4 UHR—Q—TOF质谱分析紫贻贝海鲜风味肽峰-V的氨基酸序列 图8是紫贻贝风味肽峰-V的一级质谱图,其中主要包含质荷比分别为340.760 5,679.510 3,701.492 4的3种组分。3种组分为同一种物质的3种不同表现形式,其中340.760 5是带2个电荷的,679.510 3是单电荷形式的,701.492 4 是 [M+Na]峰,因 此,只 需 对 质 荷 比为679.510 3的这个肽链进行二级质谱分析。根据氨基酸平均分子量128可推断,峰-V的组分是由5至6个氨基酸组成的寡肽。伍彬[6]、王娟[16]的研究也表明,凡纳滨对虾虾头自溶产物、金华火腿中的鲜味肽均为寡肽。

图6 3kDa滤膜透过液的Sephadex G-25凝胶柱层析和风味分析图Figure 6 Sephadex G-25gel chromatograms and flavor analysis of Mytilus edulis enzymolysate under 3kDa ultrafiltration conditions

图7 紫贻贝风味肽组分峰-Ⅱ和溶剂峰的反相高效液相色谱图Figure 7 Reversed phase high performance liquid chromatography of peak-Ⅱand solvent blank from Mytilus edulis seafood flavor peptides

图8 紫贻贝风味肽组分峰-V的一级质谱图Figure 8 Mass spectrum of peak V from Mytilus edulis seafood flavor peptides
图9为母离子m/z=679.510 3的二级质谱图。母离子m/z=679.510 3经碰撞诱导解离(CID)后,可能产生3种类型的碎片离子,包括序列离子、中间碎片离子和卫星离子。但是在CID的裂解能量不高时,肽链中的肽键(酰胺键)更易发生断裂,从而更易产生b型离子和y型离子。结合紫贻贝海鲜风味肽的氨基酸分析结果,采用从头测序(de novo)的方法对未知肽段进行氨基酸序列分析可知,其氨基酸序列为CSVQDQ 或 QAVNFT,即Cys-Ser-Val-Gln-Asp-Gln或 Gln-Ala-Val-Asn-Phe-Thr。经计算其相对分子质量理论值分别为121+105+117+146+133+146-18×5=679-1和146+89+117+132+165+119-18×5=679-1,与质谱测定结果一致。
Glu、Gln、Asp、Asn之间相互结合形成的短肽或它们与Gly、Ala、Met、Thr、Ser、Cys相互结合形成的多元酸钠盐可以呈现较为明显的鲜味特征[17]。Cerny等[18]发现含有Glu或Asp的肽与一定浓度的盐或味精等呈味成分有较强的协同增鲜功能。研究发现,部分游离氨基酸具有一定的鲜味特征,但其呈鲜味的特性远低于鲜味肽,这是由于氨基酸通过肽键的连接后,相互作用明显增强,从而使鲜味特性显著提高[1,2,17]。本研 究 分 离 纯 化 出 的 六 肽 Cys-Ser-Val-Gln-Asp-Gln或 Gln-Ala-Val-Asn-Phe-Thr含有以上特征氨基酸,但氨基酸序列独特,不同于任何目前已知序列的呈味肽。

图9 紫贻贝风味肽组分峰-V一级质谱中核质比为的679.510 3母离子二级质谱图Figure 9 MS/MS spectrum of the precursor ion with m/zof 679.510 3from MS of peak V from Mytilus edulis seafood flavor peptides
根据TDA法分析得到紫贻贝海鲜风味肽峰-V的呈味阈值为0.1mg/mL,明显低于谷氨酸一钠(味精,MSG)的呈味阈值(0.3mg/mL)[19]。
3 结论
紫贻贝酶解过程中,总酸、总糖、三甲胺、多肽、氨基酸等含量的变化均遵循一定规律,其共同作用决定了酶解液的风味特征。海鲜风味肽为低分子量肽,pH较低的条件利于其生成。这为水产蛋白,尤其是贝类蛋白酶解过程中呈味物质释放规律的研究提供了理论参考。经超滤、凝胶层析和反相高效液相色谱分离纯化得到的呈味肽纯度较高,此方法适用于海鲜风味肽的分离纯化。海鲜风味肽的结构为Cys-Ser-Val-Gln-Asp-Gln或 Gln-Ala-Val-Asn-Phe-Thr,不同于任何目前已知序列的呈味肽。其呈味阈值明显低于MSG,作为鲜味剂,具有潜在的应用价值。
1 肖如武.蓝蛤蛋白源鲜味肽的制备及分离研究[D].广州:华南理工大学,2010.
2 吕振磊,刘朝龙,王雨生,等.响应面法优化紫贻贝蛋白酶解工艺条件[J].食品科学,2012,33(10):61~66.
3 肖如武,崔春,陈文芬,等.Pancreatin酶解马氏珍珠贝肉蛋白过程中产物性质研究[J].食品与发酵工业,2008,34(7):41~46.
4 崔春.海产低值鱼深度酶解工艺与机理研究[D].广州:华南理工大学,2005.
5 赵珊珊,朱志伟,曾庆孝,等.不同蛋白酶酶解罗非鱼肉制备蛋白水解液的过程变化规律研究[J].现代食品科技,2008,24(2):115~119.
6 伍彬.凡纳滨对虾虾头自溶产物风味成分研究[D].广东:广东海洋大学,2010.
7 张艳萍,戴志远,张虹.贻贝中ACE抑制活性肽的酶解制备及表征[J].中国食品学报,2011,11(1):51~59.
8 Kupina S,Roman M.Determination of total carbohydrates in wine and wine-like beverages by hplc with a refractive index detector:First action 2013.12[J].Journal of AOAC International,2014,97(1):498~505.
9 Heising J K,van Boekel M A J S,Dekker M.Mathematical models for the trimethylamine(TMA)formation on packed cod fish fillets at different temperatures[J].Food Research International,2014,56(2):272~278.
10 Su Guo-wan,Cui Chun,Zheng Lin,et al.Isolation and identification of two novel umami and umami-enhancing peptides from peanut hydrolysate by consecutive chromatography and MALDITOF/TOF MS[J].Food Chemistry,2012,135(2):479~485.
11 张恒.鸡骨酶解过程中的呈味特性及氨基酸释放规律研究[D].四川:四川农业大学,2010.
12 Parente E,Patel H,Caldeo V,et al.RP—HPLC peptide profiling of cheese extracts:A study of sources of variation,repeatability and reproducibility[J].Food Chemistry,2012,131(4):1 552~1 560.
13 赵阳,陈海华,刘朝龙,等.双酶同步酶解工艺和自溶工艺制备紫贻贝海鲜风味肽的研究[J].中国食品学报,2014,14(9):56~62.
14 Frank O,Ottinger H.Characterization of an intense bitter-tasting 1H,4H-quinolizinium-7-olate by application of the taste dilution analysis,a novel bioassay for the screening and identification of taste-active compounds in foods[J].Agricultural and Food Chemistry,2001,49(1):231~238.
15 Su Guo-wan,Zheng Lin,Cui Chun,et al.Characterization of antioxidant activity and volatile compounds of Maillard reaction products derived from different peptide fractions of peanut hydrolysate[J].Food Research International,2011,44(10):3 250~3 258.
16 王娟.金华火腿中小肽的分离纯化及表征[D].河南:河南农业大学,2012.
17 秦乾安,欧远,周小敏,等.鳀鱼酶解过程中呈味物质变化趋势的研究[J].食品工业科技,2010,31(4):169~175.
18 Cerny H,Amado R.Analysis of taste-active compounds in an enzymatic hydrolysate of deamidated wheat gluten[J].Agricultural and Food Chemistry,2002,50(6):1 515~1 522.
19 Shi Zu-min,Yuan Bao-jun,Taylor A W,et al.Monosodium glutamate intake increases hemoglobin level over 5years among Chinese adults[J].Amino Acids,2012,43(3):1 389~1 397.

