齐口裂腹鱼肌肉品质及其PPARγ、PGC-1α相对表达量分析
冯 姣,邬应龙,夏晓杰,曾丽萍
(四川农业大学食品学院,四川雅安625014)
FENG Jiao,WU Ying-long*,XIA Xiao-jie,ZENG Li-ping
(College of Food Science,Sichuan Agricultural University,Ya’an 625014,China)
齐口裂腹鱼肌肉品质及其PPARγ、PGC-1α相对表达量分析
冯姣,邬应龙*,夏晓杰,曾丽萍
(四川农业大学食品学院,四川雅安625014)
通过对不同质量的齐口裂腹鱼肌肉品质的相关指标进行分析,并采用实时荧光定量PCR技术对其组织中过氧化物酶体增殖物激活受体辅激活子1α(PGC-1α)及过氧化物酶体增殖物激活受体γ(PPARγ)的相对表达量开展研究。结果表明:不同质量的齐口裂腹鱼肌肉中蛋白质、粗脂肪含量存在显著性差异(p<0.05),其水分、灰分含量差异不显著(p>0.05);肌肉的pH没有差异,大鱼的失水率高于中鱼与小鱼,小鱼与中鱼肌肉中氨基酸总量、必需氨基酸和鲜味氨基酸的含量均高于大鱼;中、小鱼的肌肉品质高于大鱼。在不同质量齐口裂腹鱼的头肾、肝脏、肌肉中,PPARγ的相对表达量均存在显著性差异(p<0.05);PGC-1α在头肾中相对表达量存在显著性差异(p<0.05),在肝脏、肌肉中差异不显著(p>0.05);PPARγ、PGC-1α在组织中的相对表达量与肌肉中粗脂肪含量有一定关联。
齐口裂腹鱼,肌肉品质,PPARγ,PGC-1α,相对表达量
FENG Jiao,WU Ying-long*,XIA Xiao-jie,ZENG Li-ping
(College of Food Science,Sichuan Agricultural University,Ya’an 625014,China)
齐口裂腹鱼(Schizothorax prenanti Tchang)属于鲤科裂腹鱼属动物,又名“雅鱼”,广泛分布于长江上游、金沙江、青衣江、乌江下游等水域,鱼肉色雪白、肉质细嫩、肉味鲜美,是全国名菜砂锅鱼头的首选鱼头,属于名贵的经济鱼类。由于齐口裂腹鱼的稀有及其肉味鲜美,现已引起许多学者的研究兴趣。温安祥等[1]对天然齐口裂腹鱼鱼种、成鱼及人工养殖的齐口裂腹鱼的肌肉成分进行了分析研究;向枭等[2]研究了饲料中五种不同来源的脂肪对齐口裂腹鱼的生长性能和血清中甘油三酯、总胆固醇含量、谷丙转氨酶、谷草转氨酶等生化指标的影响。
过氧化物酶体增殖物激活受体(Peroxisome proliferator-activated receptor,PPARs),在脂代谢过程中起着重要作用。PPARγ(Peroxisome proliferator-activated receptorγ)属PPARs的异构体,调节包括脂质和葡萄糖稳态在内的代谢过程[3]。过氧化物酶体增殖物激活受体辅激活子1α(peroxisome proliferatoractivated receptor-coactivator1α,PGC-1α)是PPARγ转录辅助激活因子,通过调控PPARγ介导的下游靶基因的转录等环节,参与调节多种脂质代谢通路[4]。具有调节适应性产热[5-6],促进线粒体的合成[7],调控骨骼肌的纤维类型转化及葡萄糖代谢过程[8-9],调节心肌能量代谢[10-11]等作用。林亚秋等[12]克隆了齐口裂腹鱼过氧化物酶体增殖激活受体γ(PPARγ)辅助活化因子1α(PGC-1α),并探讨了该基因在肌肉组织中的表达量。目前有关不同质量齐口裂腹鱼肌肉的品质及不同组织中PGC-1α、PPARγ相对表达量的研究较少。由于齐口裂腹鱼生长缓慢,市场销售的齐口裂腹鱼普遍为500g左右,本研究选取的质量等级分别为150、300、500g,代表着稚鱼、亚成鱼、成鱼三个不同生长阶段的鱼体,通过本研究探明不同质量齐口裂腹鱼肌肉品质差异和PGC-1α、PPARγ在不同组织中相对表达量的差异,为该鱼不同生长阶段的肌肉品质及PGC-1α、PPARγ的研究提供参考资料。
1 材料与方法
1.1材料与仪器
实验用鱼购自四川省雅安市天全县雅鱼场,按照三个重量级别,简称为大、中、小鱼,每个重量级别随机捞取20尾,经测量得齐口裂腹鱼形体指数如表1所示;RNAiso Plus、RNA反转录试剂盒、荧光定量试剂盒TaKaRa公司;琼脂糖北京方宝生物科技有限公司;不同规格的枪头、0.2μL PCR管GCS公司;荧光定量八联板美国Bio-Rad公司。
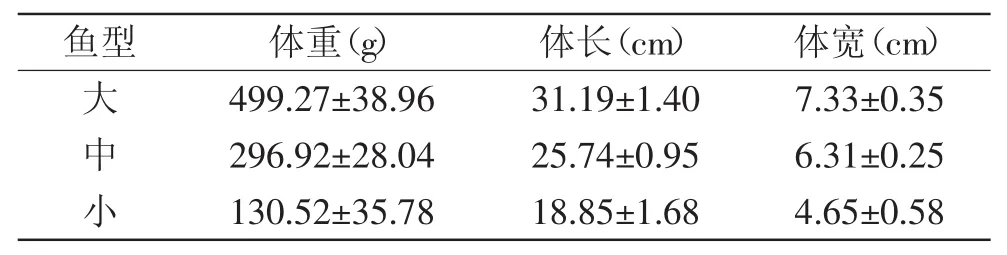
表1 大、中、小鱼的形体指数Table.1 The body index of large,medium and small-sized fish
HITACHI L-8900氨基酸自动分析仪日本日立公司;PCR仪器、荧光定量PCR仪、凝胶成像系统、水平电泳槽及电泳仪美国Bio-Rad公司;微量移液枪、Centrifuge 5810R高速低温离心机德国Eppendorf公司等。
1.2实验方法
1.2.1肌肉品质相关指标测定将鱼解剖,取完各脏器样品后,使用流水快速冲洗,去除血污等杂物,背鳍处吸干水,剥皮后,割离肉(要求无骨无刺)粉碎,密封袋储存,用于鱼肉常规指标测定。采用常规烘干失重法测定鱼肉中的水分含量,凯氏定氮法测定粗蛋白含量,索氏抽提法测定粗脂肪含量,干灰化法来测定灰分;参考GB/T 5009.124-2003,测定肌肉中的氨基酸组成。
取粉碎的鱼肉5g(重量即为m0),加入少量蒸馏水,用研钵碾碎匀浆,转移到小烧杯内,加入等量蒸馏水混和均匀,静置10min后,提取上清液,用酸度计测定pH,做3次平行,取平均值。
取鱼体背部肌肉(相同位置)5g(重量即为m0),于沸腾水中煮5min,捞出冷却,吸去鱼肉表面水分,称重为m,做3次平行,取平均值。失水率计算公式为:
1.2.2PPARγ、PGC-1α相对定量
1.2.2.1组织取样PGC-1α主要在能量代谢旺盛的肝脏、肌肉、肾脏中表达,具有明显的组织特异性[13-14]。将鱼禁食12h后捞出,解剖,取其头肾、肌肉、肝脏迅速标记通过液氮转入-80℃冰箱中保存。
1.2.2.2磨样将从三尾鱼取出的相同组织放入研钵中通过液氮研磨混样,每种体型鱼的每个组织做三个平行,研磨好后迅速装入提前冷冻好的EP管中,并迅速通过液氮转入-80℃冰箱中储存备用。
1.2.2.3总RNA提取及反转录为cDNA严格按照宝生物工程有限公司RNAiso Plus试剂说明书提取齐口裂腹鱼各组织的总RNA,用紫外分光光度计和1%琼脂糖凝胶电泳检测总RNA质量。为防止RNA的降解,用1μL的总RNA按照TaKaRa公司生产的反转录试剂盒处理得到第一股cDNA。
1.2.2.4荧光定量引物设计与合成:以齐口裂腹鱼β-actin基因序列(JQ013000)为依据设计内参基因的引物;采用Primer Premier 5.0软件,参考GenBank中草鱼PPARγ基因序列(Eu847421.1)和PGC-1α基因序列(JN195739)的保守区域,设计用于齐口裂腹鱼PPARγ、PGC-1α基因扩增的正反引物,序列如表2所示。

表2 引物序列及退火温度Table.2 Primer sequences and anneal temperature
实时荧光定量PCR基因检测:使用1.2.2.3步骤中制备的cDNA,按照TaKaRa公司生产的荧光定量试剂盒说明书,配制10μL反应体系于0.2mL八联管中,含5μL SYBR®Premix Ex TaqTM(2×)、上下游引物各0.25、1μL cDNA、3.5μL DEPC水。荧光定量PCR程序为95℃3min;95℃10s,退火温度(待测基因)30s,39个循环;95℃10s;扩增完毕后,迅速降温到65℃进行溶解曲线分析,然后以0.5℃/s的速率从65℃递增到95℃,连续测定样品荧光强度以获取溶解曲线。
相对表达量分析:以β-actin为内参基因,根据扩增曲线得到的Ct值(荧光信号达到设定的阈值所经历的循环数),利用推导公式相对表达量=2-△Ct[15]计算出目标基因(PPARγ、PGC-1α)的相对表达量,从而制作相对表达量图表,式中△Ct=Ct待测基因-Ctβ-actin。
1.3数据统计分析
部分数据以均数±标准差来表示,采用SPSS 20.0软件单因素方差分析组间数据,通过Duncan’s多重比较法分析结果的差异显著性,p<0.05为显著性差异,p>0.05为无显著性差异,部分数据以平均值表示。
2 结果与分析
2.1不同质量齐口裂腹鱼肌肉品质相关指标分析
2.1.1不同质量齐口裂腹鱼肌肉基本成分分析水分、脂肪、蛋白质、灰分是肌肉中的主要组成成分。不同质量齐口裂腹鱼肌肉的基本成分见表3。由表3可知不同质量齐口裂腹鱼肌肉中粗脂肪含量有着显著性差异(p<0.05),大鱼中的脂肪含量最低;小鱼与中鱼肌肉中蛋白质含量差异不显著(p>0.05),但显著高于大鱼中的蛋白质含量;大、中、小鱼肌肉中水分、灰分含量无显著性差异(p>0.05)。

表3 齐口裂腹鱼的基本成分Table.3 The general nutritional composition of Schizothorax prenanti Tchang
一般认为,鱼肉中的水分含量高,则蛋白质、脂肪含量将会减少,鱼肉品质就差;相反,鱼肉水分含量低,则蛋白质、脂肪含量就高,鱼就肥嫩好吃[16]。由表3可知,大鱼中水分含量高,但蛋白质、脂肪含量低,而小鱼、中鱼水分含量低,脂肪、蛋白质含量则高。温安祥等[1]研究表明天然情况下,随着鱼体重的增长,其水分、粗蛋白与灰分含量略有降低,但粗脂肪含量明显增加,水分与粗脂含量与该结论相悖,这可能是受采样的季节和样品性别的影响。
2.1.2不同质量齐口裂腹鱼肌肉pH及失水率的分析
鱼被宰杀以后,肌肉在其内部各种酶及外界微生物的作用会产生一系列的变化。正常肌肉在宰杀之前呈中性或者弱碱性,宰杀之后,糖原在缺氧的条件下酵解产生乳酸,pH则会降低。随后,体内的蛋白质不断分解,形成氨基酸、肽、蛋白胨等,又会引起pH回升,当pH升至6.9以上时,肉会腐烂。如表4所示,鱼被宰杀后,放置一段时间,测定pH,不同质量齐口裂腹鱼的pH无差异。表明鱼的重量增长对肌肉的pH没有影响。
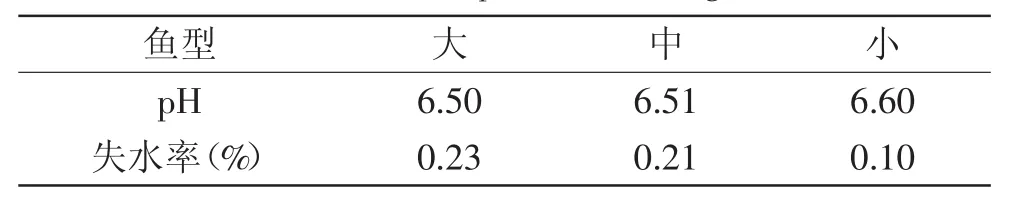
表4 齐口裂腹鱼肌肉pH及失水率Table.4 The pH value and dehydration rate in muscle of Schizothorax prenanti Tchang
肌肉组织的持水力直接影响着肉的色、香、味、多汁性、嫩度等。失水率是反应肌肉组织保持水分能力的一个重要指标,失水率高,则大量液体外流,可溶性营养成分和风味物质就会损失,肌肉也会变得干硬无味,从而导致肉品质降低。由表4可知小鱼肌肉的失水率最低,而大鱼的失水率最高。
2.1.3不同质量齐口裂腹鱼肌肉氨基酸组成分析氨基酸是蛋白质的组成单元。如表5所示,除了在水解过程中色氨酸被破坏外,不同重量的齐口裂腹鱼均检测出了17种氨基酸,小鱼肌肉干质中总氨基酸含量、必需氨基酸含量以及鲜味氨基酸含量均高于中鱼和大鱼,且大鱼中的氨基酸含量最低,各种氨基酸在三种不同体型鱼中的分布相似,谷氨酸的含量最高,其次是天冬氨酸、赖氨酸,胱氨酸的含量最低。
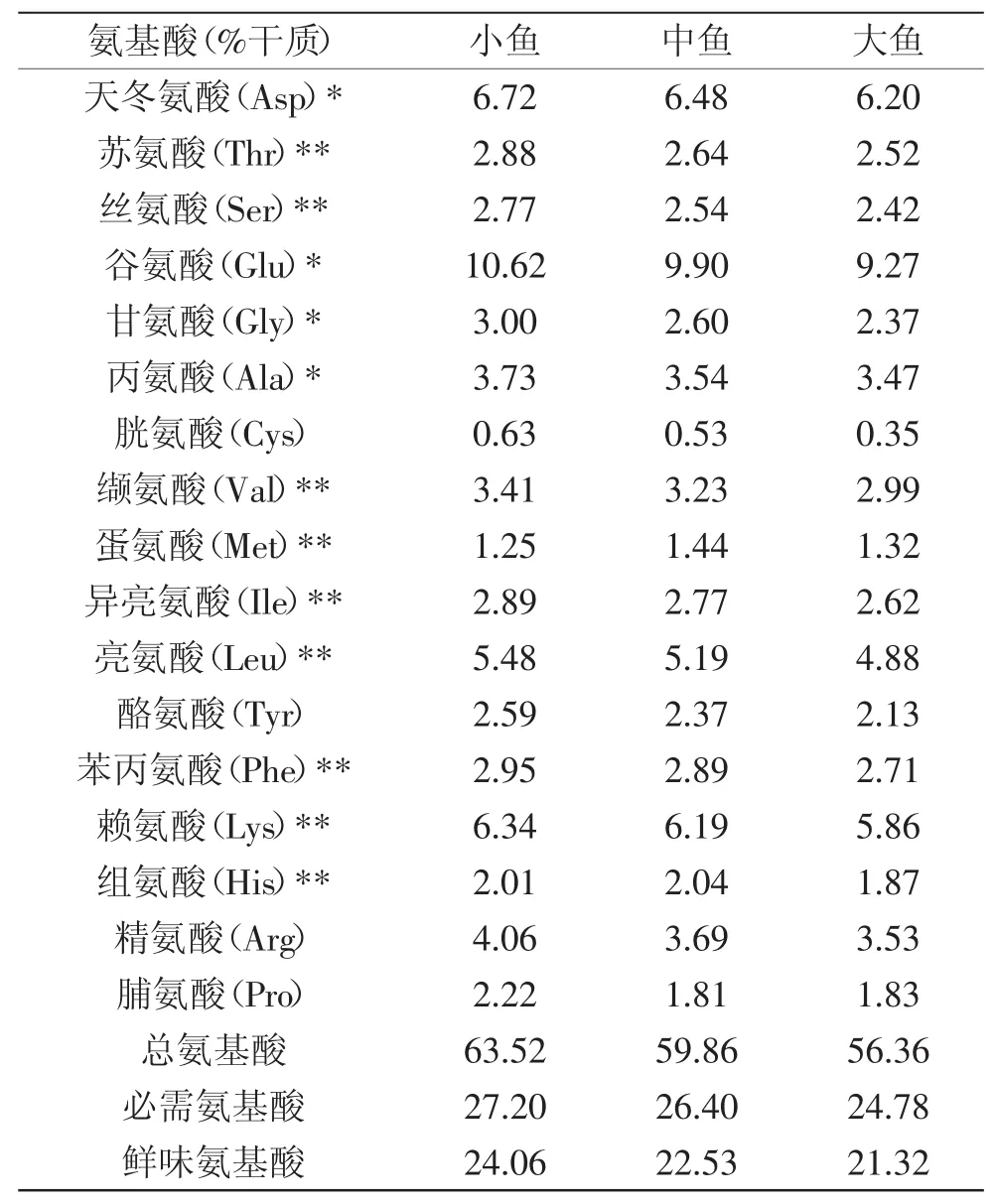
表5 齐口裂腹鱼肌肉氨基酸分析Table.5 The analysis of amino acid in muscle of Schizothorax prenanti Tchang
由于大鱼肌肉的失水率高于中鱼与小鱼,而失水率高会造成可溶性营养成分和风味物质的严重损失,因此大鱼肌肉中的总氨基酸含量、鲜味氨基酸含量、必需氨基酸含量低于中鱼,中鱼低于小鱼。肌肉中氨基酸的种类及分布与方静等[17]对齐口裂腹鱼肌肉营养成分分析结果一致,但氨基酸含量稍低于其研究结果,这可能是由于氨基酸分析所用鱼肉经过解冻后处理所致。
2.2PPARγ在不同质量齐口裂腹鱼的不同组织中的相对表达量分析
PPARγ在不同质量齐口裂腹鱼的不同组织中的相对表达量结果如图1、图2所示。

图1 头肾中PPARγ mRNA相对表达量Fig.1 PPARγ gene expression level in head kidney
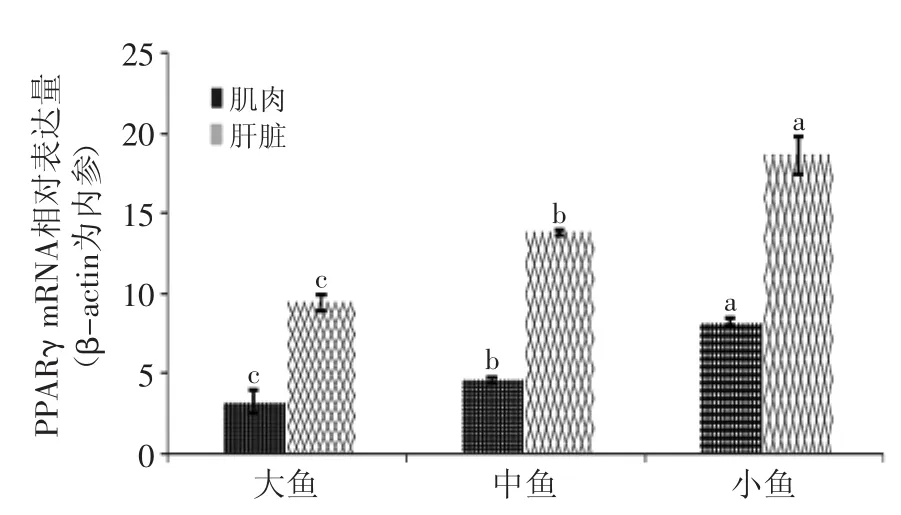
图2 肌肉、肝脏中PPARγ mRNA相对表达量Fig.2 PPARγ gene expression level in muscle and liver
由图1可知PPARγ在中鱼头肾中的表达量显著(p<0.05)高于在大鱼、小鱼中的表达量,在小鱼中的表达量又显著(p<0.05)高于大鱼中的表达量;由图2可知PPARγ在肝脏与肌肉中的相对表达量,在大、中、小鱼中有着显著性差异(p<0.05),在小鱼肝脏与肌肉中PPARγ相对表达量显著(p<0.05)高于大、中鱼,在中鱼肝脏与肌肉中相对表达又显著(p<0.05)高于大鱼中的相对表达量。
影响鱼肌肉粗脂肪含量的因素很多,龚兰[18]与Anna等[19]的研究表明,PPARγ的表达与体脂和肌内脂肪含量呈一定的相关性。PPARγ能够诱导小脂肪细胞的形成,调控脂蛋白酯酶、脂肪型脂肪酸结合蛋白、乙酰辅酶A、脂肪酸合成酶与脂肪酸转运蛋白等的表达,抑制瘦素的表达。通过本实验研究发现,PPARγ在大、中、小鱼头肾中相对表达量的差异与鱼肉中粗脂肪含量差异相同。头肾是鱼体重要的免疫器官,PPARγ可通过调节免疫相关的代谢通路来调节脂质代谢,但调节机理目前尚不明确。PPARγ在中鱼与小鱼肝脏与肌肉中的相对表达量显著(p<0.05)高于在大鱼中的相对表达量,这与中、小鱼肉中的粗脂肪含量显著(p<0.05)高于大鱼肉中的粗脂肪含量结果一致,表明PPARγ在组织中的相对表达量与肉质中脂肪沉积可能存在正相关的关系,这与Meadus[20]、Tamori等[21]学者关于PPARγ与脂质代谢的研究结果相似。
2.3PGC-1α在不同质量齐口裂腹鱼不同组织中的相对表达量分析

图3 头肾中PGC-1α mRNA相对表达量Fig.3 PGC-1α gene expression level in head kidney
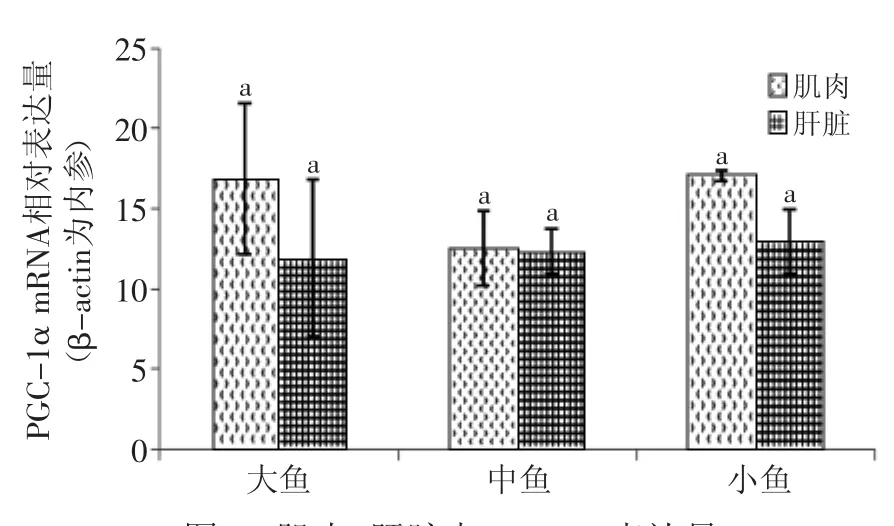
图4 肌肉、肝脏中PGC-1α表达量Fig.4 PGC-1α gene expression level in muscle and liver
由图3可知,PGC-1α在大、中、小鱼头肾中的相对表达量有着显著性差异(p<0.05),在大鱼中的相对表达量显著(p<0.05)高于中鱼和小鱼中的相对表达量,在小鱼中的相对表达量又显著(p<0.05)高于中鱼的相对表达量;而图4则反映了PGC-1α在大、中、小鱼肌肉与肝脏组织中的相对表达量无显著性差异(p>0.05)。
PGC-1α在大、中、小鱼头肾中的相对表达量存在显著性差异,而在肌肉与肝脏中的相对表达量没有显著性差异,但可以看出PGC-1α在三个组织中的相对表达量与鱼肉中粗脂肪含量可能存在负相关系。PGC-1α可以促进长链脂肪酸进入线粒体进行氧化[22],PGC-1α缺陷或表达量降低,长链脂肪酸的氧化速率就会降低,线粒体的呼吸率就会下降,就会影响肥胖的发生。Koo等[23]将小鼠的PGC-1α敲出会表现出脂肪酸氧化能力下调,导致脂肪沉积,这与本研究的结论相似。
3 结论
通过对不同质量的齐口裂腹鱼肌肉品质进行分析,发现中、小鱼肌肉中的蛋白质、脂肪、鲜味氨基酸、必需氨基酸的含量高于大鱼肌肉中的含量,而失水率低于大鱼肌肉的失水率,因此齐口裂腹鱼鱼肉的品质及营养价值与鱼体生长存在一定的关系,中、小体型齐口裂腹鱼肌肉的品质及营养价值高于大鱼;通过荧光定量PCR技术对齐口裂腹鱼不同组织中的PPARγ、PGC-1α基因相对表达量进行分析,发现齐口裂腹鱼组织中PPARγ、PGC-1α的相对表达量与肌肉中的粗脂肪含量存在着密切的联系,PPARγ的相对表达量与肌肉粗脂肪含量可能存在正相关性,而PGC-1α的相对表达量与肌肉脂肪沉积可能存在负相关性,三者之间的关系及调节机理尚不完全明确,有待于进一步验证及深入研究。
[1]温安祥,曾静康,何涛.齐口裂腹鱼肌肉的营养成分分析[J].水利渔业,2003(1):13-15.
[2]向枭,陈建,周兴华,等.5种脂肪源对齐口裂腹鱼生长性能及血清生化指标的影响[J].动物营养学报,2010(2):498-504.
[3]Mettu N B,Stanley T B,Dwyer M A.The nuclearreceptorcoactivator interaction surface as a target forpeptide antagonists oftheperoxisomeproliferator-activatedreceptors[J].Mol Endocrinol,2007,21(10):2361-2377.
[4]齐美玲,越赵.PGC-1α.PPARγ辅调节因子与脂代谢关系的研究进展[J].生命科学,2012,24(10):1150-1156.
[5]Jeninga E H,Schoonjans K J A.Reversible acety-lation of PGC-1:connecting energy sensors and effectorsto guarantee metabolic flexibility[J].Oncogene,2010,115629(33):4617-4624.
[6]Coste A,Louet J F,Lagouge M,et al.The genetic ablationof SRC-3 protects against obesity and improves insulinsensitivity by reducing the acetylation of PGC-1α[J].ProcNatl Acad Sci USA,2008,105(44):17187-17192.
[7]Lira V A,Brown D L,Lira A K,et al.Nitric oxide andAMPK cooperatively regulate PGC-1 in skeletal musclecells[J].J Physiol,2010,588(18):3266-3551.
[8]Leick L,Fentz J,Bienso R S,et al.PGC-1α is required for AICAR-induced expression of GLUT4 and mitochondrialproteins in mouse skeletal muscle[J].Am J Physiol Endocrinol Metab,2010,64(3):456-465.
[9]SummermatterS, BaumO, SantosG, etal. Peroxisomeproliferator-activated receptor γ coactivator 1α(PGC-1α)promotes skeletal muscle lipid refueling in vivo byactivating de novo lipogenesis and the pentose phosphatepathway[J].J Biol Chem,2010,285(43):32793-32800.
[10]Rowe G C,Jiang A Z A.PGC-1 coactivators incardiac development and disease[J].Circ Res,2010,107(7):825-838.
[11]Martin E,Betuing S,Pages C,et al.Mitogen-and stressactivated protein kinase 1-induced neuroprotection inHuntington’s disease:role on chromatin remodeling at the PGC-1-α promoter [J].Hum Mol Genet,2011,20(12):2422-2434.
[12]林亚秋,郑玉才,晁珊珊,等.齐口裂腹鱼PGC-1α基因编码区的克隆及其在肌肉组织中的表达[J].生物技术通讯,2013,24(1):71-75.
[13]Handschin C.Regulation of skeletal muscle cell plasticity by the peroxisome proliferator-activated receptorγ coactivator 1α [J].Receptors Signal Transduction,2010,3(6):376-384.
[14]吉红,刘品,李杰,等.PGC-1α基因的表达及饲喂n-3 HUFAs对其影响[J].水产学报,2010,34(9):1327-1334.
[15]PFAFFL M W.A new mathematical model for relative quantification in real-time RT--PCR[J].Nucleic Acids Res,2001,29(9):41-45.
[16]刘丽,余红心,肖维,等.鱼肉品质的研究进展[J].内陆水产,2008,36(8):9-12.
[17]方静,潘康成,邓天怀.齐口裂腹鱼肌肉营养成分分析[J].水产科学,2002,48(1):17-19.
[18]龚兰,金邦荃,章熙霞,等.杂交山猪骨骼肌PPARγ、RARα基因与脂代谢关系的研究[J].食品科学,2011,39(S1):62-67.
[19]Anna Bakera,Anagha Malur,Barbara P Barna,et al.PPARγ regulates the expression of cholesterol metabolism genes in alveolar macrophages[J].Biochemical and Biophysical Research Communications,2010,393(4):682-687.
[20]W J Meadus,R Maclnnis,M E Dugan.Prolonged dietarytreatmentwithconjugatedlinoleicacidstimulates porcinemuscle peroxisome proliferatorsactivatedreceptorγ andglutamine-fructose aminotransferase gene expression in vivo [J].J of Molecular Endocrinology,2002,28:79-86.
[21]Y Tamori,J Masugi,N Nishino,et al.Role of peroxisome proliferator-activatedreceptor-γinmaintenanceofthe characteristics of mature 3T3-L1 adipocytes[J].Diabetes,2002,51(7):2045-2055.
[22]Louet J F,Hayhurst G,Gonzalez F J,et al.The coactivator PGC-1 is involved in the regulation of the liver carnitine palmitoyltransferase I gene expression by cAMP in combination with HNF4α and cAMP-response element-binding protein(CREB)[J].J Biol Chem,2002,277(41):37991-38000.
[23]Koo S H,Satoh H,Herzig S,et al.PGC-1 promotes insulin resistance in liver through PPAR-α-dependent induction of TRB-3[J].Nat Med,2004,10(5):530-540.
Analysis of muscle quality and the relative expression of PPARγ and PGC-1α in Schizothorax Prenanti Tchang
In this paper,the quality of muscle in Schizothorax prenanti Tchang of different weight was analyzed and the Real-time PCR was applied to explore the relative expression of PGC-1α and PPARγ of the fish in different tissue.The results showed that the content of protein and crude fat in Schizothorax prenanti Tchang of different weight were significant difference(p<0.05).The content of moisture and ash were revealed to be no significant difference(p>0.05).The pH value in muscle was no difference.The dehydration rate in big fish was higher than the medium and small fish.The contents of total amino acids,essential amino acids and the umami amino acids in small and medium fish were higher than the big one.The quality of muscle in small and medium fish was better than big one.The relative expression of PPARγ in the head kidney,liver and muscle of Schizothorax prenanti fish of different qualities was existed significant difference(p<0.05).The relative expression of PGC-1α in the head kidney existed significant difference(p<0.05),and revealed no significant difference(p>0.05)in liver and muscle.The expression of PPARγ and PGC-1α had a certain correlation with the crude fat in muscle.
Schizothorax prenanti Tchang;the quality of muscle;PPARγ;PGC-1α;relative expression
TS254.2
A
1002-0306(2015)04-0175-05
10.13386/j.issn1002-0306.2015.04.030
2014-05-09
冯姣(1989-),女,硕士研究生,研究方向:功能性食品。
邬应龙(1963-),男,博士,教授,研究方向:功能性食品。
四川省科技支撑计划项目(2009NZ007-007);四川农业大学“211”工程双支计划(2013)。

