饲粮物理有效中性洗涤纤维水平对8~10月龄奶牛瘤胃发酵参数和纤维降解菌的影响
陈 青 王洪荣 葛汝方 崔慧慧 王梦芝 喻礼怀 林 淼
(扬州大学动物科学与技术学院,扬州 225009)
粗料是反刍动物饲粮中重要组成成分,是保证反刍动物生理健康和生产性能的关键。饲粮中NDF水平在很大程度上影响瘤胃健康,同时,饲料的物理与化学特性在很大程度上影响动物的咀嚼与反刍时间,从而与瘤胃酸中毒的发生有一定关系[1]。Menters[2]在 1997 年提出物理有效中性洗涤纤维(physically effective neutral detergent fiber,peNDF)的概念,认为不仅纤维的化学成分在反刍动物饲粮中具有重要性,而且物理性状也有十分重要的作用。peNDF可维持瘤胃正常功能和动物的健康,维持动物正常的生产性能,为动物提供大量能源,peNDF还可刺激反刍动物的肠黏膜,促进胃肠道的蠕动和粪便的排泄[3],故peNDF可以作为衡量奶牛健康及生产性能的重要指标。目前,已有众多学者的研究证明增加饲粮peNDF水平可提高泌乳期奶牛的瘤胃液pH、咀嚼活动和消化率,并影响乳蛋白和乳脂含量[4]。既然饲粮peNDF水平对泌乳奶牛的健康和生产性能有正面影响,那么peNDF水平对后备奶牛是否也有积极影响?因为在奶牛的各个生理阶段中,后备奶牛培育期在整个奶牛生产中承上启下,占着非常重要的地位。提高奶牛的产奶水平,奶牛的营养供给和科学的管理以及环境因素都很重要,但后备奶牛的培育更为重要[5]。该阶段耗费的饲养成本较大,合理培育这阶段的后备奶牛,不仅可延长奶牛的生命和使用年限,提高饲料利用率和产奶量,降低养殖成本,还有利于奶牛业的长期发展,为高产和稳产奶牛群的建立奠定基础[6]。而8~10月龄奶牛是转入育成期的小育成牛,是母牛性成熟的重要时期[7],也是转入育成阶段后的生长高峰期[8],合理培育该阶段的母牛可避免过早或过迟进入初情期,为后续配种和产犊打下基础。因此研究清楚peNDF水平对8~10月龄后备奶牛的影响可以为培育高品质后备奶牛做出重要贡献。本试验通过改变饲粮中粗料羊草的长度来改变peNDF水平,旨在研究不同peNDF水平的饲粮对8~10月龄后备荷斯坦奶牛采食量、瘤胃发酵参数和纤维降解菌的影响,为确定8~10月龄荷斯坦奶牛适宜的peNDF需要量提供科学依据。
1 材料与方法
1.1 试验设计与饲养管理
选取 24头 8~10月龄体重[(305.88±20.97)kg]接近的健康中国荷斯坦奶牛母牛,随机分为4组,每组6个重复,每个重复1头,采用单因子试验设计,分别饲喂4组不同peNDF水平的饲粮。使用多功能铡草机(0.4型和40B型,郑州兴达机械有限公司)将各组饲粮中的粗料羊草分别铡成1、3、5和7 cm 4种理论长度。4组饲粮除羊草长度外其他均无差别。饲粮每天配制,将精料、玉米青贮和羊草混匀以全混合日粮(TMR)形式饲喂。参照 NRC(2001)[9]配制产奶净能为6.65 MJ/kg和粗蛋白质为15.21%的饲粮。试验期共70 d,预试期10 d,正试期60 d。奶牛每天饲喂2次(07:00和18:00),自由采食,自由饮水。定期对牛舍进行消毒。试验饲粮组成、营养水平及颗粒分布情况见表1。饲粮颗粒分布情况采用宾州粗料分级筛(PSPS)(武汉市科立博器材有限公司)测定,具体操作参照Heinrichs等[10]的方法。

表1 试验饲粮组成、营养水平及颗粒分布情况(干物质基础)Table 1 Composition,nutrient levels and particle size distribution of experimental diets(DM basis) %

续表1
1.2 样品采集与分析
1.2.1 采食量及平均日增重(ADG)的测定
正试期内每周收集饲粮样品和剩料样品,置于65℃烘箱中干燥48 h,烘干后粉碎过40目筛,-20℃冰箱保存待测。营养水平测定:饲粮中干物质(DM)、钙(Ca)、磷(P)和粗灰分含量采用国标法测定(GB/T 6435—1986、GB/T 6436—2002、GB/T 6437—2002和 GB/T 6438—1992);粗蛋白质含量用FOSS-KT260定氮仪测定;中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量用ANKOM-A200i型半自动纤维分析仪测定。正试期内每15 d于晨饲前测量体重。
1.2.2 瘤胃发酵参数和瘤胃菌群结构的测定
正试期的56~58 d每日晨饲后6 h利用口腔瘤胃液采集器(ANSCITECH胃管式瘤胃液采样器,武汉市科立博器材有限公司)采集瘤胃液200 mL,经4层纱布过滤,立即用pHS-3C型pH仪测定瘤胃液pH。过滤后的瘤胃液-80℃保存,用于其他瘤胃发酵参数的测定。瘤胃液氨态氮(NH3-N)浓度采用冯宗慈等[12]的比色法测定。采用气相色谱法测定挥发性脂肪酸(VFA)含量[13]。对瘤胃液的纤维降解菌进行定量,瘤胃细菌基因组DNA的提取参照Zhou等[14]的反复冻融法进行,瘤胃细菌定量采用实时定量PCR(RT-PCR)比较阈值法,目的菌相对含量计算采用2-△△Ct法[15]。瘤胃细菌RT-PCR的引物序列见表2。PCR反应体系及和反应参数参照TIANGEN试剂盒(FP205)说明书进行。

表2 瘤胃细菌RT-PCR的引物序列Table 2 Primer sequences for RT-PCR of rumen bacteria
1.3 数据处理
试验数据用Excel 2003建立数据库,通过SPSS 19.0软件中的单因素方差分析对数据进行统计分析和显著性检验,运用LSD法进行多重比较,P <0.05为差异显著,P <0.01为差异极显著,结果以平均值与平均标准误表示。
2 结果与分析
2.1 不同peNDF水平饲粮对奶牛生产性能的影响
由表3可知,peNDF水平对各组后备奶牛的DM、NDF、ADF采食量和ADG均无显著影响(P>0.05)。但可观察到 ADG随着 peNDF水平的增加而增加。

表3 不同peNDF水平饲粮对奶牛生产性能的影响Table 3 Effects of different levels of peNDF in diets on performance of heifers kg/d
2.2 不同peNDF水平饲粮对奶牛瘤胃发酵参数的影响
由表4可知,各组瘤胃液pH均在6.0以上,pH随着peNDF水平的增加而增加,并且peNDF1.18为22.73%组的 pH极显著低于其他3组(P <0.01),peNDF1.18为 23.92% 组极显著低于peNDF1.18为 25.85% 组(P < 0.01)。peNDF 水平对瘤胃液中总挥发性脂肪酸(TVFA)浓度、乙酸和丁酸含量的影响不显著(P>0.05);丙酸含量总体上随peNDF水平的增加而减少,peNDF1.18为 22.73%组极显著高于 peNDF1.18为 23.92% 组(P <0.01)、显 著 高于 peNDF1.18为 28.39% 组(P < 0.05),peNDF1.18为 25.85% 组 和 peNDF1.18为 28.39%组间差异不显著(P >0.05);peNDF1.18为 23.92%组的乙酸/丙酸极显著高于 peNDF1.18为22.73%组(P <0.01),并且显著高于 peNDF1.18为25.85% 组 (P < 0.05),peNDF1.18为 25.85% 组 和peNDF1.18为28.39% 组间差异不显著(P > 0.05)。peNDF1.18为25.85%组的 NH3-N 浓度极显著高于peNDF1.18为 22.73% 组 和 peNDF1.18为 peNDF1.18为 23.92% 组,而且显著高于 peNDF1.18为 28.39%组(P <0.05),peNDF1.18为 22.73% 、23.92% 、25.85%3组之间差异不显著(P>0.05)。
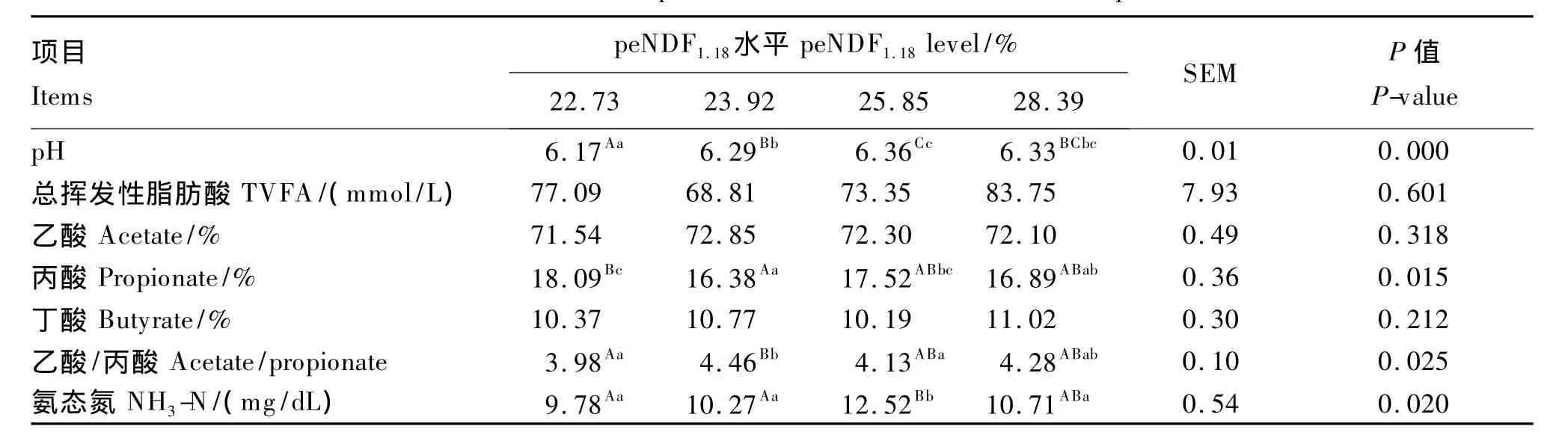
表4 不同peNDF水平饲粮对奶牛瘤胃发酵参数的影响Table 4 Effects of different levels of peNDF in diets on rumen fermentation parameters of heifers
2.3 不同 peNDF水平饲粮对奶牛瘤胃纤维降解菌相对含量的影响
由表 5 可知,试验以 peNDF1.18为 22.73% 组为对照组,产琥珀酸丝状杆菌的相对含量随饲粮peNDF水平的增加而增加,黄色瘤胃球菌、白色瘤胃球菌和溶纤维丁酸弧菌相对含量呈现先上升后下降的趋势。peNDF1.18为22.73%组的产琥珀酸丝状杆菌相对含量极显著高于另外3组(P<0.01),peNDF1.18为 28.39% 组极著高于 peNDF1.18为 23.92%组(P < 0.05),peNDF1.18为 25.85% 组显著 高 于 peNDF1.18为 23.92% 组(P < 0.05);peNDF1.18为25.85%组的黄色瘤胃球菌相对含量极显著高 于 peNDF1.18为 22.73% 组(P < 0.01)并 且显 著 高 于peNDF1.18为23 .92% 组 和 peNDF1.18为28.39%组(P <0.05),peNDF1.18为 23.92% 组的黄色瘤胃球菌相对含量显著高于peNDF1.18为22.73%组(P < 0.05);peNDF1.18为 22.73% 组和 peNDF1.18为28.39%组的白色瘤胃球菌相对含量极显著低于peNDF1.18为 25.85% 组(P <0.01),peNDF1.18为 22.73% 组显著低于 peNDF1.18为23.92% 组(P < 0.05),peNDF1.18为 23.92% 组显著低于 peNDF1.18为25.85%组(P <0.05);peNDF1.18为 25.85% 组的溶纤维丁酸弧菌相对含量极显著高于其他3组(P<0.01),peNDF1.18为 22.73% 组显著低于 peNDF1.18为 23.92%组和 peNDF1.18为28.39% 组(P <0.05),peNDF1.18为 23.92% 组和 peNDF1.18为 28.39% 组差异不显著(P >0.05)。
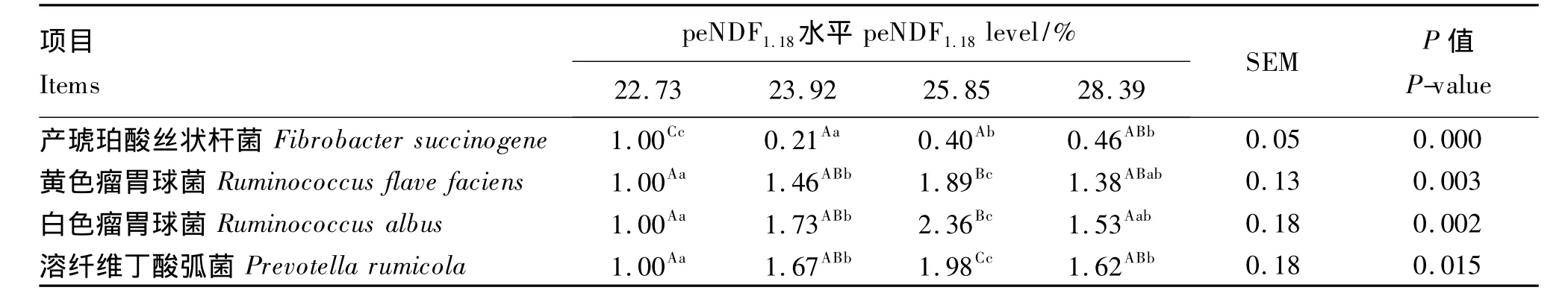
表5 不同peNDF水平饲粮对奶牛瘤胃纤维降解菌相对含量的影响Table 5 Effects of different levels of peNDF in diets on the relative content of cellulolytic bacteria of heifers
3 讨论
3.1 不同peNDF水平饲粮对奶牛生产性能的影响
本试验中饲粮的粗料长度对DM、NDF和ADF采食量并无显著影响,该结果与众多学者试验结果一致,如 Beauchemin 等[18]和 Yang 等[19]的研究表明,增加peNDF水平不影响DM采食量,但增加饲粮中青贮与干草的比例增加了DM采食量;Yang等[20]的试验显示增加粗料长度不影响营养物质摄入量,但增加粗精比降低了DM采食量,Tafaj等[4]通过对25篇文章的Meta分析发现饲粮中粗料比例大于60%时,DM采食量会受到粗料长度的影响,而比例小于40%时不影响DM采食量,本试验中,粗料比例未超过60%,所以采食量无显著变化的结果与之一致;Alende等[21]发现饲粮中青贮饲料长度不影响DM采食量,但添加小麦秸秆后降低了 DM 采食量;Stojanovic等[22]和Alamouti等[23]的试验结果显示粗料与饲粮颗粒大小均不影响DM采食量;由此可见影响营养物质摄入量的主要因素是饲粮中青贮与干草的比例、饲粮粗精比、NDF及粗饲料来源NDF(FNDF)含量、非纤维性碳水化合物(NFC)与NDF比例、粗料种类和粗料品质等,而不是粗料长度或饲粮颗粒长度。此外,Tafaj等[4]还认为饲粮中粗料长度对营养物质摄入量的影响与NDF、FNDF和NFC与NDF比例有交互作用。而在本试验的试验饲粮中,除粗料长度不同外,其他饲粮因素均无差别,因此各组的DM、NDF和ADF采食量并未显示显著差异。
本试验中,ADG随着peNDF水平的增加而增加。后备奶牛ADG过低和过高都会造成不利影响,后备奶牛ADG过低,会造成达到配种年龄时体重过小,从而使发情周期推迟;ADG过高会使奶牛因体脂肪贮存而过肥,母牛发情配种不易受胎,成年后产犊时发生难产[8]。刁其玉[6]推荐养殖场后备奶牛的最佳生长速度控制在800 g/d,本试验中 peNDF1.18为 25.85% 组和 peNDF1.18为 28.39%组的 ADG分别是0.88和 0.97 kg/d,均达到了800 g/d以上,但 peNDF1.18为 28.39% 组的 ADG过高,故 peNDF1.18为 25.85%组的 ADG 较适宜。
3.2 不同peNDF水平饲粮对奶牛瘤胃发酵参数的影响
本试验中,瘤胃液pH随着peNDF水平的增加而增加,该结果与其他学者研究结果一致。Beauchemin等[18]的试验显示用切割的干草代替粉碎的干草提高了瘤胃液pH,增加了pH大于6.2的持续时间,减少了pH小于5.8的持续时间,而且改变饲粮peNDF对pH的影响大于改变青贮与干草比例对pH的影响。Yang等[24]发现增加青贮苜蓿的长度提高了瘤胃液pH,peNDF8.0与平均瘤胃液pH呈正相关,与pH小于5.8或5.5的持续时间呈负相关。Zhao等[25-26]认为增加饲粮中稻草或苜蓿干草的长度,显著增加了瘤胃液pH;增加饲粮peDNF,反刍和总咀嚼时间线性增加,导致pH小于5.8的持续时间减少。瘤胃液pH是食糜中VFA与唾液中缓冲盐相互作用以及瘤胃上皮对VFA吸收及随食糜流出等因素综合作用的结果;瘤胃液pH主要受饲粮精粗比、采食与反刍时间的影响[27]。本试验中,4组饲粮精粗比相同,而咀嚼活动的增加使唾液分泌加强,从而更好地缓冲和中和瘤胃中的VFA,导致pH上升。
饲粮peNDF水平对瘤胃VFA的影响在众学者间尚存在争议,Zhao 等[25]、Zebeli等[28]认为增加饲粮中苜蓿干草或者青贮玉米的长度不影响VFA的含量,而Beauchemin等[29]认为增加粗料长度降低了 VFA 含量;Beauchemin等[29]、Kononoff等[30]和贺鸣[31]认为增加饲粮中粗料长度增加了乙酸/丙酸,而 Zebeli等[28]的试验结果与之相反,他认为增加饲粮中青贮玉米的长度降低了乙酸/丙酸。这种差异的出现可能是在各个学者的试验中,组的粗料长度不一致、国内外饲粮配方原料品质的差异以及动物个体的差异造成的。本试验中,TVFA浓度虽然没有显著差异,但是可以观察到随着羊草长度的增加先下降后上升的过程。影响瘤胃发酵、VFA产生量和比例的因素有饲粮的类型、不同种类的碳水化合物饲料原料来源、碳水化合物的加工处理技术、瘤胃环境和添加剂[27]。本试验中各组饲粮类型、碳水化合物原料来源和饲粮添加剂完全相同,所以饲粮的加工处理和瘤胃环境成为影响影响瘤胃发酵、VFA产生量和比例的主导因素,最短长度粗料组TVFA浓度较高可能是因为切短的粗料增加了可供瘤胃微生物利用的接触面积,使得饲粮快速发酵产生大量VFA,而较长的粗料组表现高TVFA浓度的原因可能是长粗料增加了其在瘤胃中的滞留时间,让饲粮得到更充分的发酵从而增加TVFA浓度,而且粗料长度的增加使食糜尺寸增加,导致食糜团中VFA的周转率下降造成VFA的积累[32]。
本试验发现,饲粮peNDF水平的增加对乙酸和丁酸含量无显著影响,但能显著降低丙酸含量。乙酸含量虽无显著差异,但有一个随着粗料长度的增加而先增加后下降的过程,原因是纤维类碳水化合物在瘤胃中降解产生乙酸。粗料长度的增加会降低淀粉在瘤胃中的消化率[19,26],从而降低了其降解产物丙酸的产生。乙酸/丙酸总体上随着peNDF水平的增加而增加,其变化趋势与丙酸含量的变化正好相反,是因为乙酸含量无显著变化而丙酸含量显著增加造成的。
本试验结果显示瘤胃液NH3-N浓度随着peNDF水平的增加而增加,该结果与贺鸣[31]的试验结果一致。瘤胃中NH3-N浓度受采食量、瘤胃外流速度以及饲粮中蛋白质种类、含量和溶解度的影响,本试验中,4组的采食量以及饲粮中蛋白质种类、含量和溶解度均无差别,所以瘤胃外流速度是影响瘤胃NH3-N浓度的主要因素,增加粗料长度增加了饲料在瘤胃中滞留发酵的时间,降低了外流速度,蛋白质消化率增加,瘤胃中NH3-N的浓度因此升高。
3.3 不同 peNDF水平饲粮对奶牛瘤胃纤维降解菌相对含量的影响
瘤胃中微生物的含量受限于食糜的滞留时间和流速、可溶性底物的供给以及瘤胃环境[27]。本试验中,黄色瘤胃球菌、白色瘤胃球菌和溶纤维丁酸弧菌的相对含量随着peNDF水平的增加呈现先上升后下降的趋势。粗料长度的增加,增加了食糜在瘤胃中的滞留时间并降低了外流速度,让微生物得以充分的降解粗料和增加自身繁殖,造成相对含量的增加。而羊草增加到7 cm时,细菌含量有下降的趋势,这与瘤胃液pH的变化一致,可能是因为7 cm羊草组pH的下降稍微降低了细菌的活性。产琥珀酸丝状杆菌的相对含量与预想的试验结果有很大差距,羊草长度从3 cm增加到7 cm时,其相对含量增加,但羊草长度为1 cm时,其相对含量显著高于其他3组,虽然我们没有明确的证据解释这种结果,但推测其原因有以下2面:一方面,通常理论上认为pH低于6.2时纤维降解菌的活性受到抑制,但产琥珀酸丝状杆菌在pH刚刚低于6.2时可能仍然具有较高活性,而且切短的粗料增加了细菌与底物的接触面积,使得产琥珀酸丝状杆菌对底物降解加速并迅速繁殖;另一方面,纤维降解菌主要附着于饲料颗粒,而本试验是通过口腔来采集瘤胃液,瘤胃液偏向于液相,没有完整反映瘤胃微生物的情况。
4 结论
①饲粮中peNDF水平的改变不影响饲粮营养物质的采食量。
②增加饲粮中peNDF水平能够提高瘤胃液pH。
③适当增加饲粮中peNDF水平可增加瘤胃中纤维降解菌的相对含量。
④ 饲粮 peNDF1.18为25.85%时可获得最佳ADG,故本试验中 peNDF1.18为 25.85% 是 8 ~ 10月龄荷斯坦奶牛适宜的peNDF水平。
[1] 王洪荣.反刍动物瘤胃酸中毒机制解析及其营养调控措施[J].动物营养学报,2014,26(10):3140-3148.
[2] MERTENS D R.Creating a system for meeting the fiber requirements of dairy cows[J].Journal of Dairy Science,1997,80(7):1463 -1481.
[3] SCHWAB E C,SHAVER R D,SHINNERS K J,et al.Processing and chop length effects in Brown-Midrib corn silage on intake,digestion,and milk production by dairy cows[J].Journal of Dairy Science,2002,85(3):613-623.
[4] TAFAJ M,ZEBELI Q,BAES C,et al.A meta-analysis examining effects of particle size of total mixed rations on intake,rumen digestion and milk production in high-yielding dairy cows in early lactation[J].Animal Feed Science and Technology,2007,138(2):137-161.
[5] 张卫兵,刁其玉,赵广城.从营养和饲养角度加强后备牛的培育[J].乳业科学与技术,2008(1):24-27.
[6] 刁其玉.优质后备奶牛的营养与培育[J].乳业科学与技术,2009(03):101-105.
[7] 于永华,纪小利.浅谈育成奶牛的饲养管理[J].中国畜禽种业,2012,12:94.
[8] 李文,刘小林,文利侠,等.中国荷斯坦后备奶牛生长发育规律的研究[J].畜牧兽医杂志,2007,05:19-21,24.
[9] NRC.Nutrient requirements of dairy cattle[S].7th ed.Washington,D.C.:National Academy Press,2001.
[10] HEINRICHSA J,KONONOFF P J.Evaluating particle size of forages and TMRs using the Penn State Particle Separator[EB/OL].[2010 -06 - 01].http://www.vetm ed.wsu.edu/courses-jmgay/ documents/DAS02421.pdf.
[11] 张宏福.动物营养参数与饲养标准[M].2版.北京:中国农业出版社,2010:6.
[12] 冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进[J].畜牧与饲料科学,2010,31(6 -7):37.
[13] 解永磊,秦松岩,王昕彤,毕成良.气相色谱测定挥发性脂肪酸的条件优化[J].广东农业科学,2014,23:98 -101,105.
[14] ZHOU J,BRUNS M A,TIEDJE J M.DNA recovery from soils of diverse composition[J].Applied and Environmental Microbiology,1996,62(2):316 -322.
[15] 阳成波,印遇龙,黄瑞林,等.实时定量RT-PCR的原理及方法[J].免疫学杂志,2003,19(3):145-150.
[16] MUYZER G,DE WAAL E C,UITTERLINDEN A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Applied and environmental microbiology,1993,59(3):695-700.
[17] 王加启.反刍动物营养学研究方法[M].北京:现代教育出版社,2011:33.
[18] BEAUCHEMIN K A,YANG W Z,RODE L M.Effects of particle size of alfalfa-based dairy cow diets on chewing activity,ruminal fermentation,and milk production[J].Journal of Dairy Science,2003,86(2):630 -643.
[19] YANG W Z,BEAUCHEMIN K A,RODE L M.Effects of particle size of alfalfa-based dairy cow diets on site and extent of digestion[J].Journal of Dairy Science,2002,85(8):1958 -1968.
[20] YANG W Z,BEAUCHEMIN K A.Altering physically effective fiber intake through forage proportion and particle length:digestion and milk production[J].Journal of Dairy Science,2007,90(7):3410 -3421.
[21] ALENDE M,DEPETRIS G J,DI MARCO O N,et al.Performance,chewing activity,and ruminal parameters in yearling beef steers fed early-harvested sorghum silage:effect of chop length and wheat straw addition[J].Animal Feed Science and Technology,2009,154(1-2):125-133.
[22] STOJANOVIC B,GRUBIC G,DJORDJEVIC N,et al.Effects of different levels of physically effective fibers in diets for cows in early lactation[J].Spanish Journal of Agricultural Research,2012,10(1):99 -107.
[23] ALAMOUTI A A,ALIKHANIM,GHORBANIG R,et al.Effects of inclusion of neutral detergent soluble fibre sources in diets varying in forage particle size on feed intake,digestive processes,and performance of mid-lactation Holstein cows[J].Animal Feed Science and Technology,2009,154(1 -2):9 -23.
[24] YANG W Z,BEAUCHEMIN K A.Altering physically effective fiber intake through forage proportion and particle length:chewing and ruminal pH[J].Journal of Dairy Science,2007,90(6):2826 -2838.
[25] ZHAO X H,ZHANG T,XU M,et al.Effects of physically effective fiber on chewing activity,ruminal fermentation,and digestibility in goats[J].Journal of Animal Science,2011,89(2):501 -509.
[26] ZHAO X G,WANG M,TAN Z L,et al.Effects of Rice Straw Particle Size on Chewing Activity,Feed Intake,Rumen Fermentation and Digestion in Goats[J].Asian-Australasian Journal of Animal Sciences,2009,22(9):1256-1266.
[27] 冯仰廉.反刍动物营养学[M].北京:科学出版社,2004.
[28] ZEBELI Q,TAFAJ M,JUNCK B,et al.Evaluation of the response of ruminal fermentation and activities of nonstarch polysaccharide-degrading enzymes to particle length of corn silage in dairy cows[J].Journal of Dairy Science,2008,91(6):2388 -2398.
[29] BEAUCHEMIN K A,YANG W Z.Effects of physically effective fiber on intake,chewing activity,and ruminal acidosis for dairy cows fed diets based on corn silage[J].Journal of Dairy Science,2005,88(6):2117-2129.
[30] KONONOFF P J,HEINRICHS A J.The effect of reducing alfalfa haylage particle size on cows in early lactation[J].Journal of Dairy Science,2003,86(4):1445-1457.
[31] 贺鸣.TMR中粗饲料不同颗粒大小对干奶牛咀嚼行为和瘤胃发酵的影响[D].硕士学位论文.北京:中国农业大学,2005.
[32] STORM A C,KRISTENSEN N B.Effects of particle size and dry matter content of a total mixed ration on intraruminal equilibration and net portal flux of volatile fatty acids in lactating dairy cows[J].Journal of Dairy Science,2010,93(9):4223-4238.

