Ezrin蛋白在胃癌增殖侵袭过程中的作用及其机制初探
陆 俊,曹龙龙,黄昌明,郑朝辉,李 平,谢建伟
近十年来,尽管全球胃癌的发病率呈逐年下降趋势,但是胃癌仍是目前世界上第四大常见的恶性肿瘤和最常见的消化道恶性肿瘤之一,而且高居全球癌症相关死因第二位,严重危害人类的健康安全[1-2]。尽管胃癌的根治性手术、术前化疗、术后辅助化疗和同步放疗等综合治疗手段不断进步,但仍无法获得满意疗效,复发和转移是胃癌患者的主要死亡原因。因此,积极探索胃癌侵袭、转移的分子机制,寻找新的防治靶点,进一步制定新的有效的干预策略,对提高胃癌患者长期生存率具有重要的临床意义和社会价值。
Ezrin蛋白是 ERM(Ezrin-Radimn-Moesin)家族的重要成员之一,是一种膜-细胞骨架链接蛋白,对细胞粘附、形态、分化、运动等起重要调节作用。近来研究显示,Ezrin蛋白对恶性肿瘤的预后价值仍未达成共识。Wang等报道,在结肠癌患者中,Ezrin蛋白高表达则预示患者预后不良[3]。Moilanen等则认为,对于卵巢浆液性囊腺癌的患者,Ezrin蛋白表达越低,其预后越差[4]。目前,Ezrin蛋白对胃癌生物学行为的改变以及对胃癌患者预后影响的研究少见报道。因此,本研究旨在通过检测Ezrin在胃癌中的表达情况,分析Ezrin与胃癌增殖侵袭及与胃癌患者预后的相关性,初步探讨Ezrin蛋白在胃癌增殖侵袭过程中的作用机制,以期为胃癌侵袭转移、预后判断及临床治疗提供新的思路和依据。
1 对象与方法
1.1 对象 收集2006年10月-2007年9月存档的石蜡包埋标本294例,男性209例,女性85例,年龄中位数60岁(22~88岁)。无腹膜转移的胃癌组织206例,腹膜转移癌组织34例,癌旁组织54例。另外收集2012年5-6月手术的16例胃癌患者的新鲜胃癌组织及其邻近的癌旁组织,男性11例,女性5例,年龄中位数57岁(31~76岁)。患者术前均未接受过放化疗,均施行胃癌D2根治术,术后标本均由2位经验丰富的病理医师检查,病理诊断无误。手术方法及术后病理组织学分型均按日本胃癌协会《胃癌处理规约》规定施行,并按第7版UICCTNM分期标准予以TNM 分期[5-6]。全组191例患者获得随访,随访率为92.7%,随访时间中位数51.5月(3~70月)。
1.2 方法
1.2.1 免疫组织化学 采用二步法免疫染色方法。主要步骤如下:石蜡包埋胃癌组织,经4μm连续切片,贴于多聚赖氨酸处理过的载玻片上,65℃烘干3h。经过二甲苯脱蜡、梯度酒精水化。将切片浸入枸橼酸盐缓冲液中,通过高压法修复抗原。去离子水孵育10min,阻断内源性过氧化物酶。添加一抗(兔抗人Ezrin多克隆抗体工作浓度1∶500),4℃过夜。添加试剂1(增强剂),37℃孵育20min;添加试剂2(二抗),37℃孵育30min;DAB溶液显色。最后经苏木素复染后,用中性树胶封片。染色结果判断按肿瘤细胞阳性率和着色强度分别进行记分,两者记分乘积:0~3分为弱表达组,≥4分为强表达组。
1.2.2 Western-blot检测 采用免疫印迹法检测新鲜胃癌标本中Ezrin蛋白的表达量。具体步骤如下:将胃癌组织置于液氮中(或培养的胃癌细胞置于匀浆器中)充分研磨,离心后收集上清液为组织蛋白抽提物,存放于-20℃冰箱。对组织蛋白进行BCA法蛋白定量检测。取含有50μg蛋白的样品加入适当的上样缓冲液,将含蛋白的上样缓冲液加入凝胶中,设定100V电压行电泳,设定电压100V,电流300mA,恒流,冰浴下转膜90min。采用脱脂奶粉封闭非特异性免疫反应结合位点,加一抗(Ezrin浓度1∶800;GAPDH 浓度1∶1 000),脱色摇床上4℃孵育过夜。加入1∶500的用封闭液稀释的相应的二抗,室温缓慢振摇90min,加ECL发光底物,最后曝光、密度扫描和半定量分析。
1.2.3 细胞培养与转染 将冻存 MKN-45胃癌细胞进行复苏,加入10%胎牛血清的RPMI 1640培养液中,并置于37℃、体积分数为0.05的CO2培养箱中进行细胞传代培养,选取呈对数生长期的细胞进行下一步实验。采用对数生长期的细胞,以每孔5×104接种细胞,铺一块六孔板。取5.0μL的siRNA溶于200μL opti-MEM中,标记为A管;将5μL lipo2000加入200μL opti-MEM 中,标记为B管;将A管和B管混合后分别加入各孔中,转染4h后每孔加入2mL完全培养基,继续培养48h,最终获得下调Ezrin蛋白的细胞系E-SH1和E-SH2。
1.2.4 MTT法检测细胞增殖 采用 MTT溶液(5mg/mL)处理siRNA干扰的实验组及未处理的对照组,于37℃、体积分数为0.05的CO2条件下孵育4h,在酶标仪上测定各孔细胞吸光度,以时间为横轴、各孔细胞吸光度为纵轴绘制时间曲线。
1.2.5 细胞侵袭实验 将siRNA干扰的实验组细胞及未处理的对照组细胞等量加入Transwell小室中,小室内用无血清培养基,24孔板内加入含20%血清的培养液,于37℃、体积分数为0.05的CO2条件下培养24h。通过固定及染色进行细胞计数。
1.3 统计学处理 数据统计分析和作图均使用Microsoft Office Excel 2007和SPSS 17.0软件包。计量资料用±s表示,采用非配对样本t检验;计数资料采用卡方检验或者Fisher确切概率法;单因素生存分析采用Kaplan-Meier方法和Log-rank检验;多因素生存分析采用Cox比例风险回归模型分析。P<0.05表示差别有统计学意义。
2 结 果
2.1 Ezrin蛋白在胃癌组织、癌旁组织及腹膜转移灶中的表达 在正常胃黏膜组织中,Ezrin蛋白表达率低,大多数为阴性或弱阳性表达;在胃癌组织及腹膜转移灶癌组织中,Ezrin蛋白强阳性表达率明显升高(图1),Ezrin蛋白在胃癌组织中的强阳性表达率为53.9%(111/206),弱阳性表达率为46.1%(95/206);在癌旁组织中的强阳性表达率为31.5%(17/54),弱阳性表达率为68.5%(37/54),两者差别有统计学意义(χ2=8.591,P<0.05);Ezrin蛋白在腹膜转移灶癌组织中的强阳性表达率为70.6%(24/34),弱阳性表达率为29.4%(10/34),与原发灶癌组织相比,两者差别有统计学意义(χ2=4.587,P<0.05)。
2.2 Ezrin蛋白在新鲜胃癌组织及癌旁组织中的表达 16例新鲜胃癌组织及其邻近癌旁组织中Ezrin蛋白的表达程度不同,其中第13,15例患者的肿瘤组织及癌旁组织均未检测出Ezrin蛋白的表达。Image J灰度分析软件分析结果显示(排除第13,15例),Ezrin蛋白表达相对强度在胃癌组织为(0.796 2±0.494 5),明显高于其在邻近癌旁组织中的表达(0.435 5±0.418 5),2组差别具有统计学意义(t=2.560,P=0.023 7,图2)。
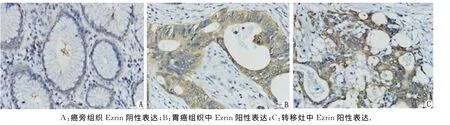
图1 Ezrin蛋白在癌旁组织、胃癌组织和转移灶组织中的表达情况( ×400)Fig 1 Representative Ezrin immunostaining in normal gastric tissues,primary gastric tumors and metastasis from the same patient( ×400)
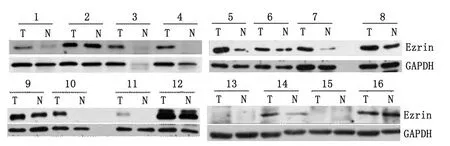
图2 16例胃癌组织及其邻近癌旁组织的Western-blot检测结果Fig 2 The expression of Ezrin protein in fresh tissue samples obtained from 16patients
2.3 细胞功能实验
2.3.1 胃癌细胞生长、增殖能力 将质粒转染至胃癌细胞MKN-45后,采用 Western-blot技术检测实验组(E-SH1、E-SH2)和对照组(E-control)基因敲除效率。实验组Ezrin蛋白表达明显低于对照组(图3)。采用MTT法测定胃癌细胞MKN-45生长曲线,观察细胞生长增殖能力,实验结果显示,Ezrin蛋白表达下调组细胞E-SH1和E-SH2的生长减慢,生长速率明显受到抑制,与E-control组细胞间差别显著(F=4.787,P=0.006),而E-SH1和E-SH2之间差别无统计学意义(P=0.956,图4)。
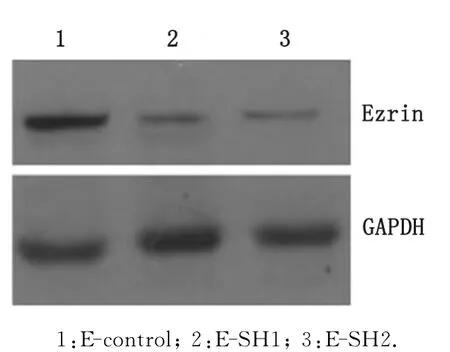
图3 实验组和对照组基因敲除效率比较Fig 3 Ezrin protein levels were decreased in target cells
2.3.2 胃癌细胞侵袭能力 采用Transwell侵袭小室实验测定胃癌细胞MKN-45侵袭能力,结果显示,与E-control相比,E-SH1和E-SH2细胞侵袭能力均明显降低(P<0.01);经过结晶紫染色,其24h穿过基质胶并贴于聚碳酸脂膜底面的细胞数分别为E-SH1(65±3.1)个/HP,E-SH2(60±2.6)个/HP和E-control(126±6.0)个/HP(图5,6)。相关(表1),而与患者的性别、年龄、肿瘤部位、肿瘤大小、Borrmann分型、组织学分型、肿瘤浸润深度、远处转移及TNM分期无显著相关性。
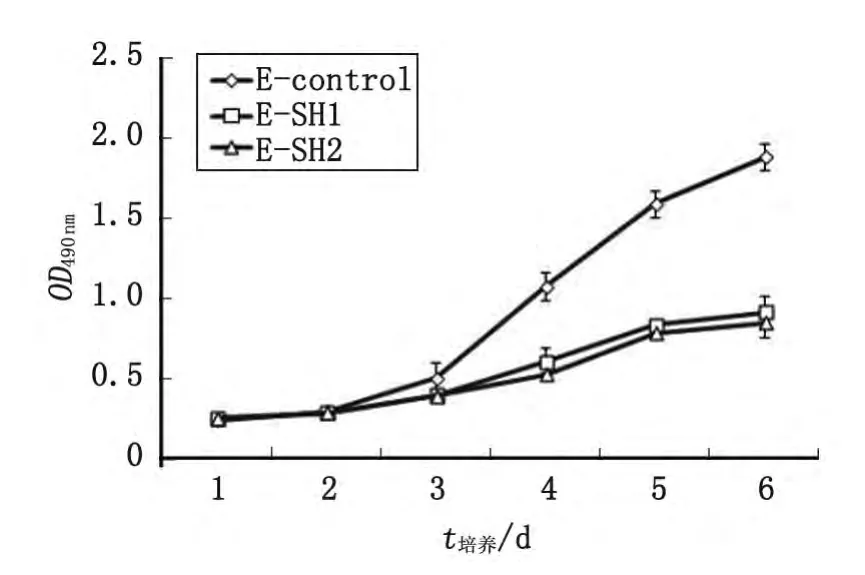
图4 Ezrin基因表达下调后对细胞增殖的影响Fig 4 The proliferation rates of the cell lineswere detected using a MTT assay
2.4 Ezrin蛋白表达与胃癌患者的临床病理参数及预后的关系
2.4.1 Ezrin蛋白表达与临床病理参数的关系206例中,Ezrin蛋白高表达与患者的淋巴结转移显著
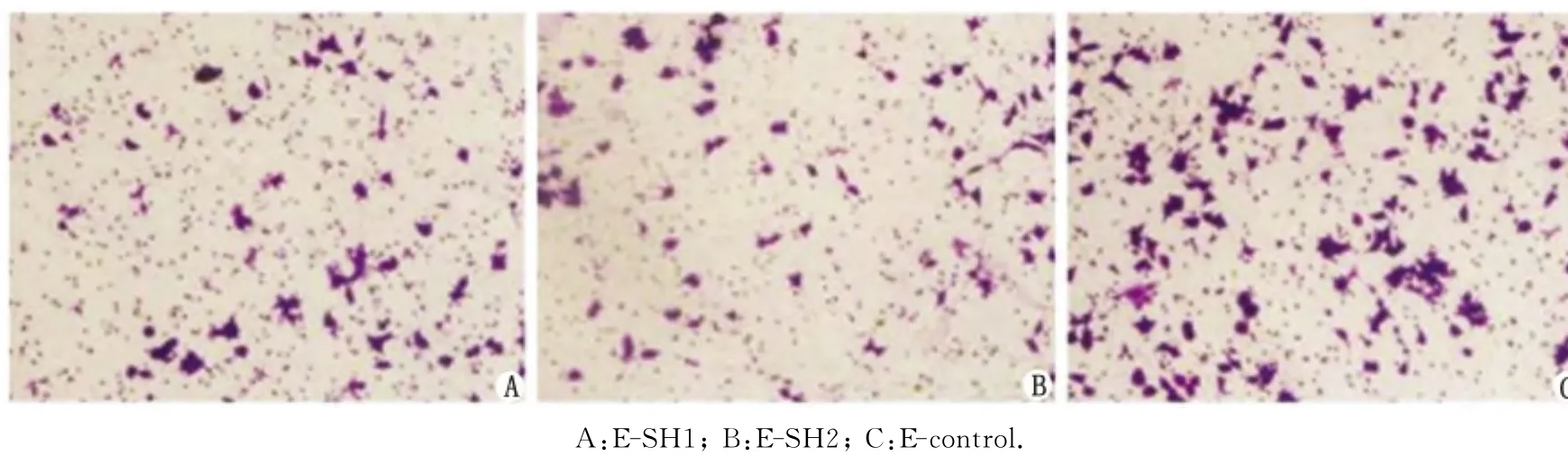
图5 Transwell侵袭小室实验测定各组细胞侵袭能力( ×400)Fig 5 Representative images of invasive cells on polycarbonate transwell membranes( ×400)
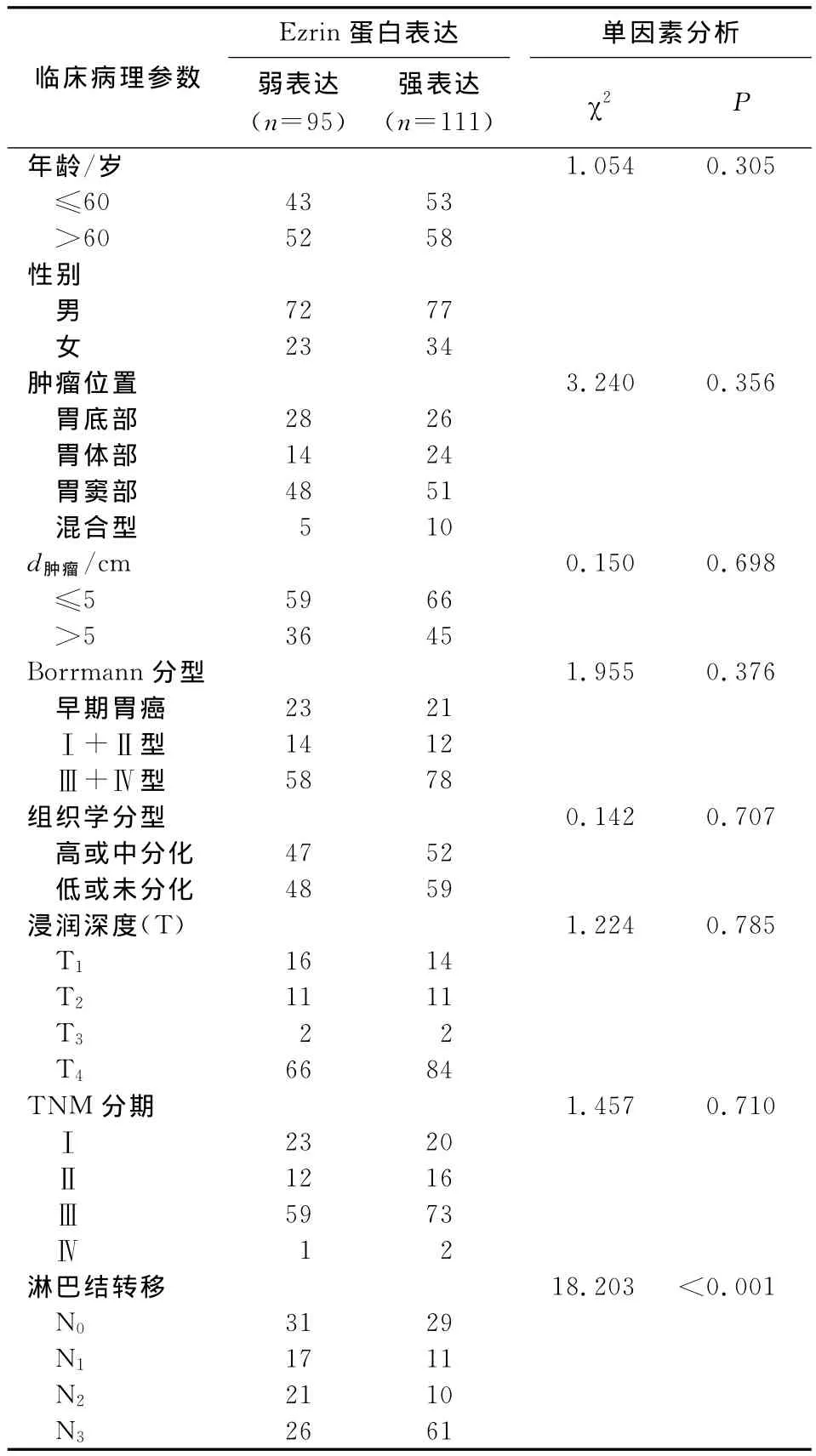
表1 胃癌组织中Ezrin表达水平与患者临床病理参数间的关系Tab 1 The relationship between clinicopathological parameters and Ezrin expression in gastric cancer
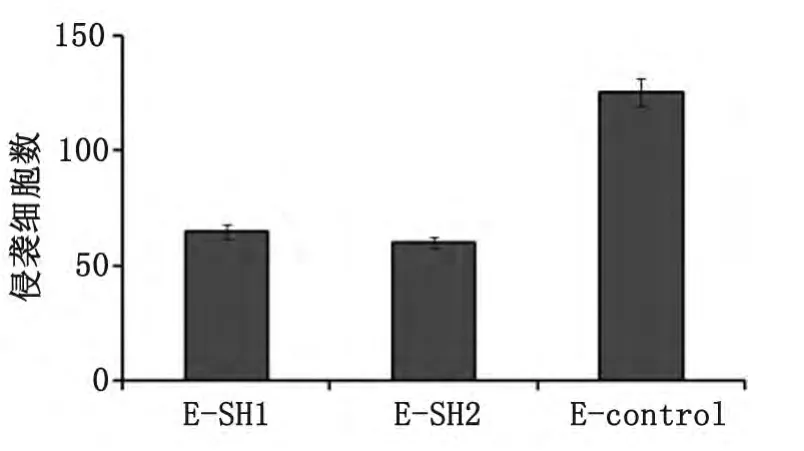
图6 Ezrin蛋白表达下调后对胃癌细胞侵袭力的影响Fig 6 The average number of invasive cells from three independent experiments are shown
2.4.2 影响患者生存的预后因素分析 预后因素分析发现,Ezrin蛋白的表达水平与患者预后密切相关(表2)。全组患者术后5年生存率为46.1%;Ezrin蛋白强阳性表达组的术后5年生存率明显低于弱阳性表达组(37.8%vs55.8%,P<0.05,图7)。
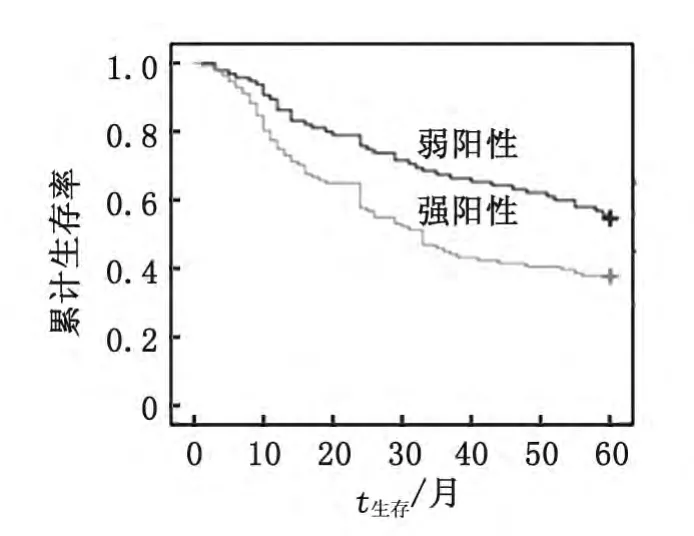
图7 Erzin蛋白表达水平与患者术后5年生存率之间的关系Fig 7 Impact of Ezrin on overall survival in gastric cancer
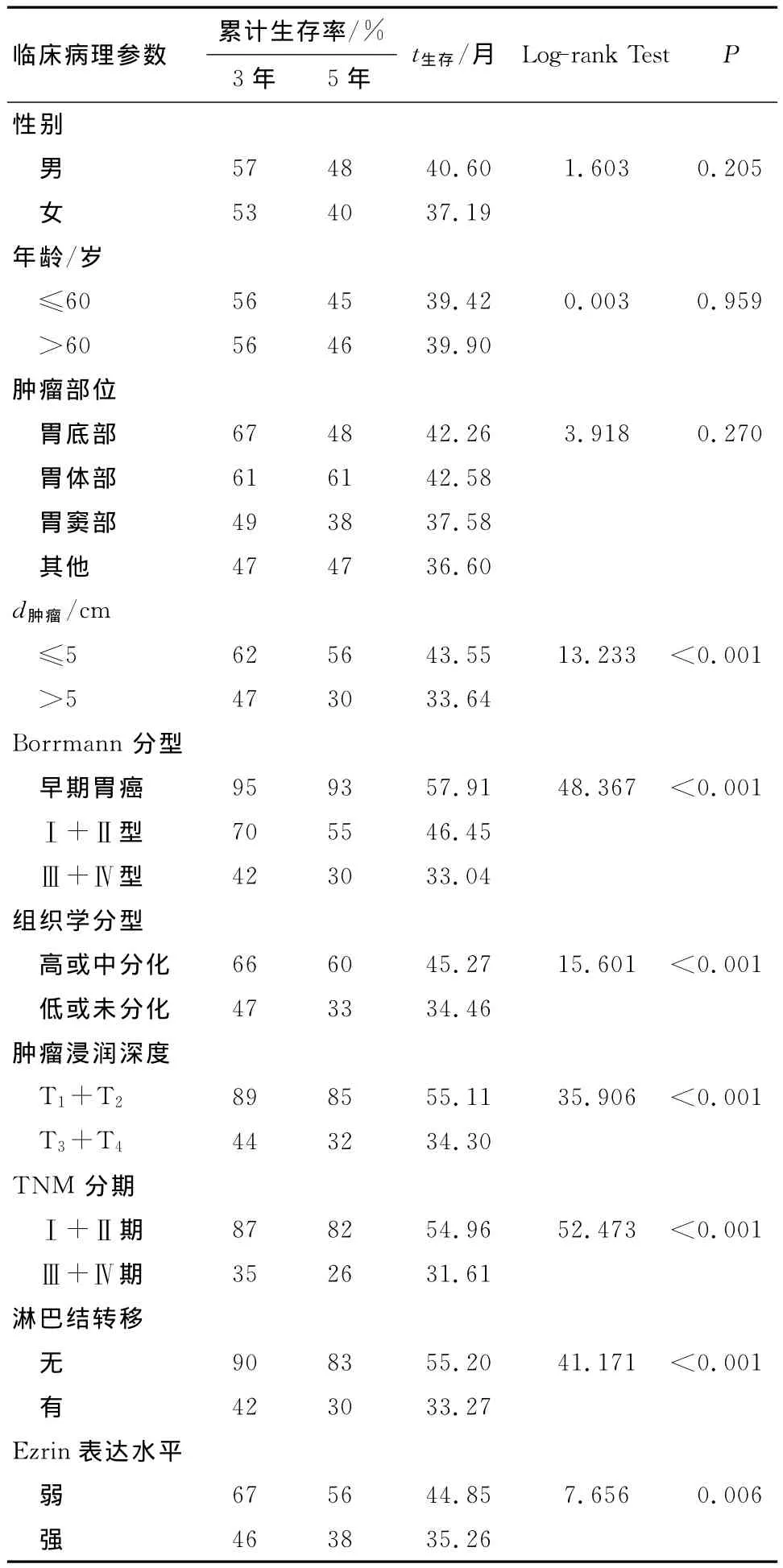
表2 影响胃癌患者生存期的单因素分析Tab 2 Univariate analysis by the Kaplan-Meier method of factors affecting overall survival
2.5 Ezrin蛋白对胃癌增殖侵袭机制
2.5.1 CD44v6在胃癌组织、癌旁组织中的表达CD44v6在胃癌组织中的表达主要定位于细胞膜和细胞质中。正常癌旁组织中CD44v6呈低表达,而在胃癌组织中呈高表达(图8)。
2.5.2 Ezrin蛋白与CD44v6在胃癌组织中表达的相关性 在胃癌组织中,Ezrin强阳性表达组CD44v6强阳性占68.5%,Ezrin弱阳性表达组CD44v6强阳性占42.1%,差别有统计学意义(P<0.001)。Spearman等级相关分析结果表明,两者表达呈显著正相关(R=0.265,P<0.001)。
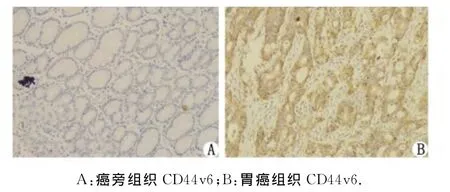
图8 CD44v6蛋白在癌旁组织、胃癌组织中的表达情况Fig 8 Representative CD44v6immunostaining in normal gastric tissues and primary gastric tumors from the same patient
3 讨 论
我国是胃癌高发地区,全球每年42%的胃癌新发病例在中国[1-2]。近年来,胃癌的发生率及死亡率在大多数国家均有不同程度的降低[7-8],但是与世界其他国家比较,我国胃癌死亡率仍高居首位[9]。因此,探讨胃癌的发病机制及预防措施仍是当前科学研究的重要任务。
近年来,Ezrin蛋白与人类恶性肿瘤的发生、增殖、侵袭、转移等方面的关系仍存在争议。Wennersten等的一项队列研究首次报道了Ezrin在泌尿系上皮肿瘤中的表达,结果显示Ezrin蛋白在复发肿瘤中的表达显著低于原发肿瘤,而Ezrin在胞膜和胞质的低表达与更差的肿瘤分期和分化程度密切相关[10]。然而,Jin等对150例非小细胞肺癌的研究表明,Ezrin蛋白高水平表达的患者淋巴结转移更多、肿瘤分期更晚,并认为Ezrin可能成为预测非小细胞肺癌预后的分子标志物[11]。Saito等的研究发现,Erzin蛋白在46.4%的舌鳞状细胞癌组织中高表达,可能通过 E-cadherin/β-catenin复合体促进舌鳞状细胞癌的生长、迁移和侵袭,有望成为舌鳞状细胞癌的新治疗靶点,是早期伴随淋巴结转移乳腺癌的预后因子[12]。本研究发现,Ezrin蛋白在胃癌原发灶组织中的强阳性表达率显著高于癌旁组织(P<0.05),在腹膜转移灶组织中的强阳性表达率显著高于原发灶癌组织(P<0.05)。此外,蛋白印迹也证实,Ezrin蛋白在胃癌组织中的相对强度明显高于其在癌旁组织中的表达(P=0.023 7)。通过绘制细胞生长曲线和测定细胞侵袭能力后发现,Ezrin蛋白表达下调组细胞的生长速率明显受到抑制且侵袭能力明显降低(P<0.001)。进一步对Ezrin蛋白的表达水平与患者临床病理学参数的分析发现,Ezrin蛋白强阳性表达组中的N3期患者比例显著增高(P<0.001)。这些结果提示,Ezrin蛋白可能是与胃癌生长、侵袭及转移相关的癌基因,其在胃癌组织中的高表达可能促进胃癌的侵袭和转移。
Ezrin蛋白对肿瘤患者预后的影响也逐渐被国内外学者所重视。瑞典的新近研究表明,Ezrin蛋白在胞膜和胞质的低表达与患者术后5年总体生存率密切相关,而胞膜低表达是影响患者预后的独立危险因素[10]。Jin等对108例非小细胞肺癌的分析发现,Ezrin蛋白高表达是影响Ⅰ~Ⅱ期非小细胞肺癌患者总体生存率的危险因素(P<0.05),但是对Ⅲ~Ⅳ期患者,Ezrin蛋白高表达组与低表达组的预后相当(P>0.05)[11]。本组研究的预后因素分析显示,除肿瘤大小、Borrmann分型、组织学分型、肿瘤浸润深度、淋巴结转移及TNM分期外,Ezrin蛋白的表达水平也与患者预后密切相关;Kaplan-Meier生存曲线显示,胃癌组织中Ezrin蛋白强阳性表达患者的术后5年生存率明显低于弱阳性表达的患者。这表明随着癌组织中Ezrin蛋白表达水平的降低,患者的5年生存率随之提高。推测Ezrin基因及其蛋白有可能成为诊断治疗胃癌患者的一个靶点。
关于Ezrin蛋白在胃癌中的作用机制,Wang等研究认为,Ezrin蛋白在肿瘤浸润、转移过程中的作用机制复杂,关于Ezrin蛋白在胃癌组织中表达的失衡是否涉及产物或通路间的相互作用及哪些产物或通路,远未被阐明[3]。CD44是第一个被发现与Ezrin共表达的黏附分子,CD44v6作为CD44的主要变异体,其胞质区能与Ezrin形成复合体,在很多高侵袭和转移活性的肿瘤细胞中都存在过量表达[13-14]。Hefler 等 的 研 究 显 示,Ezrin 可 以 与CD44v6结合后与细胞骨架连接,促进肿瘤细胞的增殖与转移,同时CD44v6表达上调,使功能性Ezrin表达增加,此时肿瘤增殖与侵袭能力也随之增加[15]。本研究显示,正常胃黏膜组织中CD44v6呈低表达,而在胃癌组织中呈高表达;而且,CD44v6在胃癌组织中表达与Ezrin蛋白呈显著正相关,提示胃癌组织中Ezrin蛋白的高表达可能需要CD44v6的参与。笔者推测,Ezrin蛋白可能通过CD44v6影响胃癌增殖及侵袭。在下一阶段的实验中,笔者将深入探讨两者的内在联系。
综上所述,Ezrin蛋白在胃癌组织中较癌旁组织表达明显上调,在腹膜转移灶组织较原发胃癌组织表达亦明显上调,且与肿瘤的淋巴结转移及患者的术后5年生存率显著相关。Ezrin蛋白改变胃癌生物学行为的机制可能与CD44v6的参与关系密切,但是具体的信号通路仍需后续研究继续探索。
[1]American Cancer Society.GlobalCancerFactsandFigures[M].2nd Edition.American Cancer Society Inc,2011:19-20.
[2]Ahmedin Jemal,Freddie Bray,Melissa M,etal.Global cancer statistics[J].CACancerJClin,2011,61:69-90.
[3]Wang H J,Zhu J S,Zhang O Z,etal.High level of ezrin expression in colorectal cancer tissues is chosely related to tumor nlalignancy[J].WrorldJGastroenterol,2009,15(16):2016-2019.
[4]Moilanen J,Lassus H,Leminen A,etal.Ezrin immunoreactivity in relation to survival in serous ovarian carcinoma patients[J].GynecolOncol,2003,90(2):273-281.
[5]Japanese Gastric Cancer Association.Japanese classification of gastric carcinoma:3rd English edition[J].GastricCancer,2011,14(2):101-112.
[6]Sobin L H,Gospodarowicz M K,Wittekind C.International Union Against Cancer(UICC)TNM classification of malignanttumours[M].7th Edition.New York:Wiley-Liss,2010:1-17.
[7]Crew K D,Neugut A I.Gastric cancer:descriptive epidemiology,risk factors,screening,and prevention[J].CancerEpidemiolBiomarkersPrev,2014,23(5):700-713.
[8]Ferlay J,Autier P,Boniol M,etal.Estimates of the cancer incidence and mortality in Europe in 2006 [J].AnnOncol,2007,18(3):581-592.
[9]Yang L.Incidence and mortality of gastric cancer in China[J].WorldJGastroenterol,2006,12(1):17-20.
[10]Wennersten C,Andersson G,Boman K,etal.Incident urothelial cancer in the Malm diet and cancer study:cohort characteristics and further validation of Ezrin as a prognostic biomarker[J].DiagnPathol,2014,9:189-198.
[11]Jin T F,Jin J C,Li X Y,etal.Prognostic implications of Ezrin and phosphorylated Ezrin expression in non-small cell lung cancer[J].BMCCancer,2014,14:191-198.
[12]Shota Saito,Hiroto Yamamoto,Kenichi Mukaisho,etal.Mechanisms underlying cancer progression caused by Ezrin overexpression in tongue squamous cell carcinoma[J].PLoS One,2013,8(1):e54881.
[13]Simona Donatello,Irina S,Babina,etal.Lipid raft association restricts CD44-Ezrin interaction and promotion of breast cancer cell migration[J].AmJPathol,2012,181(6):2172-2187.
[14]Orian-Rousseau V,Morrison H,Matzke A,etal.Hepatocyte growth factor induced Ras activation requires ERM proteins linked to both CD44v6and factin[J].MolBiolCell,2007,18(1):76-83.
[15]Hefler L A,Concin N,Mincham D,etal.The prognostic value of immunohistochernically detected CD44v3and CD44v6expression in patients with surgically staged vulvar carcinoma:a multicenter study [J].Cancer,2002,94:125-130.

