精神分裂症患者基底节功能连接的静息态fMRI研究
蒋宇超 陈 琳 段明君 陈 曦 杨 宓 邓佳燕 赖永秀 尧德中 罗 程
精神分裂症患者基底节功能连接的静息态fMRI研究
蒋宇超 陈 琳 段明君 陈 曦 杨 宓 邓佳燕 赖永秀 尧德中 罗 程
目的通过功能磁共振(fMRI)技术,探讨精神分裂症患者静息状态下与基底节异常连接的脑区。方法采用3.0T功能磁共振成像技术检测15例精神分裂症患者与12例正常对照组在静息状态下的全脑功能活动。采用功能连接分析对比两组被试的基底节(双侧尾状核、壳核和苍白球共6个区域)与全脑功能连接的差异。结果与对照组相比,精神分裂症患者的内侧额上回、后扣带与尾状核的功能连接上升;左侧额上回、右侧前扣带与左侧苍白球功能连接上升;左内侧额上回与右侧苍白球功能连接上升;左侧额上回与左侧壳核功能连接上升。差异均有统计学意义。结论精神分裂症患者的基底节区域与默认网络的重要节点功能连接上升,提示基底节-默认网络环路出现异常,这可能与精神分裂症的病理机制有关。
精神分裂症;基底节;默认网络;功能磁共振
精神分裂症是由一种以幻听、错觉和自我混乱等症状所组成的临床综合症,涉及感知觉、思维、情感和行为等多方面的障碍以及精神活动的不协调[1-2]。基底节接收来自不同大脑皮层的输入信息,并通过丘脑返回至皮层。该神经环路是基底节包括运动、认知控制、情绪加工等多种功能的神经基础[3]。目前,在精神分裂症中已经发现很多与基底节失调相关的症状,比如认知障碍、运动障碍、情感紊乱和紧张症[4]。这一现象暗示着基底节可能有助于理解精神分裂症的病理生理机制。近年来,有研究发现精神分裂症患者的基底节出现自发神经活动的改变[5]。还有研究发现精神分裂症患者的基底节出现结构体积改变[6-7]。
功能磁共振成像(functional magnetic resonance imaging,fMRI)通过探测神经元活动时局部脱氧血红蛋白相对含量的变化,即血氧水平依赖(blood oxygen level dependent,BOLD)信号的改变来推测大脑的神经活动。本研究旨在使用fMRI技术对比精神分裂症患者与正常对照组的基底节与全脑的功能连接情况,进而发现精神分裂症患者中与基底节异常连接的脑网络。
1 对象与方法
1.1 对象为2013年5月-2014年5月成都市精神卫生中心精神科的住院患者。均符合《精神障碍诊断与统计手册(第4版)》(Diagnostic and statistical Manual of Mental Disoders,Fourth edition,DSM-Ⅳ)精神分裂症诊断标准,均为慢性精神分裂症患者,并接受第二代抗精神病药物治疗。共15例精神分裂症患者和12名正常对照组入组。排除标准:有神经系统疾病史、脑外伤或物质滥用史,有磁共振扫描禁忌。所有被试均同意参加本研究并签署知情同意书。本研究获得成都市精神卫生中心伦理委员会批准。
1.2 数据采集和图像预处理磁共振图像采集使用电子科技大学(UESTC)GE 3.0T磁共振成像系统(GE DISCOVERY MR 750,USA),在标准的头线圈内完成扫描。采用平面回波成像(EPI)序列采集静息态功能图像。扫描参数:2000/30ms(TR/TE),90°翻转角,矩阵64×64,视野24cm×24cm,35层,层厚4mm,扫描时间8分30秒。整个扫描过程被试保持静息状态:闭上双眼,不要睡着,尽量不思考。
数据预处理首先采用MRIcro软件对图像数据进行格式转换,考虑到机器稳定性和被试适应环境,弃除前5个时间点。然后使用NIT软件(http:// www.neuro.uestc.edu.cn/NIT.html)对余下250个时间点的静息态数据进行预处理,步骤包括:时间校正,头动校正,空间标准化到标准EPI模板并重采样为3mm×3mm×3mm大小,以6mm全宽半高(full-width at half maximum,FWHM)进行高斯平滑。然后进行去线性漂移,回归6个头动参数、白质和脑脊液信号,以及滤波处理(0.01~0.08Hz),减少低频漂移并过滤高频的生理噪声。本研究中头动控制标准为平移<2mm及旋转角度<2°。
1.3 基于基底节网络的功能连接分析首先,采用AAL模板中的双侧尾状核、壳核和苍白球区域作为6个感兴趣区域(ROI),并分别提取出该ROI的平均时间序列与全脑所有体素计算皮尔逊相关系数,再对全脑功能连接的全脑图进行Fisher-z变换以增加其正态性。
1.4 统计方法采用SPSS19.0对被试一般资料和临床评估数据进行统计分析。组间年龄、受教育年限比较采用Mann-Whitney检验,性别比例比较采用χ2检验。为检测在静息状态下的精神分裂症患者和正常对照组基底节的功能连接的组间差异,将被试年龄、性别和受教育年限控制为协变量,对两组被试的基底节功能连接全脑图进行体素水平的独立样本t检验。当每个体素的P<0.005并且团块体积>702mm3(即大于26个体素)时,认为差异有统计学意义(P<0.05,AlphaSim校正)。
2 结果
2.1 两组一般资料比较精神分裂症组男性12例,女性3例;年龄(49.6±3.1)岁,受教育年限(12.3±2.7)年,病程(22.4±7.6)年;正常对照组男性9名,女性3名;年龄(47.9±5.2)岁,受教育年限(9.3±2.4)年。除受教育年限外,两组年龄、性别差异均无统计学意义(P>0.05)。精神分裂症组阳性和阴性症状量表(Positive and Negative Syndrome Scale,PANSS)总评分为(59.4±10.9)分,阳性症状、阴性症状和一般精神病理评分分别为(9.9 ±3.2)分、(23.1±7.3)分、(26.4±3.2)分。
2.2 功能连接分析基于基底节的功能连接分析显示,相较于正常对照组,精神分裂症患者的内侧额上回、后扣带与尾状核的功能连接上升;左侧额上回、右侧前扣带与左侧苍白球功能连接上升;左内侧额上回与右侧苍白球功能连接上升;左侧额上回与左侧壳核功能连接上升。差异均有统计学意义(P<0.05)。未发现功能连接下降的脑区。见表1、图1。

表1 精神分裂症患者较对照组与基底节功能连接升高的脑区
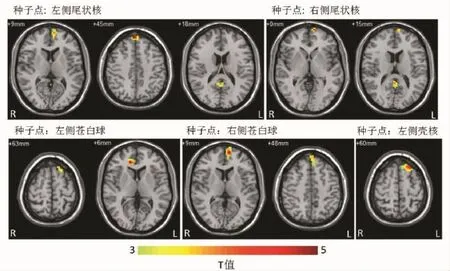
图1 精神分裂症患者较对照组与基底节功能连接升高的脑区
3 讨论
本研究选取基底节区域的双侧尾状核、壳核和苍白球共6个作为感兴趣区域,计算其与全脑的功能连接,并比较精神分裂症患者与正常对照组功能连接的差异。结果表明:在静息状态下,精神分裂症患者的额上回、前后扣带等区域与基底节功能连接上升。提示该脑网络可能存在功能异常。
内侧额上回以及前后扣带均属于默认网络。默认网络学说是Raichle等[8]于2001年提出的一个假说,认为大脑在无任务的清醒、静息状态下就存在有组织的脑活动,其主要区域包括前额叶内侧皮层、后扣带以及邻近的楔前叶和角回等脑区。在静息状态时,楔前叶与后扣带在调节默认网络内在活动中起重要作用,这与其“自参考”相关的内在思考过程中维持自我意识功能一致[9]。研究表明,后扣带与其邻近的楔前叶负责不断从个体自身和周围世界收集信息,并对这些信息进行分配处理。已有研究表明,默认网络异常与精神分裂症的病理生理有关:基于种子点相关分析表明精神分裂症患者楔前叶/后扣带内在fMRI信号振荡发生改变[10],显示精神分裂症患者默认网络内部连接存在异常[11]。总体而言,目前研究表明精神分裂症的内源性紊乱与默认网络的异常有关。
近年来,已有文章报道发现纹状体-默认网络环路的存在[12-13],Orliac等[14]发现精神分裂症患者的纹状体与默认网络的功能连接异常,也有研究发现精神分裂症患者左侧壳核和右侧楔前叶的有效连接降低[15],这些结果表明默认网络的抑制可能源于纹状体的抑制性调控,进而导致默认网络对纹状体反馈降低,从而导致纹状体-默认网络环路的异常。此外,基底节网络在决策控制,工作记忆和奖励加工过程起到重要作用[16-17]。精神分裂症患者的基底节与默认网络的异常连接也提示其认知-情感控制的调节和内外信息处理加工存在缺陷。
本研究对基底节进行了功能连接分析,发现精神分裂症患者与正常人相比,内侧额上回、前后扣带等区域与基底节的功能连接上升,这一异常改变可能与精神分裂症的病理机制相关。
[1]何红波.精神卫生服务之精神分裂症临床综合研究述评[J].四川精神卫生,2015,28(4):289-291.
[2]李元,刘文,隋毓秀,等.首发精神分裂症胼胝体的磁共振弥散张量研究[J].四川精神卫生,2008,21(2):69-72.
[3]Cropley VL,Fujita M,Innis RB,et al.Molecular imaging of the dopaminergic system and its association with human cognitive function[J].Biol Psychiatry,2006,59(10):898-907.
[4]Zampieri E,Bellani M,Crespo-Facorro B,et al.Basal ganglia anatomy and schizophrenia:the role of antipsychotic treatment[J].Epidemiol Psychiatr Sci,2014,23(4):333-336.
[5]Duan M,Chen X,He H,et al.Altered basal ganglia network integration in schizophrenia[J].Front Hum Neurosci,2015,9:561.
[6]Mamah D,Wang L,Barch D,et al.Structural analysis of the basal ganglia in schizophrenia[J].Schizophr Res,2007,89 (1-3):59-71.
[7]Glenthoj A,Glenthoj BY,Mackeprang T,et al.Basal ganglia volumes in drug-naive first-episode schizophrenia patients before and after short-term treatment with either a typical or an atypical antipsychotic drug[J].Psychiatry Resh,2007,154(3):199-208.
[8]Raichle ME,MacLeod AM,Snyder AZ,et al.A default mode of brain function[J].P Natl Acad Sci USA,2001,98(2):676-682.
[9]Gusnard DA,Akbudak E,Shulman GL,et al.Medial prefrontal cortex and self-referential mental activity:relation to a default mode of brain function[J].Proc Natl Acad Sci USA,2001,98 (7):4259-4264.
[10]Bluhm RL,Miller J,Lanius RA,et al.Spontaneous low-frequency fluctuations in the BOLD signal in schizophrenic patients: anomalies in the default network[J].Schizophr Bull,2007,33 (4):1004-1012.
[11]Whitfield-Gabrieli S,Thermenos HW,Milanovic S,et al.Hyperactivity and hyperconnectivity of the default network in schizophrenia and in first-degree relatives of persons with schizophrenia[J].Proc Natl Acad Sci U S A,2009,106(4):1279-1284.
[12]Braskie MN,Landau SM,Wilcox CE,et al.Correlations of striatal dopamine synthesis with default network deactivations during working memory in younger adults[J].Hum Brain Mapp,2011,32 (6):947-961.
[13]Lim SL,O'Doherty JP,Rangel A.The decision value computations in the vmPFC and striatum use a relative value code that is guided by visual attention[J].J Neurosci,2011,31(37):13214-13223.
[14]Orliac F,Naveau M,Joliot M,et al.Links among resting-state default-mode network,salience network,and symptomatology in schizophrenia[J].Schizophr Res,2013,148(1-3):74-80.
[15]Wang X,Li F,Zheng H,et al.Breakdown of the striatal-default mode network loop in schizophrenia[J].Schizophr Res,2015,168 (1-2):366-372.
[16]Graybiel AM.Habits,rituals,and the evaluative brain[J].Annu Rev Neurosci,2008,31:359-387.
[17]Northoff G,Hayes DJ.Is our self nothing but reward?[J].Biol Psychiatry,2011,69(11):1019-1025.
Resting-state functional magnetic resonance imaging study of functional connectivity of basal ganglia in schizophrenia
JIANG Yu-chao1,CHEN Lin1,DUAN Ming-jun1,3,CHEN Xi2,YANG Mi1,4,DENG Jia-yan2,LAI Yong-xiu1,YAO De-zhong1,2,LUO Cheng1,21Key Laboratory for NeuroInformation of Ministry of Education,School of Life Science and Technology,University of Electronic Science and Technology of China,Chengdu610054,China
2Center for Information in Medicine,International Joint Research Center for neuroInformation(Ministry of Science and Technology of China),University of Electronic Science and Technology of China,Chengdu610054,China
3Department of Psychiatry,The Fourth People's Hospital of Chengdu,Chengdu610036,China
4Department of stomatology,The Fourth People's Hospital of Chengdu,Chengdu610036,China
*
ObjectiveTo explore the difference of functional connectivity of basal ganglia in schizophrenia during a resting state by functional magnetic resoncance imaging(fMRI).Methods3.0T fMRI was used to assess the whole brain activity of 15 schizophrenia patients and 12 health controls.Functional connectivity analysis based on basal ganglia was performed to obtain the significant difference between two groups.ResultsCompared with the health controls,the patients showed significantly increased functional connectivity between media superior frontal gyrus,posterior cingulate and caudate;increased functional connectivity between left superior frontal gyrus,right anterior cingulate and left pallidum;increased functional connectivity between left medial frontal gyrus and right pallidum; increased functional connectivity between left superior frontal gyrus and left putamen.ConclusionThis study discovers increased functional connectivity between basal ganglia and crucial regions of Default Model Network(DMN).The results imply that basal ganglia-DMN loop altered aberrantly,which might be associated with the pathological mechanisms of schizophrenia.
Schizophrneia;Basal ganglia;Default Model Network(DMN);Functional magnetic resoncance imaging(fMRI)
R749.3
A
10.11886/j.issn.1007-3256.2015.06.002
2015-12-07)
国家自然科学基金(81471638,81571759)
610054成都,电子科技大学生命科学与技术学院,神经信息教育部重点实验室(蒋宇超,陈琳,段明君,杨宓,赖永秀,尧德中,罗程);610054成都,电子科技大学信息医学研究中心,神经信息国际联合研究中心(科技部)(陈曦,邓佳燕,尧德中,罗程);610036成都市第四人民医院精神科(段明君); 610036成都市第四人民医院口腔科(杨宓)
罗程,E-mail:chengluo@uestc.edu.cn

