叶酸修饰四代聚酰胺-胺型枝状聚合物纳米粒靶向肝癌细胞HepG2的研究1
刘碧英
(长沙卫生职业学院 湖南长沙 410100)
生物可降解材料作为基因和药物载体,是肿瘤靶向治疗研究的热点。本实验室制备的四代聚酰胺-胺型枝状聚合物型纳米粒(polyamidoamine,PAMAM)具有良好的生物相容性和生物可降解性。PAMAM能够防止其被网状内皮系统清除,提高生物相容性,延长其在体内的分布时间[1]。采用PAMAM制备包载药物或基因的纳米粒(nanoparticles,NPs)可以用于肿瘤的靶向治疗[2]。叶酸受体是一种糖基化磷脂酰肌醇连接的膜糖蛋白,可以介导细胞内吞,将叶酸摄入胞浆的一种高亲和力受体,在某些肿瘤细表面高度表达,而正常组织没有或很少表达,因而具良好的肿瘤组特异性[3-4]。叶酸分子量小,与叶酸受体具有很强的亲和力,属于机体的内源性物质,没有免疫原性,因此广泛的应用于抗肿瘤药物和纳米载体靶向传递[5-6]。我们采用FA对PAMAM进行修饰并制备了带FA单克隆抗体的PAMAM,作为肝癌靶向治疗的药物递送载体。本研究通过对肝癌细胞HepG2的体外与体内实验,初探FA-PAMAM对肝癌的靶向效果,为肝癌的靶向递送系统构建提供初步的实验基础。
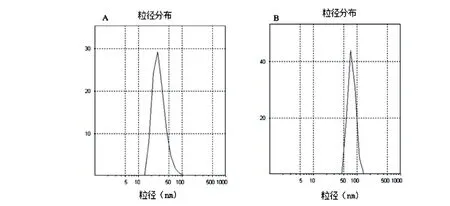
图1 PAMAMNPs和PAMAM-FANPs的粒径A:PAMAMNPs;B:PAMAM-FANPs.
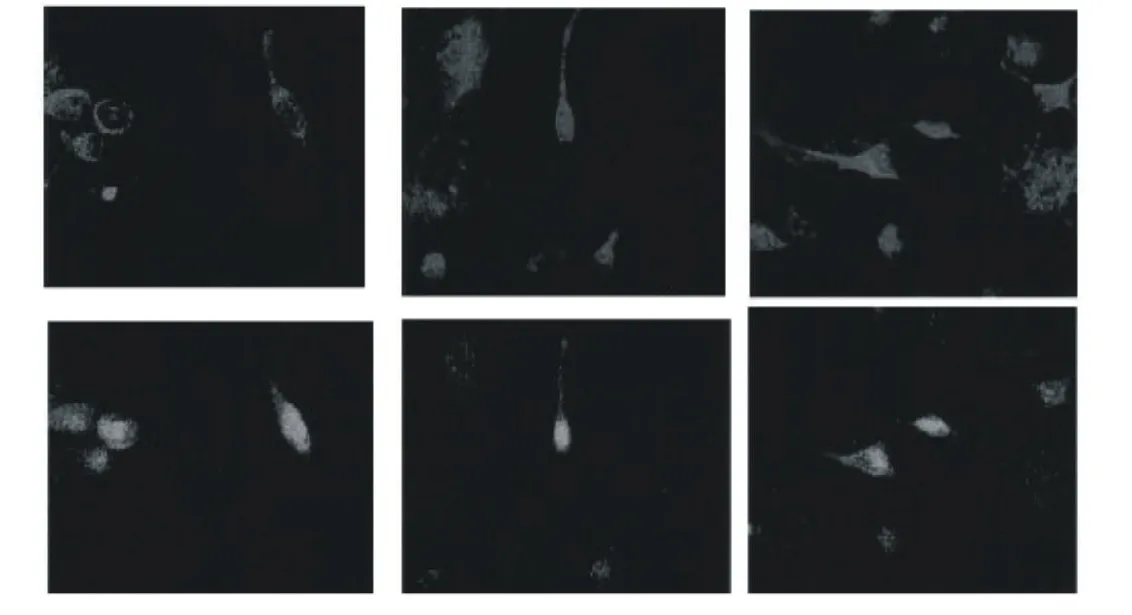
图3 HepG2细胞体外摄取PAMAM-FANPs的荧光显微镜和激光共聚焦断层扫描图片
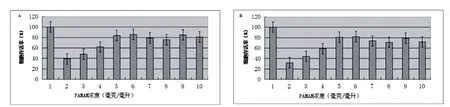
图2 MTT法检测PAMAMNPs和PAMAM-FANPs对HepG2细胞生存影响A:PAMAMNPs;B:PAMAM-FANPs.细胞存活率(%)
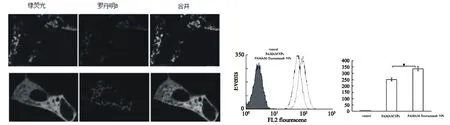
图4 HepG2细胞摄取PAMAMNPs和PAMAM-FANPs定性、定量比较
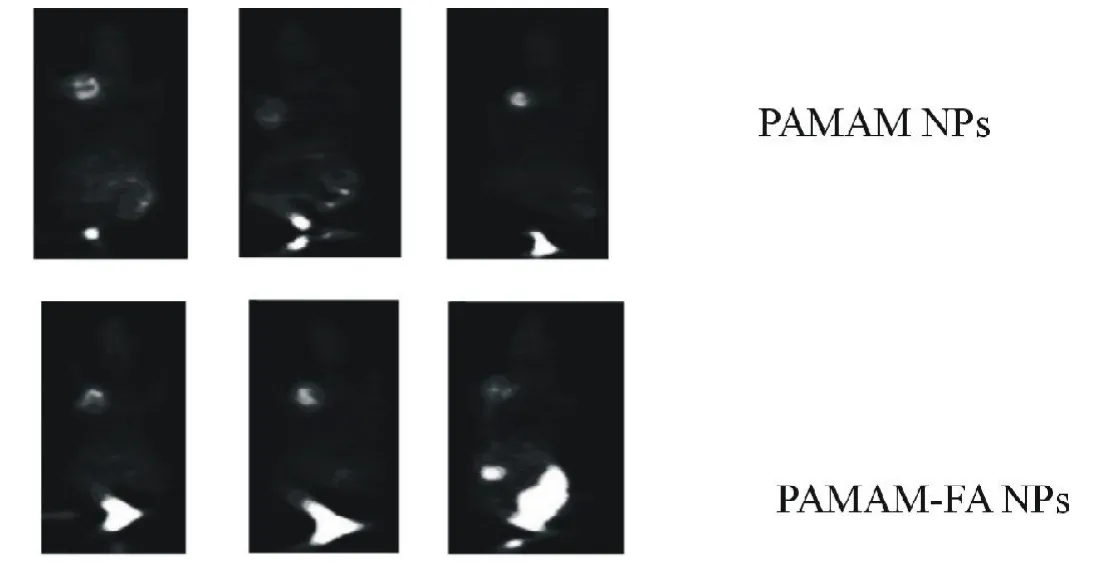
图5 PAMAMNPs和PAMAM-FANPs在荷HepG2瘤裸鼠体内在4、24和48小时分布情况
1 材料和方法
1.1 材料
肝癌细胞HepG2购自中国科学院上海分院细胞库;罗丹明B(RhodmaineB,RB)、Cy5、四甲基偶氮唑蓝(MTT)购自美国Sigma公司;PluronicF68(F68)购自德国BASF公司;其他试剂购自国药集团;BALB/c(nu/nu)雌性裸鼠购自上海市肿瘤研究所动物实验中心;实验仪器包括离心机(AnkeTGL-16B)、Zeta电位粒径分析仪(ZetasizerNanoZS)、荧光显微镜成像系统(OlympusIX51)、激光共聚焦成像系统(OlympusFV1000)、FACSCALIBUR流式细胞仪和CRIMaestroTM活体成像系统等。
1.2 NPs制备与表征
称取PAMAM0.1g、TEA0.0245g溶于90ml无水甲醇中,丁二酸酐9.1mg溶于6ml无水甲醇中,逐滴加入前一溶液里,室温搅拌24h。旋转蒸发甲醇,剩余物溶于水中进行透析,透析液冷冻干燥处理。称取PAMAM-丁二酸酐12.758mg、EDC2.04mg溶于4ml水中反应3h。称取FA9.2mg,溶于lmlDMSO中,逐滴加入到前一溶液里,搅拌过夜。样品进行透析和冷干处理,即得PAMAM-FA纳米粒。 称取PAMAM-FA4mg,充分溶于200μL二氯甲烷,加入2mg/mLRB溶液20μL,超声强度300W,超声时间每次为10s,共5次,再加入2mLF68(1%)溶液,超声强度300W,时间设为每次为10s,共7次,最后真空旋蒸除去二氯甲烷,即得RB标记的PAMAM-FANPs,以相同方法制备PAMAMNPs。取适量PAMAMNPs和PAMAM-FANPs测定其粒径和表面电位。
1.3 HepG2细胞摄取NPs的浓度
将HepG2细胞在含10%的胎牛血清(法国Biowest公司)和1%的青霉素/链霉素的高糖DMEM培养液(法国Biowest公司)中,置于CO2体积分数为5%的37℃细胞培养箱内培养。取Huh7细胞铺96孔板,每孔100μL,细胞密度为5×104/mL,进行细胞培养待贴壁。取制备的PAMAMNPs和PAMAM-FANPs分别加入孔中,NPs的终浓度分别为:0.005、0.01、0.02、0.05、0.1、0.2、0.5、1和2mg/mL,另设调零组及空白对照组。HepG2与NPs共温育24h后,加入MTT(5mg/mL)溶液20μL,继续培养4h,吸取培养液,加DMSO100μL溶解后,在酶标仪490nm处检测吸光度值(A)。记录数值,按照存活率公式[存活率=(A实验孔-A调零孔)/(A空白对照组-A调零孔)]计算细胞的存活率,每个实验条件设置5个复孔。
1.4 HepG2细胞摄取PAMAM-FANPs的观察
取HepG2细胞辅在培养皿中,加入细胞0.5mL,细胞数5×103个,设3个复孔,进行细胞培养待贴壁。将培养液置换成含有0.2mg/mLRB标记的PAMAM-FANPs的培养液,共温育3h,除去培养液,用PBS充分洗涤3次,然后加入4%多聚甲醛固定30min,再用PBS洗涤3次。用激光共聚焦断层扫描技术检测Huh7细胞内RB标记的PAMAM-FANPs的分布情况(RB的激发光波长为540nm,发射光波长为625nm)。
1.5 HepG2细胞对NPs摄取的定量分析
取HepG2细胞铺24孔板和6孔板,细胞数分别为5×103和1×105个,各设3复孔,进行细胞培养待贴壁。24孔板与6孔板中分别用含有0.2mg/mLRB标记的PAMAMNPs或PAMAM-FANPs培养液置换原培养液,共温育2h,然后PBS洗涤3次,24孔板用荧光显微镜观察,定性比较HepG2细胞对PAMAMNPs与PAMAM-FANPs摄取的差异。6孔板细胞洗涤3次后加入1mL0.25%的胰酶消化,2000r/min离心3min,去上清液,加入200μLPBS混悬细胞,用流式细胞计数仪定量检测HepG2细胞对PAMAMNPs和PAMAM-FANPs的摄取情况。
1.6 NPs在荷HepG2瘤裸鼠的体内分布研究
用Cy5分别标记PAMAMNPs和PAMAM-FANPs,取荷HepG2皮下瘤的裸鼠18只,随机分成PAMAMNPs和PAMAM-FANPs组,每组9只裸鼠,尾静脉注射NPs0.2mL。分别在尾静脉注射后4、24和48h后处死裸鼠,取其心、肝、脾、肺、肾和肿瘤组织,于活体成像仪上观察Cy5标记的PAMAMNPs和PAMAM-FANPs的体内分布情况。Cy5的激发波长为649nm,发射波长为666nm。
1.7 统计学分析
实验数据以均数±标准差表示,组间以t检验比较。应用SPSS18.0软件包进行相关统计学处理,以P<0.05为差异有统计学意义。
2 结果
2.1 NPs粒径和电位分布
采用旋转蒸发法制备PAMAMNPs和PAMAM-FANPs,PAMAMNPs的粒径为(147±18.2)nm,PAMAM-FA的粒径为(151±17.4)nm(图1),所制备的NPs均一性较好。PAMAMNPs和PAMAM-FANPs的Zeta电位分别为(34.9±6.2)mV和(36.4±7.4)mV。
2.2 HepG2细胞摄取NPs的浓度确定
如图2所示,MTT法检测显示,HepG2细胞在PAMAMNPs和PAMAM-FANPs的浓度<0.2mg/mL时的细胞存活率在83%以上,细胞生存状况良好,随着NPs浓度的增加细胞的生存率不断下降,当NPs的浓度在2mg/mL时,HepG2的存活率只有38%。细胞的生存状况对细胞摄取NPs有重要的意义,NPs的浓度对细胞的生存影响小,可以降低由于其毒性而影响细胞摄取。
2.3 HepG2细胞摄取PAMAM-FANPs的观察
图3为激光共聚焦断层扫描,固定X、Y坐标,沿Z轴扫描,扫描始于25.83μm即荧光最弱的细胞表面,扫描深度为6μm。通过观察荧光强度来判断细胞内NPs的量,随着扫描深度的增加,断层面的荧光强度增加,当扫描深度在5μm左右的胞内时荧光强度最强。通过断层扫描证明PAMAMNPs能被HepG2细胞摄取,且主要分布于细胞质中,细胞核中未观察到有明显的分布。
2.4 HepG2细胞摄取NPs的定性与定量比较
HepG2细胞分别与PAMAMNPs和PAMAM-FANPs共温育2h后,在荧光显微镜下可以明显地看出:HepG2对PAMAM-FANPs的摄取要多于PAMAMNPs;通过流式细胞仪定量检测,进一步表明HepG2细胞对AMAM-FANPs的摄取要多于PAMAMNPs(P<0.05,图4)。绿荧光罗丹明B合并
2.5 NPs在荷HepG2瘤裸鼠的体内分布研究
如图5所示,采用Cy5标记PAMAMNPs和PAMAM-FANPs可以显示NPs在体内的分布情况,荧光强度越高所呈现的颜色越红,表明组织摄取的NPs越多。在4h时PAMAMNPs和PAMAM-FANPs在裸鼠体内的分布相差无几,在肿瘤和结肠部的分布都较多。但随着时间的延长,PAMAM-FANPs在肿瘤中的分布呈持续高荧光强度状态,其他脏器则呈下降趋势,而PAMAMNPs在各脏器分布则呈现再分布的状况,在其他脏器如肺中不断增加。
3 讨论
肝癌靶向给药要求药物有效地递送到达结肠,减少药物的不良反应。纳米递送靶向肝癌的研究是当今的一个热点,各种靶向材料也是层出不穷,其中研究较多的有壳聚糖[7]、脂质体[8]、阳离子聚合物[9]等。本研究制备了PAMAM-FA,其上的PAMAM具有很好的生物相容性,可以降低网状内皮系统的吞噬,从而延长其在体内的分布时间[1],PAMAM是被美国FDA批准应用于人体,已广泛应用于药物缓控释系统和NPs的制备。PAMAM也因其良好的生物相容性被广泛研究,所以本材料具有很好的应用前景。
叶酸是1种小分子维生素,其受体在许多肿瘤细胞中随度表达,而在正常细胞中表达弱或不表达[12]。因则,将叶酸连接到聚合物纳米胶束表面,可赋予纳米胶束对肿瘤细胞的主动靶向性,可提高药物在肿瘤组织中的浓度并降低其在正常组织中的浓度,减轻不良反应。
本研究采用采用复乳法制备PAMAM-FA,其粒径在150nm左右,Zeta电位在+35mV左右,其较高的正电位易与表面为负电位的细胞膜结合,有利于其摄取。通过MTT实验确定了对HepG2细胞较小毒性浓度为0.2mg/mL,在细胞摄取实验研究中皆采用此浓度的NPs。HepG2细胞对PAMAM-FANPs有较好的摄取能力,应用荧光显微镜可以观察到,经过3h的摄取,HepG2细胞中有较多的罗丹明B标记的NPs,而激光共聚焦断层扫描进一步显示PAMAM-FANPs在HepG2细胞中的分布情况,表明NPs为细胞所摄取,而非黏附其表面,PAMAM-FANPs要多于PAMAMNPs,流式细胞术进一步证明PAMAM-FANPs对HepG2具有良好的靶向效果。本研究开展荷HepG2瘤裸鼠的体内分布实验,PAMAMNPs最初在肿瘤中分布较多,可能与肿瘤通透性增强与滞留(enhancedpermeabilityandrete ntion,EPR)效应[13]有关,PAMAM-FANPs在较短的时间内未展现出更好的靶向性,但随着时间的延长,体内的NPs不断的重新分布,FA的靶向效果不断的呈现,PAMAM-FANPs在肿瘤的分布一直处于较高的状态,在其他的脏器则分布越来越少,而PAMAMNPs的分布随时间的增加在体内的分布则没有明显的靶向效果。
本研究是对PAMAM-FA靶向肝癌的初步研究,为肝癌靶向纳米递送系统的构建提供初步的依据。
[1]黄英男,吴昊,沈锡中.叶酸受体在肿瘤靶向诊断和治疗中的应用[J].复旦学报:医学版,2012,39(1):74-79.
[2]郭林峰,蒋宗林,李东红.叶酸受体介导靶向药物载体的研究进展[J].现代肿瘤医学,2013,21(5):1128-1131.[3]
[3]高海翟,包金,黄晶.叶酸和维生素B12与肿瘤关系的研究进展[J].广东医学,2014,35(10):1620-1621.