遗传控制技术在实蝇类害虫中的研究进展
武 强, 吕志创, 张桂芬, 严 盈,2,3, 刘桂清,4, 李建伟, 王玉生, 蔡玉音, 万方浩,5*
1中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京100193; 2 Department of
Entomology, North Carolina State University, Campus Box 7613, Raleigh, NC 27695-7613, USA;
3Genetic Engineering and Society Center and W.M. Keck Center for Behavioral Biology, North
Carolina State University, Raleigh, NC 27695-7613, USA; 4广东省昆虫研究所,
广东 广州 510260; 5青岛农业大学农学与植物保护学院,山东 青岛 266109
遗传控制技术在实蝇类害虫中的研究进展
武强1, 吕志创1, 张桂芬1, 严盈1,2,3, 刘桂清1,4, 李建伟1, 王玉生1, 蔡玉音1, 万方浩1,5*
1中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京100193;2Department of
Entomology, North Carolina State University, Campus Box 7613, Raleigh, NC 27695-7613, USA;
3Genetic Engineering and Society Center and W.M. Keck Center for Behavioral Biology, North
Carolina State University, Raleigh, NC 27695-7613, USA;4广东省昆虫研究所,
广东 广州 510260;5青岛农业大学农学与植物保护学院,山东 青岛 266109
摘要:实蝇类害虫严重危害多种水果和蔬菜,是世界果蔬产业最重要的害虫类群之一,严重影响了发生地的果蔬生产和出口贸易活动。昆虫不育技术(SIT)是一种物种特异和环境友好型防治措施,在多种实蝇类害虫的防治、阻截和根除中起到了不可替代的重要作用。通过分子生物学技术对昆虫的基因组进行遗传修饰,可对SIT进行改进,提高其防控效果并扩大应用的物种范围,近年来相关方面的研究已取得重要进展,成为害虫遗传控制的研究热点。本文阐述了通过受四环素调控的tet-off基因表达系统来实现昆虫“不育”的基本原理和在果蝇及其他几种主要实蝇类害虫中建立的不同类型的遗传控制体系,以及类似体系在其他农业昆虫中的应用情况。简要介绍了在橘小实蝇遗传控制技术体系构建方面的工作进展,并对该技术的在害虫综合治理(IPM)尤其是实蝇类害虫防治中的应用前景进行了讨论和展望。
关键词:遗传控制; 实蝇; 昆虫不育技术; tet-off基因表达系统; 致死品系
Genetic engineering approaches for the improvement
of sterile insect technique (SIT) on fruit flies
Qiang WU1, Zhi-chuang LÜ1, Gui-fen ZHANG1, Ying YAN1,2,3, Gui-qing LIU1,4,
Jian-wei LI1, Yu-sheng WANG1,Yu-yin CAI1, Fang-hao WAN1,5*
1StateKeyLaboratoryforBiologyofPlantDiseasesandInsectPests,InstituteofPlantProtection,ChineseAcademyofAgricultural
实蝇类害虫属双翅目Diptera实蝇科Tephritidae,遍布全球热带、亚热带和温带地区,种类繁多,寄主范围广且危害严重。成虫于寄主植物果皮下产卵,幼虫在果实内取食为害,致使被害果实腐烂、脱落,该虫极易随果蔬、花卉等的贸易活动传播(Hardy,1969; Lysandrou,2009; White & Elson-Harris,1992)。目前已记录的实蝇类昆虫超过500属4500余种,其中250 余种具有经济意义(李志红等,2013)。具经济重要性的实蝇主要分为5个类群:按实蝇属AnastrephaSchiner、腊实蝇属CeratitisMacleay、绕实蝇属RhagoletisLoew、离腹寡毛实蝇属BactroceraMacqart和合腹寡毛实蝇属DacusFabricius(严盈等,2009)。随着国际贸易活动的日趋频繁与复杂化,实蝇类害虫传播和扩散的机率也增加,成为世界果蔬进出口贸易中的重要检疫问题。
通过昆虫不育技术(Sterile insect technique,SIT) (Klassen & Curtis,2005; Knipling,1955)与灭雄技术(Male annihilation technique,MAT) (Allwoodetal.,2002; Cunningham,1989)相结合,可有效防控和阻截多种实蝇类害虫和鳞翅目害虫,并逐步发展形成以昆虫不育技术为核心的大区域综合治理策略(Area-wide integrated pest management approach,AW-IPM)防控体系(Klassen,2005; Vargasetal.,2010)。然而,传统的将昆虫进行辐射后标记释放的技术存在交配竞争力降低、荧光粉标记易混淆等缺陷,同时,雌雄混合释放会大大降低防治效果,而用于雄虫筛选的遗传性别品系(Genetic sexing strain,GSS)在新物种中的构建较为困难,阻碍了SIT在更多物种中的推广应用(Morrisonetal.,2010; Scolarietal.,2008)。通过遗传修饰对昆虫基因组进行编辑而实现昆虫不育的技术,能够克服传统SIT的缺陷,从而达到更高效和稳定的防控效果。
近年来,害虫遗传控制技术的相关研究取得了一系列重要进展,本文着重阐述了基于四环素调控tet-off基因表达系统的遗传不育体系的基本原理和其在果蝇和部分实蝇类害虫中的研究进展,以及相似体系在其他农业昆虫中的应用情况。
1 通过tet-off系统实现昆虫遗传控制的基本原理
利用转基因技术达到使昆虫“不育”的目的,主要是通过与受四环素调控的tet-off基因表达系统相结合来实现的。研究表明,大肠杆菌Escherichcoli转座子Tn10中四环素阻遏因子(Tetracycline repressor,tetR)可与四环素结合,从而不能负性调节四环素抗性操纵子(Tetracycline-resistance operon,tetO),因此在四环素存在时,tetR对tetO没有阻遏作用,下游转录随即启动(Gatz & Quail,1988)。依此原理,将tetR中的部分氨基酸与单纯疱疹病毒(Herpes simplex virus,HSV)中的Viral protein 16蛋白的转录活化区域(VP16)组合成一种融合蛋白,即四环素转录激活因子(Tetracycline transcriptional activator,tTA),将tetO与巨细胞病毒(cytomegalovirus,CMV)启动子组合成tTA响应元件(tTA response element,TRE),由此便得到了tet-off基因表达双元件系统(Belloetal.,1998; Gossen & Bujard,1992)。四环素不存在时,tTA蛋白结合tetO从而引发CMV启动子对下游基因的启动功能;四环素浓度达到一定剂量时,四环素与tTA蛋白结合,阻抑了tetO感知tTA的途径,因此无法激发TRE下游基因的转录活化。
如果将某些“致死基因”作为上述基因表达系统中的目的基因,那么含有该系统的个体在没有四环素的条件下,由于“致死基因”的大量表达而导致其个体死亡,而在四环素存在时,“致死基因”不能表达,个体可正常发育和存活(图1A)。相关研究表明,低水平表达的tTA对细胞无害,被广泛用于基因表达研究,然而高水平表达的tTA蛋白对细胞有毒害作用,其原因可能是依赖泛素的蛋白质水解作用受到干扰。Gongetal. (2005)根据上述现象对双元件致死系统进行简化,得到了单元件致死系统。在该系统中,tTA发挥了转录激活因子与致死效应因子的双重功能:在无四环素条件下,基础水平表达的tTA蛋白可以反复结合tetO,从而促使更大量tTA的合成,其表达量受tTA的mRNA稳定性和转录效率的调控,逐步积累可达到使虫体致死的剂量;存在四环素的条件下,tTA的驱动作用被抑制,从而使其表达量保持在较低水平而不会对虫体造成伤害(图1B)。

图1 四环素可抑制的双元件致死系统(A)及单元件致死系统(B) (改自Morrison et al.,2010)
2 遗传控制策略与致死系统类型
2.1 双元件雌性特异致死系统
Thomasetal.(2000)获得了黑腹果蝇Drosophilamelanogaster(Meigen)的雌性特异致死品系,该体系是基于转基因双元件表达系统构建的:以雌虫特异表达的卵黄蛋白yp3基因的启动子驱动tTA的表达,以能产生细胞毒素的Ras64BV12基因作为效应载体中的致死基因,所得品系在有四环素条件下生长正常,在无四环素条件下雌虫全部死亡。基于此,提出了释放携带显性致死系统昆虫(Release of insects carrying a dominant lethal,RIDL)的理念,并分析了该系统与传统SIT相比的优势。
Heinrich & Scott(2000)也基于类似的思路在果蝇上实现了双元件的雌性特异致死系统,该系统使用了在雌虫脂肪体中特异表达的卵黄蛋白yp1基因的启动子和可促近细胞凋亡的头部退化缺陷基因headinvolutiondefective(hid)分别构建驱动载体和效应载体,并获得遗传转化品系。tTA的表达受雌虫脂肪体特异表达基因yp1的转录增强子的调控,在没有四环素的条件下,tTA与tetO结合并进一步诱导促细胞凋亡基因hid在脂肪体中表达,雌虫脂肪体的缺失导致其死亡;存在四环素条件下,tTA与tetO的结合受到抑制,hid基因不能表达,雌虫可正常存活(图2)。
2.2 双元件胚胎致死系统
以上系统由于卵黄蛋白基因在成虫期才能高表达,所以该系统多在成虫期才能致死,而实蝇类害虫多在幼虫期危害,如果可以实现胚胎期致死,则可以避免释放的不育雄虫的后代造成的危害,一定程度上降低其生态风险,而且还将大大降低饲养成本。
Horn & Wimmer(2003)利用在胚胎早期高表达的serendipityα(sryα)和nullo基因的启动子来驱动tTA的表达,以hid基因为致死基因,分别构建胚胎早期驱动载体(Embryonic driver)和致死效应载体(Lethal effector),在果蝇上成功构建了胚胎条件致死系统。该系统中由sryα驱动tTA在胚胎早期高表达,无四环素条件下,tTA与TRE结合驱动促细胞凋亡基因hid的表达并累积,从而使虫体在胚胎期死亡;而存在四环素的条件下,可阻止tTA与TRE的结合,hid不能表达,胚胎可存活并正常发育(图3)。
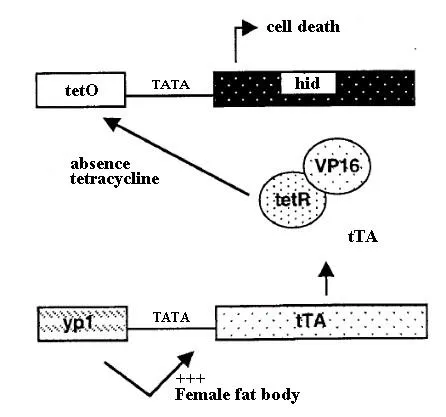
图2 四环素调控的转基因双元件雌性特异
该系统已在地中海实蝇Ceratitiscapitata(Wiedemann) (Scheteligetal.,2009)和加勒比按实蝇Anastrephasuspensa(Loew)(Schetelig & Handler,2012a)中成功建立。地中海实蝇的双元件致死系统中驱动品系、效应品系和致死品系的荧光表达模式如图4所示,驱动品系和效应品系可分别表达红色荧光蛋白DsRed和绿色荧光蛋白EGFP,而由其杂交所得的致死品系同时含有驱动元件和效应元件,同时表达这2种荧光。

图3 双元件胚胎条件致死体系原理示意图(Ogaugwu,2013)
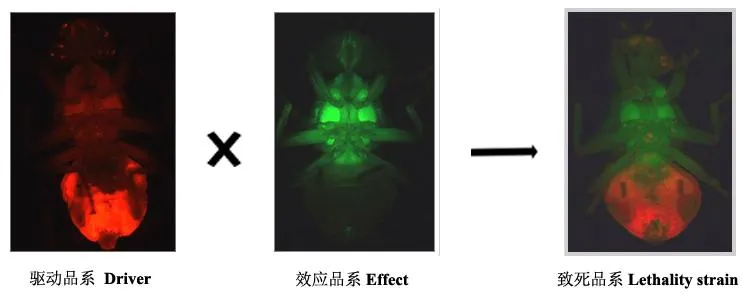
图4 地中海实蝇双元件致死系统中驱动品系、效应品系和致死品系的荧光表达模式
2.3 单元件早期发育致死系统
Gongetal. (2005)构建了单元件致死系统所需的转化质粒pLA656和pLA928,这2个质粒除标记单元中荧光蛋白基因所用的启动子不同外,转座子和致死单元的组成都相同,其中致死单元由热激蛋白hsp70基因启动子、tetO和经过密码子优化突变改造的tTA (tTAV)组成,所用启动子为果蝇hsp70基因启动子的近端元件片段(包括其转录起始位点和很短的前导序列,推断其已失去热激响应功能);pLA656中由ubi-p63E启动子驱动红色荧光蛋白DsRed2表达,而pLA928中则为Hr5增强子和IE1启动子。
用这2个质粒对地中海实蝇进行遗传转化,获得了早期发育致死的RIDL品系,将纯合子雄虫与野生型雌虫交配,则后代基因组中携带单拷贝的复合转座子,在无四环素条件下,致死单元表达tTAV并大量积累最终死亡;该品系的杂合子和纯合子个体能通过荧光表达强度来区分。所得品系中使tTAV的表达量积累到致死剂量一般要到幼虫期,在无四环素条件下,所得品系的地中海实蝇很少(1.3%~7.7%)能存活到蛹期,极少数(0.2%~0.7%)可发育到成虫(Gongetal.,2005)。
基于类似设计, Morrisonetal.(2012)和 Simmonsetal.(2007)构建了质粒OX1124并用于棉红铃虫Pectinophoragossypiella(Saunders) RIDL品系的构建,该质粒所得转化品系的幼虫期致死率仅27%~46%。分析发现,增加tetO/tTAV在其基因组中的拷贝数可放大致死率。对该质粒进行改造后,构建了含多个tetO/tTAV的质粒OX3347、OX3400和OX3402,并通过遗传转化得到了相应的转化品系,其中OX3347和OX3402得到了幼虫期致死率100%的品系。
2.4 单元件雌性特异致死系统
与性别决定相关的2个关键基因transformer和doublesex均存在雌雄差异剪切现象(Black,2003; Parketal.,2004; Sacconeetal.,2002)。在雄虫中trasformer的编码区由含有多个终止密码子的外显子所打断,而雌虫中的剪切体不含该外显子(图5A),因此可编码有功能的Tra蛋白(Paneetal.,2002)。如果将这段雌性特异剪切的内含子插入到基因组上某个基因的编码区,那么从原理上来讲,与transformer基因的情况类似,该基因将只在雌虫中表达(图5B)。Fuetal. (2007)将地中海实蝇中transformer基因(Cctra)的雌性特异剪切元件(Transformer intron,traI)引入到质粒pLA928中得到质粒pLA3097,使tTAV只能在雌虫中表达并积累至致死剂量,而雄虫则不能表达tTAV,从而实现了雌性特异的早期发育致死。
通过该系统,Oxitec公司已经分别在地中海实蝇(图6A、 B)、橄榄实蝇Bactroceraoleae(Gmelin) (图6C、 D)、墨西哥按实蝇Anastrephaludens(Loew)和小菜蛾Plutellaxylostella(L.)中建立了雌性幼虫100%致死的雌性特异早期发育致死品系。Tanetal. (2013)使用家蚕Bombyxmori(L.)的doublesex基因(Bmdsx)雌性特异剪切元件构建类似质粒,并通过遗传转化得到了家蚕的雌性特异致死转化品系。基于类似的设计,Lietal. (2014)和 Scott(2014)以铜绿蝇Luciliacuprina(Wiedemann)的热激蛋白hsp70基因(Lchsp70)启动子和其transformer基因(Lctra)雌性特异剪切内含子元件等构建相应质粒并获得了铜绿蝇的雌性特异致死品系。

图5 地中海实蝇transformer基因(Cctra)雌性特异剪切模式 (Fu et al.,2007)

图6 雌性特异致死RIDL品系OX3864A (地中海实蝇: A, B)和OX3097D (橄榄实蝇: C, D)的
2.5 双元件雌性特异胚胎致死系统
由于卵黄蛋白基因在成虫期才能高表达,由其驱动的双元件雌性特异致死系统只能在成虫期致死;而单元件的雌性特异致死系统中tTA的致死作用原理尚不明确,且饲养条件下抑制该系统表达所需的四环素浓度较高(Schetelig & Handler,2012a),可能会提高某些潜在的未知风险,所以更理想的是利用双元件致死系统实现雌性特异胚胎致死。
该系统可通过将transformer基因的雌性特异剪切内含子元件traI引入到双元件胚胎条件致死系统中的驱动载体或效应载体中来达到该目的。分别构建含有traI的驱动载体(Sexing driver)质粒和效应载体(Sexing effector)质粒,并获得相应遗传转化品系,并分别与相应不含traI的效应品系或驱动品系杂交,则所得品系中只有雌虫可以表达tTA蛋白并驱动TRE表达Hid蛋白从而致死,或者雌雄虫都能表达tTA蛋白,但只有雌虫可以表达Hid蛋白,从而实现雌性特异的胚胎致死(Ogaugwu,2013)。
在地中海实蝇中,用含traI的效应载体(图7B)转化所得效应品系与不含traI的驱动载体(图7A)所得驱动品系进行杂交得到的致死品系能达到雌虫胚胎100%致死,而含traI的驱动载体与不含traI的效应载体所得品系的致死效率较低(Ogaugwu,2013)。基于类似的思路,Schetelig & Handler (2012b)通过使用按实蝇中的相关分子元件成功构建了加勒比按实蝇的雌性特异胚胎致死品系,其杂合子和纯合子的荧光表达模式及荧光强度对比如图8所示,它们也均可同时表达红色荧光蛋白和绿色荧光蛋白,而纯合子个体表达荧光强度要比杂合子个体强。
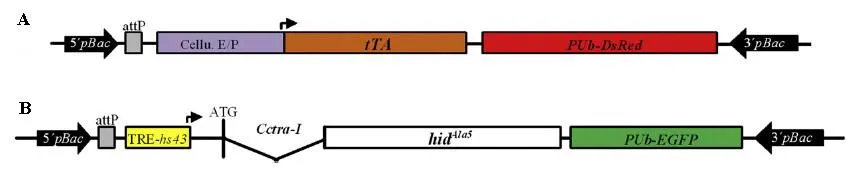
图7 雌性特异胚胎致死体系中胚胎驱动载体(A)和雌性特异效应载体(B)的

图8 双元件致死的加勒比按实蝇杂合个子(A)和纯合子(B)的
3 橘小实蝇遗传不育品系构建的工作进展
橘小实蝇是一种危害水果和蔬菜的世界性害虫,在我国发生尤为严重,且有向北方果蔬产区扩张的趋势(谢琦和张润杰,2005; 尹英超和王勤英,2014; 周国梁等,2007)。目前,橘小实蝇的防治主要以性诱剂和化学农药等传统防治措施为主,已有研究发现,由于频繁使用农药,橘小实蝇野外种群已对有机磷杀虫剂、拟除虫菊酯和阿维菌素等产生了抗性(潘志萍等,2005; 章玉苹等,2008)。根据我国对橘小实蝇有效防控的需求,中国农业科学院生物入侵研究室锚定国际研究前沿,开展了橘小实蝇遗传控制技术体系的构建研究。
基于对以上各遗传不育系统的分析,研究人员拟采用基于tet-off双元件表达系统的不育策略,在橘小实蝇中首先构建胚胎致死系统和雌性特异胚胎致死系统。首先,该体系的构建需要得到的分子元件包括:(1)胚胎早期高表达基因的启动子,以构建胚胎早期驱动载体并使其在胚胎期启动tTA系统;(2) 致死基因(如促细胞凋亡基因hid,reaper和grim等),用于构建致死效应载体;(3) 雌性特异剪接基因元件(如性别决定基因transformer或doublesex的雌性特异剪切内含子序列),用于构建雌性特异表达的效应载体。在得到以上分子元件后,构建相应载体并通过遗传转化与筛选获得驱动品系与效应品系,再将其杂交进行致死效果验证,并最后获得相应致死品系。
目前,研究人员已经克隆了胚胎分化期特异表达基因sryα及母体效应基因nanos和vasa等胚胎早期高表达基因,并分离了它们的上游潜在启动区序列;克隆了促细胞凋亡基因hid的cDNA全长;克隆了性别决定基因transformer的cDNA全长并得到了其内含子序列,通过分析获得了其雌性特异剪切元件;并已利用以上分子元件构建了双元件胚胎致死品系所需的胚胎早期驱动载体和致死效应载体。然后,对橘小实蝇早期胚胎显微注射流程进行了调整和优化,通过胚胎显微注射将各载体对橘小实蝇进行遗传转化的工作正在进行中。以上研究结果为获得橘小实蝇遗传不育品系,实现橘小实蝇可持续控制奠定了基础。
4 总结与展望
近年来,由于国际果蔬贸易活动的大量增加和旅游产业的快速发展,大大增加了有害生物传播和扩散的机会,很多实蝇类害虫在原发生地以外的地区发生为害(Clarkeetal.,2005; Malacridaetal.,2007)。实蝇类害虫的杂食性、较强的飞行能力和较高的繁殖力等特点,使其具有很强的入侵性(Duycketal.,2004),而其幼虫危害的隐蔽性也使得化学防治等传统防治技术不能对其进行有效防治。因此,研究人员一直在致力于研究和发展针对实蝇类害虫的替代传统化学农药的防治技术。
Rubin & Spradling(1982)通过P-转座元件将调控野生型玫瑰色眼睛颜色的基因插入果蝇基因组,开启了转基因昆虫领域的相关研究,经过30多年的发展,在很多昆虫中对其基因组进行人工操纵和改造已成为现实(Fraser,2012)。这些技术已成为在一些模式昆虫中进行基因功能分析等基础生物学研究的重要实验工具,也为农林害虫和媒介害虫的防治提供了新的思路(Wimmer,2003)。近年来,用于害虫防治的遗传不育技术相关研究取得了很多重要进展(曾保胜等,2013; Morrisonetal.,2010),可应用于SIT的多个类型的遗传致死品系先后在果蝇、地中海实蝇、橄榄实蝇、按实蝇等实蝇类害虫,及棉红铃虫、小菜蛾和家蚕等农业昆虫中建立(表1)。
害虫遗传控制技术具有物种特异、环境友好及高效长久等优点,符合未来有害生物防治技术的需求与发展趋势,将在基于大区域综合治理策略的农业害虫综合防控技术体系中发挥重要作用。然而,作为一种基于遗传修饰的新型害虫防控技术,遗传控制技术在广泛应用前仍存在一些问题。
首先,经过遗传修饰的生物在进行野外环境释放前,要严格进行系统的安全性风险评价,已有多家研究单位和政府组织进行了一系列相关研究,并制订了遗传转化昆虫研究和释放流程相关的政策和法规(AHTEG,2010; Benedictetal.,2011; FAO/IAEA,2006; NRE,2009; USDA-APHIS,2009)。
其次,抗性问题也是需要考虑的重要问题之一。很多昆虫具有对各种化学农药和生物农药快速产生抗性的能力(Zhaoetal.,2003),相关调查发现,有些经过SIT防治“筛选”的雌虫产生了“行为抗性(Behaviral resistance)”,即可识别释放的不育雄虫并避免与其交配(Dycketal.,2005)。目前大部分基于遗传修饰改进的SIT体系中,都是单一致死因子(如双元件系统中的促细胞凋亡基因和单元件系统中的tTA蛋白的过量表达),而少数害虫体内可能会存在或者有些害虫在防治过程中会产生相应的抗性突变位点,所以,目标害虫是否也会通过其“生物抗性”能力对该技术产生抗性也是需要考虑的重要问题之一(Alpheyetal.,2011; Gould,1998; Maclntosh,2010; Reevesetal.,2012)。

表1 已成功构建遗传致死品系的农业昆虫
随着分子生物学技术的快速发展,各种高效的基因组编辑技术体系已逐步发展成熟并且在多种物种中成功测试(王跃强等,2013; Fraser,2012),这些技术的应用及相关新体系的建立有望进一步解决现行手段的缺陷并显著提高安全性,为新型的害虫遗传控制技术的发展提供重要工具。
致谢:本文中所用部分图片由Dr. Marc F. Schetelig (Justus-Liebig-University Giessen, Germany)和Dr. Luke Alphey (Oxitec Limited, UK)提供,特此表示感谢。
参考文献
李志红, 姜帆, 马兴莉, 方焱, 孙壮志, 秦誉嘉, 王巧铃. 2013. 实蝇科害虫入侵防控技术研究进展. 植物检疫, 27(2): 1-10.
潘志萍, 曾玲, 陆永跃. 2005. 华南地区桔小实蝇对几种农药的抗药性研究. 华南农业大学学报: 自然科学, 26(4): 23-26.
王跃强, 郑贵斌, 谭安江, 黄勇平. 2013. 基因组编辑技术及其在昆虫研究中的应用. 中国科学: 生命科学, 43(12): 1105-1111.
谢琦, 张润杰. 2005. 桔小实蝇生物学特点及其防治研究概述. 生态科学, 24(1): 52-56.
严盈, 杨瑞, 吕志创, 郭建英, 张桂芬, 万方浩. 2009. 实蝇害虫防治措施的研究进展. 中国生物防治, (增刊2): 1-19.
尹英超, 王勤英. 2014. 警惕北方果园新害虫——桔小实蝇. 河北农业, 236(11): 48-49.
曾保胜, 许军, 陈树清, 谭安江, 黄勇平. 2013. 昆虫种群的遗传调控. 中国科学: 生命科学, 43(12): 1098-1104.
章玉苹, 曾玲, 陆永跃, 梁广文. 2008. 华南地区桔小实蝇田间种群抗药性的监测. 华中农业大学学报, 27(4): 456-459.
周国梁, 陈晨, 叶军, 胡白石, 刘凤权. 2007. 利用GARP生态位模型预测橘小实蝇(Bactroceradorsalis)在中国的适生区域. 生态学报, 27(8): 3362-3369.
AHTEG. 2011. Risk assessment of living modified mosquitoes∥GuidanceonRiskAssessmentofLivingModifiedOrganisms. Ad Hoc Technical Expert Group on Risk Assessment and Risk Management (AHTEG), Secretariat of the Convention on Biological Diversity, Montreal, Canada.
Allwood A J, Vueti E T, Leblanc L and Bull R. 2002. Eradication of introducedBactroceraspecies (Diptera: Tephritidae) in Nauru using male annihilation and protein bait application techniques∥Veitch C R and Clout M N.TurningtheTide:theEradicationofInvasiveSpecies. IUCN Species Specialist Group. IUCN, Gland Switzerland and Cambridge, UK, 19-25.
Alphey N, Bonsall M B and Alphey L. 2011. Modeling resistance to genetic control of insects.JournalofTheoreticalBiology, 270: 42-55.
Bello B, Resendez-Perez D and Gehring W J. 1998. Spatial and temporal targeting of gene expression inDrosophilaby means of a tetracycline-dependent transactivator system.Development, 125: 2193-2202.
Benedict M Q, Eckerstorfer M, Franz G,Gaugitsch H, Greiter A, Heissenbergera A, Knols B, Kumschick S, Nentwig W and Rabitsch W. 2010. Defining environmental risk assessment criteria for genetically modified insects to be placed on the EU market.Scientific/technicalreportsubmittedtoEFSA. Question number: EFSA-Q-2009-01081.
Black D L. 2003. Mechanisms of alternative pre-messenger RNA splicing.AnnualReviewofBiochemistry, 72: 291-336.
Clarke A R, Armstrong K F, Carmichael A E, Milne J R, Raghu S, Roderick G K and Yeates D K. 2005. Invasive phytophagous pest arising through a recent tropical evolutionary radiation: theBactroceradorsaliscomplex of fruit flies.AnnualReviewofEntomology, 50: 293-319.
Cunningham R T. 1989. Male annihilation∥Robinson A S and Cooper G.FruitFlies:theirBiology,NaturalEnemiesandControl. Amsterdam: Elsevier, 345-351.
Duyck P F, David P and Quilici S. 2004. A review of relationships between interspecific competition and invasions in fruit flies (Diptera: Tephritidae).EcologicalEntomology, 29: 511-520.
Dyck V A, Hendrichs J and Robinson A S. 2005.SterileInsectTechnique:PrinciplesandpracticeinArea-WideIntegratedPestManagement. The Netherlands: Springer.
FAO/IAEA. 2006.StatusandRiskAssessmentoftheUseofTransgenicArthropodsinPlantProtection. FAO/IAEA technical meeting, 8-12 April 2002. IAEA-TECDOC-1483. http:∥www-pub.iaea.org/MTCD/publications/PDF/te_1483_web.pdf.
Fraser M J. 2012. Insect transgenesis: current applications and future prospects.AnnualReviewofEntomology, 57: 267-289.
Fu G, Condon K C, Epton M J, Gong P, Jin L, Condon G C, Morrison N I, Dafa′alla T H and Alphey L. 2007. Female-specific insect lethality engineered using alternative splicing.NatureBiotechnology, 25: 353-357.
Gatz C and Quail P H. 1988. Tn10-encoded tet repressor can regulate an operator-containing plant promoter.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 85: 1394-1397.
Gong P, Epton M J, Fu G L, Scaife S, Hiscox A, Condon K C, Condon G C, Morrison N I, Kelly D W, Dafa′alla T, Coleman P G and Alphey L. 2005. A dominant lethal genetic system for autocidal control of the Mediterranean fruitfly.NatureBiotechnology, 23: 453-456.
Gossen M and Bujard H. 1992. Tight control of gene expression in mammalian cells by tetracycline-responsive promoters.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 43: 701-726.
Gould F. 1998. Sustainability of transgenic insecticidal cultivars: integrating pest genetics and ecology.AnnualReviewofEntomology, 43: 701-726.
Hardy D E. 1969. Taxonomy and distribution of the oriental fruit fly and related species (Tephritidae: Diptera).ProceedingsoftheHawaiianEntomologicalSociety, 20: 395-428.
Heinrich J C and Scott M J. 2000. A repressible female-specific lethal genetic system for making transgenic insect strains suitable for a sterile-release program.ProceedingsoftheNationalAcademyofSciences, 97: 8229-8232.
Horn C and Wimmer E A. 2003. A transgene-based, embryo-specific lethality system for insect pest management.NatureBiotechnology, 21: 64-70.
Klassen W. 2005. Area-wide integrated pest management and the Sterile Insect Technique∥Dyck V A, Hendrichs J and Robinson A S.SterileInsectTechnique:PrinciplesandpracticeinArea-WideIntegratedPestManagement. Springer, Dordrecht, The Netherlands, 39-68.
Klassen W and Curtis C F. 2005. History of the Sterile Insect Technique∥Dyck V A, Hendrichs J and Robinson A S.SterileInsectTechnique:PrinciplesandpracticeinArea-WideIntegratedPestManagement. Springer, Dordrecht, The Netherlands, 3-36.
Knipling E F. 1955. Possibilities in insect control or eradication through the use of sexually sterile males.JournalofEconomicEntomology, 48: 459-462.
Li F, Wantuch H A, Linger R J, Belikoff E J and Scott M J. 2014. Transgenic sexing system for genetic control of the Australian sheep blow flyLuciliacuprina.InsectBiochemistryandMolecularBiology, 51: 80-88.
Lysandrou M. 2009. Fruit flies in the mediterranean and Arab world: how serious a threat are they and how can we minimize their impact.ArabJournalofPlantProtection, 27: 236-239.
Maclntosh S C. 2010. Managing the risk of insect resistance to transgenic insect control traits: practical approaches in local environments.PestManagementScience, 66:100-106.
Malacrida A R, Gomulski L M, Bonizzoni M, Bertin S, Gasperi G and Guglielmino C R. 2007. Globalization and fruitfly invasion and expansion: the medfly paradigm.Genetica, 131: 1-9.
Morrison N I, Franz G, Koukidou M, Miller T A, Saccone G, Alphey L S, Beech C J, Nagaraju J, Simmons G S and Polito L C. 2010. Genetic improvements to the sterile insect technique for agricultural pests.Asia-PacificJournalofMolecularBiologyandBiotechnology, 18: 275-295.
Morrison N I, Simmons G S, Fu G, O′Connell S, Walker A S, Dafa′alla T, Walters M, Claus J, Tang G, Jin L, Marubbi T, Epton M J, Harris C L, Staten R T, Miller E, Miller T A and Alphey L. 2012. Engineered repressible lethality for controlling the pink bollworm, a Lepidopteran pest of cotton.PLoSONE, 7: e50922.
NRE. 2009. Risk assessment workshop on transgenic insects∥Hilton P J.MinistryofNaturalResourcesandEnvironment. Putrajaya, Malaysia, 13-15. http:∥www.nre.gov.my/Malay/Pusat-Media/Penerbitan/NewsletterBoisafety2009.pdf.
Ogaugwu C E. 2013.Biotechnologicalapproachestofightfruitfliesofagriculturalimportance. Goettingen: University of Goettingen.
Ogaugwu C E, Schetelig M F and Wimmer E A. 2013. Transgenic sexing system forCeratitiscapitata(Diptera: Tephritidae) based on female-specific embryonic lethality.InsectBiochemistryandMolecularBiology, 43: 1-8.
Pane A, Salvemini M, Delli Bovi P, Polito C and Saccone G. 2002. The transformer gene inCeratitiscapitataprovides a genetic basis for selecting and remembering the sexual fate.Development, 129: 3715-3725.
Park J W, Parisky K, Celotto A, Reenan R and Graveley B. 2004. Identification of alternative splicing regulators by RNA interference inDrosophila.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 101: 15974-15979.
Reeves R G, Denton J A, Santucci F, Bryk J and Reed F A. 2012. Scientific standards and the regulation of genetically modified insects.PLoSNeglectedTropicalDiseases, 6: e1502.
Rubin G M and Spradling A C. 1982. Genetic transformation ofDrosophilawith transposable element vectors.Science, 218: 348-353.
Saccone G, Pane A and Polito C. 2002. Sex determination in flies, fruitflies and butterflies.Genetica, 116: 15-23.
Schetelig M F and Handler A M. 2012a. Strategy for enhanced transgenic strain development for embryonic conditional lethality inAnastrephasuspense.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 109: 9348-9353.
Schetelig M F and Handler A M. 2012b. A transgenic embryonic sexing system forAnastrephasuspense(Diptera: Tephritidae).InsectBiochemistryandMolecularBiology, 42: 790-795.
Scolari F, Schetelig M F, Gabrieli P, Siciliano P, Gomulski L M, Karam N, Wimmer E A, Malacrida A R and Gasperi G. 2008. Insect transgenesis applied to tephritid pest control.JournalofAppliedEntomology, 132: 820-831.
Scott M J. 2014. Development and evaluation of male-only strains of the Australian sheep blowfly,Luciliacuprina.BMCGenetics, 15(S2): S3.
Simmons G S, Alphey L S, Vasquez T, Morrison N I, Epton M J, Miller E, Miller T A and Staten R T. 2007. Potential use of a conditional lethal transgenic pink bollworm pectinophora gossypiella∥Vreysen M J B, Robinson A S and Hendrichs J.Area-WideControlofInsectPests:FromResearchtoFieldImplementation. Dordrecht, The Netherlands: Springer, 119-123.
Tan A, Fu G, Jin L, Guo Q, Li Z, Niu B, Meng Z, Morrison N I, Alphey L and Huang Y. 2013. Transgene-based, female-specific lethality system for genetic sexing of the silkworm,Bombyxmori.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 110: 6766-6770.
Thomas D D, Donnelly C A, Wood R J and Alphey L S. 2000. Insect population control using a dominant, repressible, lethal genetic system.Science, 287: 2474-2476.
USDA-APHIS. 2008. General document preparation guidelines for submission to BRS. v. 2/22/2011.http:∥www.aphis.usda.gov/brs/pdf/Doc_Prep_Guidance.pdf.
Vargas R I, Mau R F L, Stark J D, Piero J C, Leblanc L and Souder S K. 2010. Evaluation of methyl eugenol and cue-lure traps with solid lure and insecticide dispensers for fruit fly monitoring and male annihilation in the Hawaii areawide pest management program.JournalofEconomicEntomology, 103: 409-415.
White I M and Elson-Harris M M. 1992.FruitFliesofEconomicSignificance:TheirIdentificationandBionomics. CAB International, Wallingford, UK.
Wimmer E A. 2003. Applications of insect transgenesis.NatureReviewsGenetics, 4: 225-232.
Zhao J Z, Cao J, Li Y, Collins H L, Roush R T, Earle E D and Shelton A M. 2003. Transgenic plants expressing twoBacillusthuringiensistoxins delay insect resistance evolution.NatureBiotechnology, 21: 1493-1497.
(责任编辑:郭莹)
Sciences,Beijing100193,China;2DepartmentofEntomology,NorthCarolinaStateUniversity,CampusBox7613,Raleigh,
NC27695-7613,USA;3GeneticEngineeringandSocietyCenterandW.M.KeckCenterforBehavioralBiology,North
CarolinaStateUniversity,Raleigh,NC27695-7613,USA;4GuangdongEntomologicalInstitute,Guangzhou,
Guangdong510260,China;5CollegeofAgronomyandPlantProtection,QingdaoAgriculturalUniversity,
Qingdao,Shandong266109,China
Abstract:Many tephritid fruit flies are economically important pest species that can destroy fruits and vegetables, bringing can be a barrier to international trades. The Sterile Insect Technique (SIT), a species-specific and environment-friendly pest control method, has been proven to be highly effective against tephritid pests. Genetic engineering has a potential to bring great improvements to SIT and facilitate its applicability to more insect pests. Much progress has been made in the area, which also became a frontier of genetic innovation. Here we describe the principles of lethality systems based on the tet-off inducible gene expression system,same case studies from Drosophila and tephritid fruit flies for the improvement of SIT, and the application of similar systems to other agricultural insects. The progress to develop a genetic control system on Bactrocera dorsalis is also briefly reported here. The genetic control strategies based on genetic engineering and SIT is believed to play a great role in the Integrated Pest Management (IPM) of tephritid fruit flies and other agricultural insect pests in the future.
Key words:genetic control; fruit flies; sterile insect technique; tet-off gene expression system; lethality strains
通讯作者*(Author for correspondence): 张桂芬, E-mail: guifenzhang3@163.com; 万方浩, E-mail: wanfanghao@caas.cn
作者简介:张桂芬, 女, 研究员。 研究方向: 入侵生物学。 E-mail: guifenzhang3@163.com
基金项目:公益性行业(农业)科研专项(200903047); 国家“973”计划项目(2009CB119200)
收稿日期(Received): 2014-11-12接受日期(Accepted): 2015-01-28
DOI:10.3969/j.issn.2095-1787.2015.02.009

