害虫遗传防治的研究历史与现状
严 盈, 万方浩
1中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193; 2Department of Entomology,
North Carolina State University, Campus Box 7613, Raleigh, NC 27695-7613, USA; 3Genetic Engineering
and Society Center and W. M. Keck Center for Behavioral Biology, North Carolina State University,
Raleigh, NC 27695-7613, USA; 4农业部外来入侵生物预防与控制研究中心,北京 100193
害虫遗传防治的研究历史与现状
严盈1,2,3, 万方浩1,4*
1中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京 100193;2Department of Entomology,
North Carolina State University, Campus Box 7613, Raleigh, NC 27695-7613, USA;3Genetic Engineering
and Society Center and W. M. Keck Center for Behavioral Biology, North Carolina State University,
Raleigh, NC 27695-7613, USA;4农业部外来入侵生物预防与控制研究中心,北京 100193
摘要:作为防治或根除重大害虫最为有效的手段之一,害虫遗传防治在世界范围内被广泛采用并取得了巨大成功。本文综述了不育昆虫技术、雌性致死系统和昆虫显性致死技术等经典害虫遗传防治策略的发展历史、技术特点和应用情况。近年来,许多新的分子生物手段被不断提出并整合到害虫遗传防治策略中,包括归巢核酸内切酶基因、锌指核酸酶、转录激活因子样效应因子核酸酶、CRISPR/Cas9系统、Medea元件、Killer-Rescue系统、Wolbachia-细胞质不亲和性系统等。基于这些新的工具手段,许多国家已经在不同程度上启动了下一代害虫遗传防治项目。而我国在该领域的研究相对薄弱,需要在借鉴国外成功经验的同时,进一步加强害虫遗传防治的基础和应用研究,从而实现本地有害生物的可持续治理和外来入侵生物的有效狙击,确保我国未来的粮食和生态安全。
关键词:不育昆虫技术; 大规模饲养; 染色体移位; 遗传定性品系; 转座子
History and status of the genetic control of insect pest
Ying YAN1,2,3, Fang-hao WAN1,4*
20世纪30~40年代,害虫遗传防治(Genetic pest management,GPM)的设想被提出,即将不育性引入野生种群从而通过遗传手段控制害虫,当时也称作不育昆虫技术(Sterile insect technique,SIT)。60年代后,SIT被不同国家广泛使用并在特定区域内防治或根除了多种农业和卫生害虫(Klassen & Curtis,2005)。与此同时,一些区别于传统SIT的GPM设想被不断提出。如Curtis (1968a)提出“品系替换”(Srain replacement)的概念,认为可以通过染色体移位(Chromosome translocations)突变的方法将传播病原的蚊子品系替换为无法传播病原的品系;Yen & Barr (1971)提出利用内生菌Wolbachia造成的细胞质不亲和性(Cytoplasmic incompatibility)使害虫不育;70年代一批学者提出性别比定向(Sex ratio distortion)策略,即通过可遗传的性别比定向子(Sex ratio distorters,通常是性别关联基因)使配子在减数分裂过程中定向发育为雄性(Lyttle,1977; Suguna & Curtis,1974; Sugunaetal.,1977);80~90年代,雌性致死系统(Female killing system,FKS)的开发使单独释放雄虫成为可能,进一步提升了SIT项目的效率 (Fosteretal.,1988; Franzetal.,1997)。然而,由于技术条件的限制,这些设想大多数仅停留在测试阶段,无法真正应用于实际中,因此在20世纪后30年关于GPM新策略的应用研究基本处于停滞阶段(Gould & Schliekelman,2004)。21世纪分子生物学、细胞学、生物信息学等学科的快速发展,使GPM进入一个全新的阶段。2000年,“携带显性致死基因昆虫的释放技术”(简称为“昆虫显性致死技术”;Release of insects carrying a dominant lethal,RIDL)被开发,通过基因修饰实现雌性致死的精确调控(Heinrich & Scott,2000; Thomasetal.,2000)。
1 SIT
1.1 SIT的发展历史与概念
20世纪,新大陆螺旋蝇Cochliomyiahominivorax(Coquerel)是美洲大陆热带和亚热带地区温血动物(包括人在内)的主要杀手,大量农药用于防治该害虫的危害。美国农业部的Knipling博士通过对新大陆螺旋蝇交配行为和种群动态的详细观察,认为如果将不育性人为引入野生种群将有可能达到控制目的,但是在当时并没有行之有效的手段使昆虫不育。20世纪40年代H. J. Muller教授发现辐射能够导致果蝇不育;Bushland (1951) 经过详细试验证实了X光对螺旋蝇的不育效应。随后,Knipling (1955)较为系统地阐述了SIT的概念和模型,即通过工厂化大量培养靶标害虫,经过特定处理(如60Co-γ射线辐照)使害虫不育,然后在合适的时间把不育雄虫大量释放到田间与野生型雌虫交配,使其无法产生后代,如果连续多代释放足够多的不育昆虫,最终能够显著降低甚至根除靶标害虫种群。同时,Knipling (1955)指出实施SIT必须同时满足的5个条件:目标昆虫可以被大规模饲养;不育雄虫需要具备一定的扩散能力;不育手段不会显著降低目标昆虫的交配能力;雌虫最好只交配一次,如果交配多次,不育雄虫的精子活力须与野生型雄虫相当;目标昆虫的野外种群数量不能太高,否则需要通过特定手段压低种群密度,从而确保释放的不育雄虫数量大大超过野生型雄虫数量。Knipling指出,释放不育雄虫与野生型雄虫的初始数量比(释放比)越高,防治效果越好。由于各种因素的限制,野外昆虫的生长潜力一般很难达到最佳状态,如果释放比为2∶1,虽然可以在一定程度上降低后代数量,但存活的幼虫可能因为拥有更多的资源和空间而发育更好,存活率更高,从而抵消了亲代数量下降对子代绝对数量的影响。因此,Knipling建议采用更高的释放比(如9∶1)来执行不育昆虫项目(图1)。
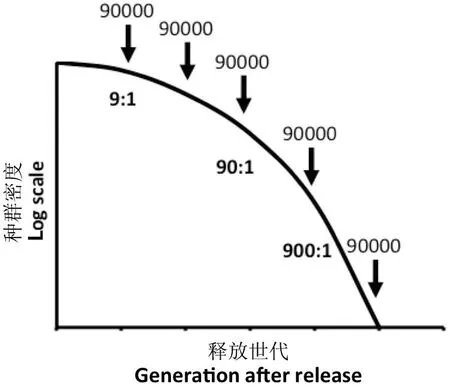
图1 不育昆虫技术的种群控制理论模型(Knipling,1955)
1.2 SIT的应用
1956年,美国农业部开始在佛罗里达州筹备基于SIT的新大陆螺旋蝇根除项目,1957年一个大型饲养工厂在锡布灵市的空军基地竣工,该工厂每周可以生产螺旋蝇6000万头。自1958年5月起,数以千万的不育螺旋蝇被运往佛罗里达及附近各州进行野外释放,1959年2月新大陆螺旋蝇在整个佛罗里达州被根除。1962年在德克萨斯州米申市修建了第2个大型饲养工厂,并在美国西南各州释放不育螺旋蝇,1964年德克萨斯州和新墨西哥州的新大陆螺旋蝇被根除,1966年美国农业部宣布新大陆螺旋蝇从整个美国被根除。为了防止该蝇从南部边界重新传入,美国农业部与多国相关部门协作,将SIT项目向南推进,1991年新大陆螺旋蝇从整个墨西哥被根除,2006年从整个中美洲被根除(Klassen & Curtis,2005)。2006年,美国农业部与巴拿马政府在帕科拉市(Pacora)合作修建了不育昆虫工厂,该工厂每周可生产新大陆螺旋蝇2000~4000万头。这些螺旋蝇经辐射后在巴拿马与哥伦比亚的边界被释放,建立了生物隔离带(Biological barrier),以防止其从南美洲重新入侵。基于SIT的新大陆螺旋蝇根除项目给整个北美和中美洲畜牧业带来的直接收益高达每年15亿美元,而整个项目在半个多世纪来的投资不到10亿美元(Klassen & Curtis,2005);同时显著减少了农药的使用,极大地保障了当地畜牧业和环境的健康发展(图2)。
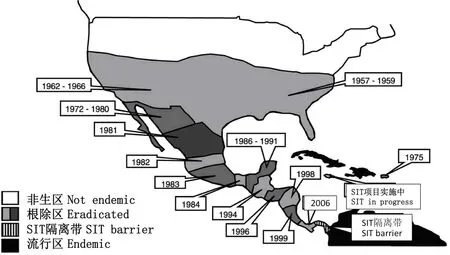
图2 利用SIT在美国及中美洲国家根除新大陆螺旋蝇的路线图(改自Robinson,2002)
1976~1977年,危地马拉、墨西哥和美国签署了一项名为“实蝇计划”(Programa Moscamed)的协议,该协议的主要内容是采用SIT将地中海实蝇Ceratitiscapitata限制在危地马拉,防止其传入墨西哥和美国,共同保护3个国家的种植业。在该计划的初期(1977~1982年),墨西哥采用SIT结合综合检疫、化学防治、机械防治、农业防治等措施,将地中海实蝇从南部的恰帕斯州(危害面积6400 km2)根除(Villaseoretal.,2000),一条不育雄虫形成的隔离带由此建立,阻止了该害虫向北扩散。目前,危地马拉设立了全世界最大的不育昆虫培育基地,每周释放超过25亿头不育昆虫,使地中海实蝇的危害降到最低。此外,在中美洲和巴拿马地区,萨尔瓦多、哥斯达黎加、危地马拉、洪都拉斯、尼加拉瓜、巴拿马等国农业部也共同制定了SIT项目。
20世纪60年代马里亚纳群岛应用SIT成功根除了橘小实蝇Bactroceradorsalis(Steineretal.,1965);70年代萨尔瓦多每天释放100万头不育淡色按蚊Anophelesalbimanus,有效降低了其在太平洋沿岸的种群数量(Dameetal.,1981);90年代日本冲绳和鹿儿岛等地也采用该技术成功根除了瓜实蝇Bactroceracucurbitae和橘小实蝇(Liu,1993; Shiga,1992);澳大利亚西部应用该技术成功根除了昆士兰实蝇Dacustryroni(Jessupetal.,2007);美国和加拿大在90年代分别采用SIT防治鳞翅目害虫棉红铃虫Pectinophoragossypiella(Waltersetal.,2000) 和苹果蠹蛾Cydiapomonella(Bloem & Bloem,2000),都取得了理想的效果。至今,全世界不同地区已应用SIT成功防治或根除了多种农业和卫生害虫(表1)。
1.3 SIT的特点与缺陷
SIT具有几个防治特点:(1)对象高度专一,由于释放的不育昆虫只会与同种野生型昆虫交配,从而特异地造成目标害虫种群数量下降;(2)生态环境友好,SIT可以降低农药的使用,从而有效避免害虫抗性、农药残留、环境污染、杀伤天敌等一系列问题;(3)防治效果显著,通过多代释放可以将目标害虫种群维持在较低水平,甚至彻底根除害虫;(4)防治面积较大,通常与大区域综合治理(Area-wide integrated pest management approach,AW-IPM)相结合,辅以生物防治、农业防治、物理防治、引诱剂杀灭和合理喷施农药等多种技术手段,并通过地区之间农民、当地政府和区域性组织的合作,实现一种大范围且可持续的、长期的害虫治理(Klassen & Curtis,2005)。

表1 不同国家(地区)应用SIT成功防治或根除的农业和卫生害虫
但在操作过程中,基于辐射的传统SIT往往存在以下缺陷:由于缺乏有效手段区分性别,雌虫和雄虫被同时释放,一定程度上增加了生产成本并降低了控制效率;昆虫的质量受种虫引进、人工饲养、辐射处理和操作过程的影响,饲养种群的遗传变异性在种虫引进早期由于飘移、选择和内交丧失到最低限,随后由于突变和重组有所回升,但远低于自然种群的水平,且这种近亲繁殖下的变异性与自然种群也不一致,导致释放种群适应野外生境的能力变差(Bushland,1971);长期人工饲养引起种群质量的变化,表现为飞行能力下降、交尾时间改变、雌虫的吸引性与交尾次数改变等(Cayoletal.,1999)。此外,辐射处理可影响昆虫的活动能力、视觉、寿命,可能改变求偶过程中的发声讯号等,辐射剂量越低,这些影响越小;辐射昆虫的交尾竞争力往往低于自然昆虫,如日本的辐射不育瓜实蝇的交尾竞争力为正常实蝇的20%~60%(Shiga,1992);难以监控,尽管在有的SIT项目中不育昆虫可以通过喷施荧光粉识别,但释放昆虫常常会将荧光粉传递给野生种群从而造成误判,并且使用荧光粉的成本太高且对人体有害(Hagler & Jackson,2001)。这些缺陷在一定程度上增加了SIT的操作难度和运行成本,在降低防治效果的同时限制了SIT在更多害虫上的应用。
2 FKS
2.1 FKS的概念与原理
传统SIT采取的策略是同时释放不育的雌虫和雄虫(两性害虫),但实质上仅不育雄虫将不育性引入野生种群,因此在早期SIT也被称为“不育雄虫方法”(Sterile male method; Knipling,1959)。不育雌虫对野生害虫种群的不育性传递没有实质性的意义,且即使雌虫不育,其仍会叮咬(如蚊子)或产卵(如实蝇类害虫),从而对人类健康或作物品质造成影响。因此,在传统SIT的基础上研究人员开发了FKS。早期FKS采用染色体移位技术将包括选择标记和条件致死基因在内的多种突变重组,导致雌虫在发育过程中死亡,从而定向生产出雄性成虫,由此得到的昆虫品系被称为遗传定性品系(Genetic sexing strain)。构建遗传定性品系至少需要满足2个条件:(1)具有性别区分作用的选择标记和条件致死突变;(2)能够通过Y染色体移位将这种突变定性遗传给后代。在包括地中海实蝇在内的多种双翅目害虫中,其Y染色体都包含一个显性的“雄性因子”(Maleness factor; Willhoeft & Franz,1996)。如果通过染色体移位将常染色体上的选择标记和条件致死野生型等位基因连接到Y染色体的“雄性因子”区域(图3),那么产生的雄性后代将是选择标记和条件致死基因的杂合子,具有与野生型一样的性状;而雌性后代则是选择标记和条件致死基因的纯合子,不仅可以被选择标记识别,而且能在条件启动下(如热激)致死。

图3 遗传定性品系的基本构造 (Franz et al.,1997)
Robinson (2002)总结了19个物种的遗传定性品系,这些品系的构造原理基本类似。从理论上讲,遗传定性品系即使不经过辐射释放到田间,也能造成野外害虫种群的显著减少。如Foster (1991)报道的澳大利亚铜绿蝇Luciliacuprina遗传定性品系中,3号和5号染色体各自包含一个眼睛颜色突变和染色体倒置(Inversion)突变,这种倒置仅在纯合子条件下无害,表现为雄虫杂合子可育而雌虫半不育,因此释放雄虫仅将常染色体突变传递给子代雌虫;同时常染色体上的突变由染色体移位连接到Y染色体,因此释放雄虫仅将Y染色体突变传递给子代雄虫。当释放雄虫与野生雌虫交配后,常染色体突变被定向传递给子代雌虫,造成整个野生种群50%不育;而存活的雌虫再次与释放雄虫交配后,不同拷贝数的常染色体和Y染色体突变被同时传递给子代,造成整个野生种群90%不育。如果同时考虑不育和眼睛突变的致盲作用,野生种群的死亡率高达98%(Fosteretal.,1992)。
2.2 FKS的应用
1970年,超过10万头尖音库蚊Culexpipiens的遗传定性品系在8周内被释放到法国巴黎圣母院附近,结果显示,染色体移位突变不仅被成功引入当地种群,而且大大降低了其种群密度(Lavenetal.,1972)。1980年FKS首次在大规模饲养中得到应用,结果表明,阿拉伯按蚊Anophelesarabiensis遗传定性品系可以定向生产出99.9%的雄性且羽化率高达90%(Baileyetal.,1980)。1984~1986年铜绿蝇遗传定性品系的田间释放直接将性别定向饲养与雄性释放相结合 (Fosteretal.,1985)。通常,构建FKS相对容易,困难的是如何满足SIT项目的特定要求。要将某一遗传定性品系从实验室转移到工厂大规模饲养,然后再推广到田间的大面积释放,需要在遗传稳定性、品系适合度、行为和生理背景、环境选择压力、生态适应性和经济可行性等多个方面进行大量研究。由于不同开发环节的限制,具备遗传定性品系的19个物种中,只有淡色按蚊和地中海实蝇可以被工厂化大规模饲养,而真正结合SIT应用于田间并取得理想效果的仅有地中海实蝇的遗传定性品系(表2)。
2.3 FKS的特点与缺陷
遗传定性品系的开发使得单独释放不育雄虫成为可能,大大增加了不育雄虫与野外雌虫交配的概率(McInnisetal.,1986);增加了生态安全性,因为即使在生产过程中发生逃逸,也不会造成重大安全事故;监测更为准确,当采用雌性引诱剂时,引诱的都是野生雌虫而非不育雌虫;提高了防控效率,如对地中海实蝇而言,单独释放不育雄虫比释放雌、雄两性不育昆虫的防控效率提高了3~4倍(Caceresetal.,2004; Rendonetal.,2004);此外,遗传定性品系减少了包括标记、辐射、运输、释放和检测在内的后期操作,降低了生产成本。

表2 世界范围内不同害虫SIT工厂的生产能力和饲养策略(Franz,2005)
FKS在地中海实蝇SIT项目中的成功应用使人们迫切希望将该技术运用到其他重大害虫防治中,但遗传定性品系的自身特点限制了其应用范围。如对某一新目标物种进行诱导突变是一个非常难于预测的过程,无法保证能够找到合适的选择标记和条件致死突变;染色体移位也是一个随机过程,且遗传稳定性很大程度上取决于染色体移位位点,最好只涉及一个常染色体,并且该染色体与Y染色体的移位位点已知;染色体倒置是突变筛选的一个重要手段,但这不仅需要开展大量的工作,而且需要非常完善的细胞学检测手段;突变选择、染色体移位等因素往往制约了获得品系的适用性,如地中海实蝇项目中的遗传定性品系由于染色体移位降低了其单雌产卵量,而只有维持较大种群数量才能获得足够的雄虫释放,所以实际上饲养成本也较高(Robinsonetal.,1999)。
3 RIDL技术
3.1 RIDL技术的发展和原理
Rubin & Spradling (1982)通过P转座子将外源基因插入果蝇Drosophilamelanogaster的基因组,获得了世界上第一个转基因昆虫品系,从而打开了人为控制昆虫表达特定目的基因的大门,随后科学家开始不断尝试通过昆虫转座子技术开发新的GPM策略。从20世纪90年代到21世纪初,多种转座子被应用于昆虫的遗传转化体系并取得了成功(Handler,2011; Robinsonetal.,1999)。2000年,来自英国和新西兰的科研团队分别独立提出一种基于昆虫转座子技术的RIDL (Thomasetal.,2000; Heinrich & Scott,2000)。该技术利用遗传工程方法,体外连接昆虫转座子、特异启动子、昆虫显性致死基因、转录激活域、荧光标记等元件,构建了一个复合转座子(Transposons with armed cassettes,TAC),在昆虫转座子的引导下,TAC插入昆虫基因组,形成遗传修饰昆虫。该遗传修饰昆虫的纯合子品系与野生型昆虫交配后,雌性后代在TAC作用下死亡,而雄性后代继续携带TAC与野生型雌虫交配;如果最初释放的是多拷贝TAC的遗传修饰昆虫,或连续多代释放单拷贝TAC的遗传修饰昆虫,那么经过几个世代后TAC的基因拷贝将扩散到野生种群的所有个体,最终使靶标昆虫“自毁”(图4; Alphey,2000; Alphey & Andreasen,2002)。

图4 RIDL的田间效应图
目前构建RIDL技术昆虫品系最常见的手段是采用四环素(Tetracycline)调控体系,其中包括双元件系统和单元件系统(Alpheyetal.,2008)。在双元件体系中(Heinrich & Scott,2000; Horn & Wimmer,2003; Scheteligetal.,2009; Thomasetal.,2000),启
动元件(Driver)通过特定启动子(如雌性特异启动子)驱动四环素反式激活因子(The tetracycline dependent transactivator,tTA)的表达,而效应元件(Effector)则包括转录增强子tetO (也叫作TRE)、最小启动子(Minimal promoter)和效应基因(可包含雌性特异剪辑内含子),其中,tetO由大肠杆菌Escherichiacoli四环素抑制子(tet repressor,tetR)的DNA结合域与病毒HSV1中VP16蛋白的转录激活域组成。因此,在缺乏四环素的条件下,tTA与tetO结合,驱动效应基因在雌性中表达并导致死亡(图5A);而在四环素存在的条件下,tTA无法与tetO结合,不能激活效应基因的表达,整个系统通路被关闭(图5B)。在单因子体系中(Gongetal.,2005),包含雌性特异剪辑内含子的tTA直接作为效应基因,由连锁在tetO上的最小启动子控制。因此,在缺乏四环素条件下,只有雌性能够产生tTA,该tTA与tetO结合后将激活更多tTA的表达,由此循环反复造成tTA的不断累积,高浓度的tTA最终导致雌性死亡(图5C);而在四环素存在的条件下,tTA无法与tetO结合,不能造成tTA的累积,整个系统通路被关闭(图5D)。
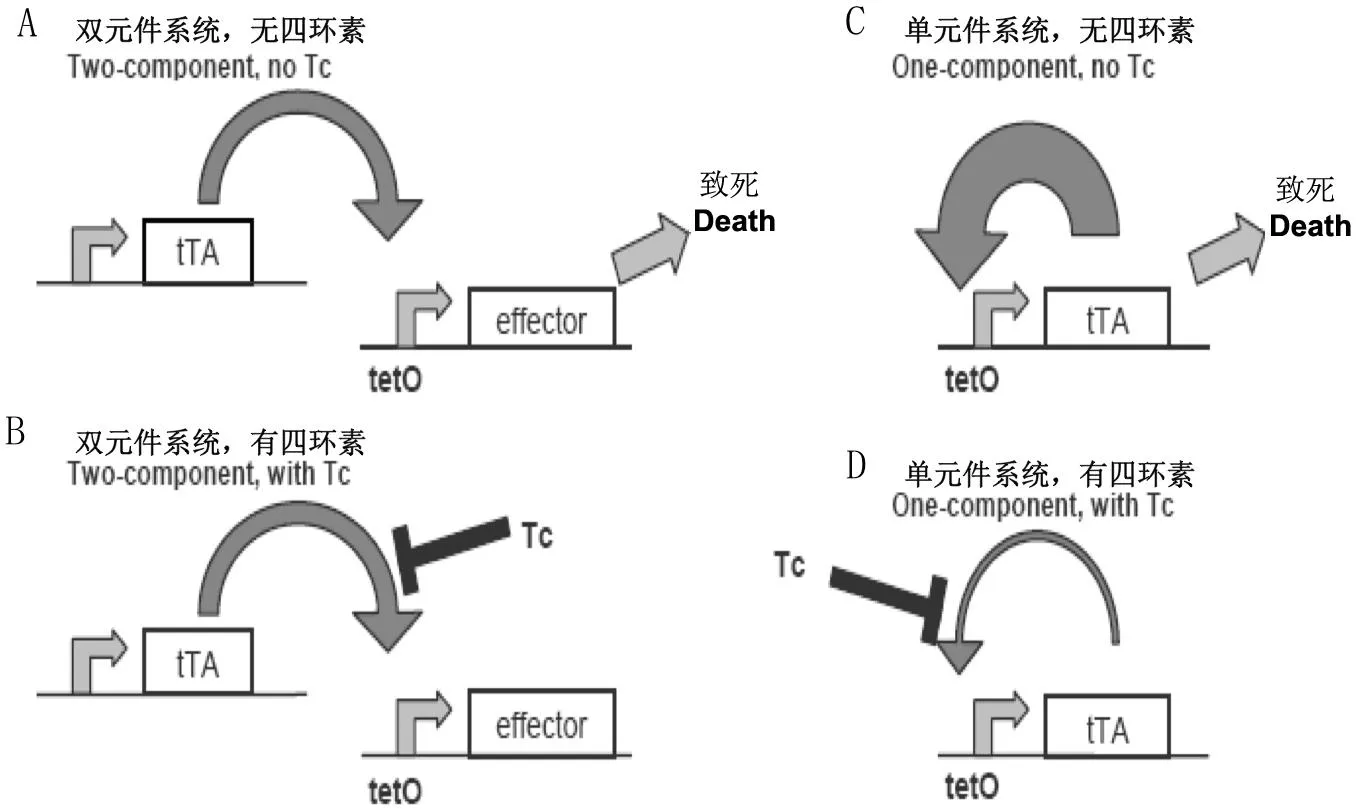
图5 RIDL的单元件系统和双元件系统(Alphey et al.,2008)
3.2 RIDL技术的应用
RIDL技术应用于田间的一个重要条件是携带TAC的遗传修饰品系必须具备与野生种群相近的竞争、交配以及扩散等能力。2006年,美国农业部与英国生物公司Oxitec合作开发了一个棉红铃虫仅携带荧光标记(DsRed)的遗传修饰品系OX1138B,2006~2008年数以千万的OX1138B品系棉红铃虫被释放到美国亚利桑那州的棉花田间。结果表明,OX1138B与SIT标准释放品系APHIS在竞争、交配、扩散等能力方面没有显著差异(Simmonsetal.,2011)。随后美国农业部与Oxitec进一步合作开发出基于单因子系统的棉红铃虫显性致死品系(Jinetal.,2013; Morrisonetal.,2012)。2010年Oxitec与马来西亚政府合作,对登革热病毒主要传播载体埃及伊蚊Aedesaegypti的RIDL品系OX513A进行了非栖息地野外释放测试,结果表明,OX513A与同步释放的野生型实验室品系在平均寿命等生命参数上没有显著差异(Lacroixetal.,2012)。与此同时,Oxitec在开曼群岛对OX513A进行了大面积的栖息地(居民区)野外释放测试,结果显示,释放的OX513A雄虫不仅与当地野生型雄虫具有同等的竞争和交配能力(Harrisetal.,2011),而且能够显著降低当地野生埃及伊蚊的种群密度(Harrisetal.,2012)。此外,自2011年至今在巴西不同城市的野外释放测试都表明,OX513A能够有效抑制不同种类蚊子的野生种群数量,从而有效防止如登革热、疟疾等疾病的传播(Alphey,2014)。2014年,印度、巴拿马等国家也纷纷开始启动RIDL项目,以防控本国的病原蚊子(Alphey,2014; Patiletal.,2014)。
3.3 RIDL的特点与缺陷
与传统SIT相比,RIDL具有几个优点:不需要使用辐射使昆虫不育,不会因此降低昆虫寿命、繁殖力、交配竞争能力等生命参数;有的昆虫(如蚊子)因难以控制不育辐射的剂量而无法应用SIT,而RIDL则能够应用于此类昆虫;具有更强的生物安全性,因为任何从培育基地逃逸的昆虫都不育,且由于环境中缺乏抑制昆虫致死基因的化学物质(四环素),逃逸的昆虫将迅速死亡;大大降低了饲养成本,早期致死的RIDL品系将不需要额外饲养雌虫;显著提升了防控效率,如需要的初始释放种群数量更少,达到控制效果的时间更短(Schliekelman & Gould,2000);由于所有释放昆虫都含有可遗传的荧光标记,可以对项目进行更有效的监控。
目前构建的RIDL品系都是使用不同转座子转化而来,TAC被随机插入到基因组,其插入位点很大程度上决定了效应基因的表达效率和RIDL品系的适合度,因此往往需要构建多个转化品系进行筛选比较;构建TAC一般采用内源元件,需要从目标昆虫本身分离启动子、效应基因和雌性特异剪辑内含子等元件;转座子活性可能导致TAC在种内或种间漂移,降低RIDL品系的遗传稳定性,进而需要通过特定手段使转座子失活(Scheteligetal.,2009)。这些问题增加了RIDL前期的技术难度和构建成本。
4 小结与展望
经过半个多世纪的不断发展和改进(表3),GPM已经成为当今国际上用于防治或根除重大害虫最有效的手段之一。作为一个学科高度交叉的应用领域,GPM涉及到多个层面的问题。在技术层面上,既需要分子生物学、细胞学、生物信息学等方面的知识储备,也需要掌握目标对象的遗传背景、生活史参数、种群动态、危害特征等生态特点。在操作层面上,项目前期需要结合经济学、检疫学、气象学等进行详细的可行性考证和风险评估;项目中期需要结合数学模型、半开放试验等决定释放的策略组合;项目后期需要结合种群遗传学、田间流行学等对释放种群和野生种群进行有效监控和管理。在政策层面上,既需要政府部门的大力支持,也需要制定和落实相关的法律法规。在社会层面上,既需要公共媒体进行科学的宣传和教育,也需要普通大众的理解和支持。总而言之,尽管GPM具有卓越的防治效果和巨大的应用前景,但每一个GPM项目的实施都必须经过科学、社会、法规、伦理等方面详细审慎的梳理、评估和管理,才能使GPM技术最大化地造福人类社会。
传统的害虫防治技术已不能满足现代农业生产的需求,各种基因组剪辑手段和遗传防治策略被不断开发,如归巢核酸内切酶基因(Homing endonuclease gene)、锌指核酸酶(Zinc-finger nucleases)、转录激活因子样效应因子核酸酶(Transcription activator-like effector nucleases)、CRISPR/Cas系统(Clustered regulatory interspaced short palindromic repeat)、Medea元件(Medea element)、Killer-Rescue系统、Wolbachia-细胞质不亲和性系统(Wolbachia-cytoplasmic incompatibility)等 (Alphey,2014; Fraser,2012; Gajetal.,2013; Gould,2008; Gouldetal.,2008; Sinkins & Gould,2006)。基因组测序技术的发展不仅帮助更多模式生物完成了全基因组测序,从而为相关近缘有害生物的遗传控制策略提供了更多数据参照,而且使针对非模式生物的重大害虫进行全基因组测序成为可能,大大降低了GPM前期的投入和操作难度。目前,美国、加拿大、英国、德国、澳大利亚、印度、马来西亚、巴西、墨西哥、巴拿马等多个国家已经在不同规模上启动了下一代的GPM项目。而我国在GPM领域起步较晚,对下一代遗传防治策略的研究几乎是空白,因此迫切需要借鉴国外先进经验,针对我国农林牧渔业重大有害生物开展遗传防治的基础和应用研究,实现本地有害生物的可持续治理和外来入侵生物的有效狙击,确保我国未来的粮食和生态安全。

表3 害虫遗传防治的发展历史和重大事件(改自Robinson,2002)
参考文献续表3时间Date事件Event意义SignificanceReferences1982首次通过P转座子将外源基因插入果蝇的基因组InsertionofexogenousgeneintoDrosophilamelano-gastergenomebyPelement获得了世界上第一个转基因昆虫品系DevelopmentofthefistinsecttransgenicstrainRubin&Spradling,19821998地中海实蝇遗传修饰品系的构建Constructionoftransgenicmedflystrain基于遗传修饰技术的害虫方式手段进入人们视野ConsiderationofgeneticengineeringmethodforpestcontrolLoukerisetal.,19952000基于四环素调控的雌性特异显性致死系统在果蝇中得到实现Experimentaldemonstrationofarepressiblefemale-specificdominantlethalgeneticsysteminDrosophi-lamelanogaster首次阐述了昆虫显性致死技术作为新遗传防治手段的原理和优势DevelopmentofRIDLasanewcontrolmethodHeinrich&Scott,2000;Thomasetal.,20002003基于昆虫显性致死技术的胚胎早期致死在果蝇中得到实现Demonstrationofembryo-specificlethalitysysteminDrosophilamelanogaster利用昆虫显性致死技术的双因子系统使胚胎早期致死成为可能Developmentofembryo-specificlethalityusingtwocomponentssystemofRIDLHorn&Wimmer,20032005在地中海实蝇中发现了tTA的致死效应DemonstrationoftTAlethalityeffectinMedfly提出了昆虫显性致死技术单因子系统的原理与模型DevelopmentofonecomponentsystemofRIDLGongetal.,20052006携带荧光标记DsRed的棉红铃虫OX1138B品系被大规模释放到田间FieldreleaseofPectinophoragossypiellatransgenicstraincarryingDsRedinArizona昆虫遗传修饰品系首次在田间被大规模释放FirstfieldreleaseofinsecttransgenicstrainSimmonsetal.,20112009埃及伊蚊的昆虫显性致死品系被大规模释放到开曼群岛的居民区FieldreleaseofAedesaegyptiRIDLstraininCay-manisland昆虫显性致死品系首次被释放到人类社区FieldreleaseofinsectRIDLstrainintohumancom-munityHarrisetal.,2011、2012
Alphey L. 2000. Re-engineering the Sterile Insect Technique.InsectBiochemistryandMolecularBiology, 32: 1243-1247.
Alphey L. 2014. Genetic control of mosquitoes.TheAnnualReviewofEntomology, 59: 205-224.
Alphey L and Andreasen M. 2002. Dominant lethality and insect population control.MolecularandBiochemicalParasitology, 121: 173-178.
Alphey L, Nimmo D, O′Connell S and Alphey N. 2008. Insect population suppression using engineered insects∥Aksoy S.TransgenesisandtheManagementofVector-BorneDisease. Austin, Texas: Landes Bioscience, 627: 93-103.
Bailey D L, Lowe R E, Dame D A and Seawright J A. 1980. Mass rearing the genetically altered macho strain ofAnophelesalbimanusWiedemann.TheAmericanJournalofTropicalMedicineandHygiene, 29: 141-149.
Barnes B N, Eyles D K and Franz G. 2004. South Africa′s fruit fly SIT programme — the Hex River Valley pilot project and beyond∥Barnes B N.Proceedingsofthe6thInternationalSymposiumonFruitFliesofEconomicImportance. Irene, South Africa: Isteg Scientific Publications, 131-141.
Baumhover A H, Graham A J, Bitter B A, Hopkins D E, New W D, Dudley F H and Bushland R C. 1955. Screwworm control through release of sterilized flies.JournalofEconomicEntomology, 48: 462-466.
Bloem K A and Bloem S. 2000. SIT for codling moth eradication in British Columbia, Canada∥Tan K H.Proceedings:AreaWideControlofFruitFliesandOtherInsectPests. Penang, Malaysia: Penerbit Universiti Sains, 207-214.
Bushland R C. 1951. Hopkins Experiments D. E., with screwworm flies sterilized by X-rays.JournalofEconomicEntomology, 44: 725-731.
Bushland R C. 1971. Sterility principle for insect control. Historical development and recent innovations∥Proceedings,Symposium:SterilityPrincipleforInsectControlorEradication. Vienna, Austria: IAEA, 3-14.
Caceres C. 2002. Mass rearing of temperature sensitive genetic sexing strains in the Mediterannean fruit fly (Ceratitiscapitata).Genetica, 116: 107-116.
Caceres C, Cayol J P, Enkerlin W R, Franz G, Hendrich J and Robinson A S . 2004. Comparison of Mediterranean fruit fly (Ceratitiscapitata) bisexual and genetic sexing strains: development, evaluation and economics∥Barnes B N.Proceedingsofthe6thInternationalSymposiumonFruitFliesofEconomicImportance. Irene, South Africa: Isteg Scientific Publications, 367-381.
Cayol J P, Coronado P and Taher M. 2002. Sexual compatibility in Medfly (Diptera: Tephritidae) from different origins.FloridaEntomologist, 85: 51-57.
Cayol J P, Rossler Y, Weiss M, Bahdousheh M, Omari M, Hamalawi M and Almughayyar A. 2004. Fruit fly control and monitoring in the Near East: shared concern in a regional transboundary problem∥Barnes B N.Proceedingsofthe6thInternationalSymposiumonFruitFliesofEconomicImportance. Irene, South Africa: Isteg Scientific Publications, 155-171.
Cayol J P, Vilardi J, Rial E and Vera M T. 1999. New indices and method to measure the sexual compatibility and mating performance ofCeratitiscapitata(Diptera: Tephritidae) laboratory-reared strains under field cage conditions.JournalofEconomicEntomology, 92: 140-145.
Curtis C F. 1968a. A possible genetic method for the control of insect pests, with special reference to tsetse flies (Glossinasp.).BulletinofEntomologicalResearch, 57: 509-523.
Curtis C F. 1968b. Possible use of translocations to fix desirable genes in insect pest populations.Nature, 218: 368-369.
Dame D A, Lowe R E and Williamson D W. 1981. Assessment of released sterileAnophelesalbimanusandGlossinamorsitansmorsitan∥Pal R, Kitzmiller J B and Kanda T.CytogeneticsandGeneticsofVectors. Amsterdam, The Netherlands: Elsevier Science Publishers, 231-248.
Dantas L, Pereira R, Silva N, Rodrigues A and Costa R. 2004. The SIT control programme against medfly on Madeira Island∥Barnes B N.Proceedingsofthe6thInternationalSymposiumonFruitFliesofEconomicImportance. Irene, South Africa: Isteg Scientific Publications, 127-130.
Dowell R V, Siddiqui I A, Meyer F and Spaugy E L. 2007. Mediterranean fruit fly preventative release programme in southern California∥Tan K H.AreaWideControlofFruitFliesandOtherInsectPests. Penang, Malaysia: Penerbit Universiti Sains, 369-375.
Food and Agriculture Organization of the United Nations (FAO). 1992.TheNewWorldScrewwormEradicationProgramme:NorthAfrica1988-1992. Rome: FAO.
Foster G G, Vogt W G and Woodburn T L. 1985. Genetic analysis of field trials of sex-linked translocation strains for genetic control of the Australian sheep blowflyLuciliacuprina(Wiedemann).AustralianJournalofBiologicalSciences, 38: 275-293.
Foster G G. 1991. Chromosomal inversions and genetic control revisited: the use of inversions in sexing systems for higher Diptera.TheoreticalandAppliedGenetics, 81: 619-623.
Foster G G, Vogt W G, Woodburn T L and Smith P H. 1988. Computer simulation of genetic control. Comparison of sterile males and field-female killing systems.TheoreticalandAppliedGenetics, 76: 870-879.
Foster G G, Weller G L, James W J, Paschalidis K M and McKenzie L J. 1992. Advances in sheep blowfly genetic control in Australia∥ProceedingsofInternationalAtomicEnergyAgencySymposium:ManagementofInsectPests:NuclearandRelatedMolecularandGeneticTechniques. Vienna, Austria: IAEA, 299-312.
Franz G. 2005. Genetic sexing strains in Mediterranean fruit fly, an example for other species amenable to large-scale rearing for the sterile insect technique∥Dyck V A, Hendrich J and Robinson A S.PrinciplesandPracticeinArea-WideIntegratedPestManagement. The Netherlands: Springer, 427-451.
Franz G, Willhoeft U, Kerremans P, Hendrichs J and Rendón P. 1997. Development and application of genetic sexing systems for Mediterranean fruit fly based on a temperature sensitive lethal system∥IAEA.EvaluationofGeneticallyAlteredMedfliesforUseinSITProgrammes. Vienna: IAEA, 85-95.
Fraser M J. 2012. Insect transgenesis: current applications and future prospects.AnnualReviewofEntomology, 57: 267-289.
Gaj T, Gersbach C A and Barbas C F. 2013. ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering.TrendsBiotechnology, 31: 397-405.
Gong P, Epton M, Fu G, Scaife S, Hiscox A, Condon K, Condon G, Morrison N, Kelly D, Dafa′alla T, Coleman P and Alphey L. 2005. A dominant lethal genetic system for autocidal control of the Mediterranean fruit fly.NatureBiotechnology, 23: 453-456.
Gould F. 2008. Broadening the application of evolutionarily based genetic pest management.Evolution, 62: 500-510.
Gould F, Huang Y, Legros M and Lloyd A L. 2008. A killer-rescue system for self-limiting gene drive of anti-pathogen constructs.ProceedingsoftheRoyalSocietyofLondon, 275: 2823-2829.
Gould F and Schliekelman P. 2004. Population genetics of autocidal control and strain replacement.AnnualReviewofEntomology, 49: 193-217.
Guillén D and Sánchez R. 2007. Expansion of the National Fruit Fly Control Programme in Argentina∥Tan K H.AreaWideControlofFruitFliesandOtherInsectPests. Penang, Malaysia: Penerbit Universiti Sains, 653-660.
Hagler J R and Jackson C G. 2001. Methods of marking insects: current techniques and future prospects.AnnualReviewofEntomology, 46: 511-543.
Handler A M. 2011. A current perspective on insect gene transfer.InsectBiochemistryandMolecularBiology, 31: 111-128.
Harris A F, McKemey A R, Nimmo D, Curtis Z, Black I,etal. 2012. Successful suppression of a field mosquito population by sustained release of engineered male mosquitoes.NatureBiotechnology, 30: 828-830.
Harris A F, Nimmo D, McKemey A R, Kelly N, Scaife S, Donnelly C A, Beech C, Petrie W D and Alphey L. 2011. Field performance of engineered male mosquitoes.NatureBiotechnology, 29: 1034-1037.
Heinrich J C and Scott M J. 2000. A repressible female-specific lethal genetic system for making transgenic insect strains suitable for a sterile-release program.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 97: 8229-8232.
Hertwig O.1911. Die radiumkrankheit tierischer Keimzellen. Ein Beitrag zur experimentellen Zeugungs-und Vererbungslehre.ArchMikroskAnat, 77: 1-164.
Horber E. 1963. Eradication of the white grub (MelolonthavulgarisF.) by the sterile male technique∥FAO/IAEA:Proceedings,Symposium:RadiationandRadioisotopesAppliedtoInsectsofAgriculturalImportance. Vienna, Austria: IAEA, 313-332.
Horn C and Wimmer E A. 2003. A transgene-based, embryo-specific lethality system for insect pest management.NatureBiotechnology, 21: 64-70.
Jessup A J, Dominiak B, Woods B D E, Lima C P F, Tomkins A and Smallridge C J. 2007. Area-wide management of fruit flies in Australia∥Tan K H.AreaWideControlofFruitFliesandOtherInsectPests. Penang, Malaysia: Penerbit Universiti Sains, 685-697.
Jin L, Walker A S, Fu G L, Harvey-Samuel T, Dafa′alla T, Miles A, Marubbi T, Granville D, Humphrey-Jones N, O′Connell S, Morrison N I and Alphey L. 2013. Engineered female-specific lethality for control of pest Lepidoptera.ACSSyntheticBiology, 2: 160-166.
Klassen W and Curitis C F. 2005. History of the sterile insect technique∥Dyck V A, Hendrichs J and Robinson A S.SterileInsectTechnique:PrinciplesandPracticeinArea-WideIntegratedPestManagement. Dordrecht: Springer, 3-36.
Knipling E F. 1955. Possibilities of insect control or eradication through the use of sexually sterile males.JournalofEconomicEntomology, 48: 459-462.
Knipling E F. 1959. Sterile-male method of population control.Science, 130: 902-904.
Knipling E F. 1960. The eradication of the screw-worm.ScientificAmerican, 203: 54-61.
Lacroix R, McKemey A R, Raduan N, Wee L K, Ming W H, Ney T G, Siti Rahidah A A, Salman S, Subramaniam S, Nordin O, Norhaida Hanum A T, Angamuthu C, Mansor S M, Lees R S, Naish N, Scaife S, Gray P, Labbé G, Beech C, Nimmo D, Alphey L, Vasan S S, Lim L H, Nazni Wasi A and Murad S. 2012. Open field release of genetically engineered sterile maleAedesaegyptiin Malaysia.PLoSONE, 7: e42771.
Laven H, Cousserans J and Guille G. 1972. Eradicating mosquitoes using translocations: a first field experiment.Nature, 236: 456-457.
Liu Y C. 1993. Pre-harvest control of Oriental fruit fly and melon fly∥PlantQuarantineinAsiaandthePacific,ReportofAPOStudyMeeting,Taipei,China. Tokyo: Asian Productivity Organization, 73-76.
Loukeris T G, Livadaras J, Arco B, Zabalou S and Savakis C. 1995. Gene transfer into the medfly,Ceratitiscapitata, with aDrosophilahydeitransposable element.Science, 270: 2002-2005.
Lyttle T W. 1977. Experimental population genetics of meiotic drive systems. I. Pseudo-Y chromosomal drive as a means of eliminating cage populations ofDrosophilamelanogaster.Genetics, 86: 413-445.
Malavasi A, Nascimento A S, Paranhos B J, Costa M L Z and Walder J M M. 2007. Establishment of a Mediterranean fruit flyCeratitiscapitata, fruit fly parasitoids, and codling mothCydiapomonellarearing facility in north-rastern Brazil∥Tan K H.AreawideControlofFruitFliesandOtherInsectPests. Penang, Malaysia: Penerbit Universiti Sains, 527-534.
McInnis D O, Wong T T Y and Tam S Y T. 1986. Mediterranean fruit fly (Diptera: Tephritidae): suppression efficiencies of unisexual and bisexual sterilized release populations in field cages.AnnalsoftheEntomologicalSocietyofAmerica, 79: 931-937.
Morrison N I, Simmons G S, Fu G, O′Connell S, Walker A S, Dafa′alla T, Walters M, Claus J, Tang G L, Jin L, Marubbi T, Epton M J, Harris C L, Staten R T, Miller E, Miller T A and Alphey L. 2012. Engineered repressible lethality for controlling the pink bollworm, a Lepidopteran pest of cotton.PLoSONE, 7: e50922.
Muller H J. 1927. Artificial transmutation of the gene.Science, 66: 84-88.
North D T and Holt G G. 1970. Population control of Lepidoptera: the genetic and physiological basis.ManitobaEntomologist, 4: 53-69.
Orankanok W, Chinvinijkul S, Thanaphum S, Sitilob P and Enkerlin W R. 2007. Area-wide integrated control of oriental fruit flyBactroceradorsalisand guava fruit flyBactroceracorrectain Thailand∥Tan K H.AreaWideControlofFruitFliesandOtherInsectPests. Penang, Malaysia: Penerbit Universiti Sains, 517-526.
Patil P B, Reddy B P N, Gorman K, Reddy K V S, Barwale S R, Zehr U B, Nimmo D, Naish N and Alphey L. 2014. Mating competitiveness and life-table comparisons between transgenic and Indian wild-typeAedesaegyptiL.PestManagementScience, DOI: 10.1002/ps.3873.
Proverbs M D and Newton J R. 1962. Some effects of gammairradiation on the reproductive potential of the codling moth,Carpocapsapomonella(L.) (Lepidoptera: Olethreutidae).CanadaEntomology, 94: 1162-1170.
Rao T R. 1974. Research on genetic control of mosquitoes in India: review of the work of the WHO/ICMR research unit New Delhi.JournalofCommunicableDiseases, 6: 57-72.
Rendon P, McInnis D, Lance D and Stewart J. 2000. Comparison of medfly male only and bisexual releases in large scale field trials∥Tan K H.AreaWideControlofFruitFliesandOtherInsectPests. Penang, Malaysia: Penerbit Universiti Sains, 517-527.
Rendon P, McInnis D, Lance D and Stewart J. 2004. Medfly (Diptera: Tephritidae) genetic sexing: Large-scale field comparison of males-only and bisexual sterile fly releases in Guatemala.JournalofEconomicEntomology, 97: 1547-1553.
Robinson A S. 2002. Mutations and their use in insect control.MutationResearch, 511: 113-132.
Robinson A S, Franz G and Fisher K. 1999. Genetic sexing strains in the medfly,Ceratitiscapitata: development, mass rearing and field application.TrendsEntomology, 2: 81-104.
Rubin G M and Spradling A C. 1982. Genetic transformation ofDrosophilawith transposable element vectors.Science, 218:348-353.
Runner G A. 1916. Effects of roentgen rays on the tobacco or cigarette beetle and the results of an experiment with a new roentgen tube.TheJournalofAgriculturalResearch, 6: 383-388.
Schetelig M F, Scolari F, Handler A M, Kittelmann S, Gasperi G and Wimmer E A. 2009. Site-specific recombination for the modification of transgenic strains of the Mediterranean fruit flyCeratitiscapitata.ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 106: 18171-18176.
Schliekelman P and Gould F. 2000. Pest control by the release of insects carrying a female-killing allele on multiple loci.JournalofEconomicEntomology, 93: 1566-1579.
Shiga M. 1992. Future prospects for the eradication of fruit flies.TechnicalBulletinofFoodandFertilizerTechnologyCenter, 128: 1-12.
Simmons G S, McKemey A R, Morrison N I, O′Connell S, Tabashnik B E, Claus J, Fu G L, Tang G L, Sledge M, Walker A S, Phillips C E, Miller E D, Rose R I, Staten R T, Donnelly C A and Alphey L. 2011. Field performance of a genetically engineered strain of pink bollworm.PLoSONE, 6: e24110.
Sinkins S P and Gould F. 2006. Gene drive systems for insect disease vectors.NatureReviewsGenetics, 7: 427-435.
Steiner L F, Mitchell W C, Harris E J, Kozuma T T and Fujimoto M S. 1965. Oriental fruit fly eradication by male annihilation.JournalofEconomicEntomology, 58: 961-964.
Suguna S G and Curtis C F. 1974. Sex ratio distorter strains inAedesaegypti.JournalofCommunicableDiseases, 6: 102-105.
Suguna S G, Curtis C F, Kazmi S J, Singh K R P, Razdan R K and Sharma V P. 1977. Distorter double translocation heterozygote systems inAedesaegypti.Genetica, 47: 117-123.
Takken W, Olandunmade M A, Dengwat L, Feldmann H U, Onah J A, Tenabe S O and Hamann H J. 1986. The eradication ofGlossinapalpalis(Robineau-Desvoidy) (Diptera: Glossinidae) using traps, insecticide-impregnated targets and the sterile insect technique in central Nigeria.BulletinofEntomologicalResearch, 76: 275-286.
Thomas D D, Donnelly C A, Wood R J and Alphey L S. 2000. Insect population control using a dominant, repressible, lethal genetic system.Science, 287: 2474-2476.
Vanderplank F L. 1944. Hybridization betweenGlossinaspecies and suggested new method for control of certain species of tsetse.Nature, 154: 607-608.
Vreysen M J B. 2001. Principles of area-wide integrated tsetse fly control using the sterile insect technique.MedicineforTropics, 61: 397-411.
Vreysen M J B, Saleh K M, Ali M Y, Abdulla A M, Zhu Z R, Juma K G, Dyck A, Msangi A, Mkonyi P A and Feldmann H U. 2000.Glossinaausteni(Diptera: Glossinidae) eradicated on the island of Unguja, Zanzibar, using the sterile insect technique.JournalofEconomicEntomology, 93: 123-135.
Walters M L, Staten R T and Roberson R C. 2000. Pink bollworm integrated management using sterile insects under field trial conditions. Imperial Valley, California∥Tan K H.AreaWideControlofFruitFliesandOtherInsectPests. Penang, Malaysia: Penerbit Universiti Sains Malaysia, 201-206.
Whitten M J. 1969. Automated sexing of pupae and its usefulness in control by sterile insects.JournalofEconomicEntomology, 62: 272-273.
Willhoeft U and Franz G. 1996. Identification of the sex-determining region of theCeratitiscapitataY chromosome by deletion mapping.Genetics, 144: 737-745.
Wyss J H. 2000. Screwworm eradication in the Americas — Overview∥Tan K H.Area-WideControlofFruitFliesandOtherInsectPests. Penang, Malaysia: Penerbit Universiti Sains Malaysia, 79-86.
Yen J H and Barr A R. 1971. New hypothesis of the cause of cytoplasmic incompatibility inCulexpipiens.Nature, 232: 657-658.
(责任编辑:杨郁霞)
1State Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection, Chinese Academy of Agricultural
Sciences,Beijing100193,China;2Department of Entomology, North Carolina State University, Campus Box 7613, Raleigh,
NC27695-7613,USA;3Genetic Engineering and Society Center and W. M. Keck Center for Behavioral Biology,
NorthCarolinaStateUniversity,Raleigh,NC27695-7613,USA;4Center for Management
ofInvasiveAlienSpecies,MinistryofAgriculture,Beijing100193,China
Abstract:Genetic pest management (GPM) is one of the most efficient methods to control or eradicate insect pests and has been carried out worldwide with notable successes. Some classic GPM strategies including the sterile insect technology (SIT), female killing system (FKS) and release of insects carrying dominant lethality (RIDL) are reviewed here. The development history, technical characters and application of SIT, FKS and RIDL technologies are introduced. In recent years, many new molecular or biological tools like the homing endonuclease gene, zinc-finger nucleases, transcription activator-like effector nucleases, CRISPR/Cas9 system, medea element, the killer-rescue system and the Wolbachia-cytoplasmic incompatibility system were proposed to improve GPM efficiency. Some new tools were already used in control programs as next generation GPM strategies in some countries. The GPM practice in China is limited, and both basic and applied research on GPM should be enhanced, as the GPM technology can help with the sustainable management of some major pests and contribute to food production and human health in China.
Key words:insect sterile technique; mass rearing; chromosome translocation; genetic sexing strain; transposon
通讯作者*(Author for correspondence), E-mail: wanfanghao@ieda.org.cn
作者简介:申建茹, 女, 博士后。 研究方向: 入侵昆虫抗逆性生物防治。 E-mail: sjrhappy2008@126.com
基金项目:国家“973”计划项目(2009CB119200); 国家“十一五”科技支撑计划课题(2006BAD08A18); 农业部农作物病虫害疫情监测与防治项目(2003-2015); 中国农科院科技创新工程(2013-2015); 人力资源社会保障部2014年度留学人员科技活动择优资助项目
收稿日期(Received): 2014-12-02接受日期(Accepted): 2015-03-20
DOI:10. 3969/j.issn.2095-1787.2015.02.002

