乙肝病毒感染与B淋巴瘤患者利妥昔单抗联合CHOP化疗后的临床观察
张美霞,徐细明(武汉大学人民医院肿瘤中心,武汉 430060;通讯作者,E-mail:2981806387@qq.com)
非霍奇金淋巴瘤(NHL)是恶性淋巴瘤的一大类型,在中国恶性淋巴瘤中非霍奇金淋巴瘤所占的比例远高于霍奇金病,其中B细胞淋巴瘤所占的比例最大。越来越多的研究表明,非霍奇金淋巴瘤与乙型肝炎的感染存在一定的联系[1-3]。近年来,由于利妥昔单抗(美罗华)的广泛应用,NHL治疗效果有明显的改善,显著提高了临床缓解率和长期生存率,但相关毒副反应也引起关注,特别是感染乙肝病毒的患者,将面临乙肝病毒被激活的问题。本文回顾性分析了我科给予利妥昔单抗联合CHOP方案治疗乙肝病毒感染合并B淋巴瘤的临床疗效及安全性。
1 资料与方法
1.1 一般资料
回顾性分析我院2005-2013年在我科住院的经病理检查确诊,并经免疫表型证实为CD20(+)并伴HBsAg+的B细胞淋巴瘤患者108例,且全部采用R-CHOP方案进行化疗,疗程为2-10周期不等,平均疗程为5周期;临床分期采用Ann Arbor分期:Ⅰ期 29 例(26.9%),Ⅱ期 39 例(36.1%),Ⅲ期28 例(26.0%),Ⅳ期12 例(11.1%);根据淋巴组织病理活检结果:弥漫大B细胞性82例,滤泡性8例,套细胞性6例,淋巴浆细胞性5例,其他或未分型7例;初治73例,复治35例;所有患者化疗前经血清学检查并提示未合并甲型、丙型等其他病毒性肝炎;腹部超声或CT排除肝脏受侵及肝硬化,无其他严重合并症,均可评价疗效;KPS(卡式行为状况评分)>60,预计生存时间>6个月。一般情况详见表1。
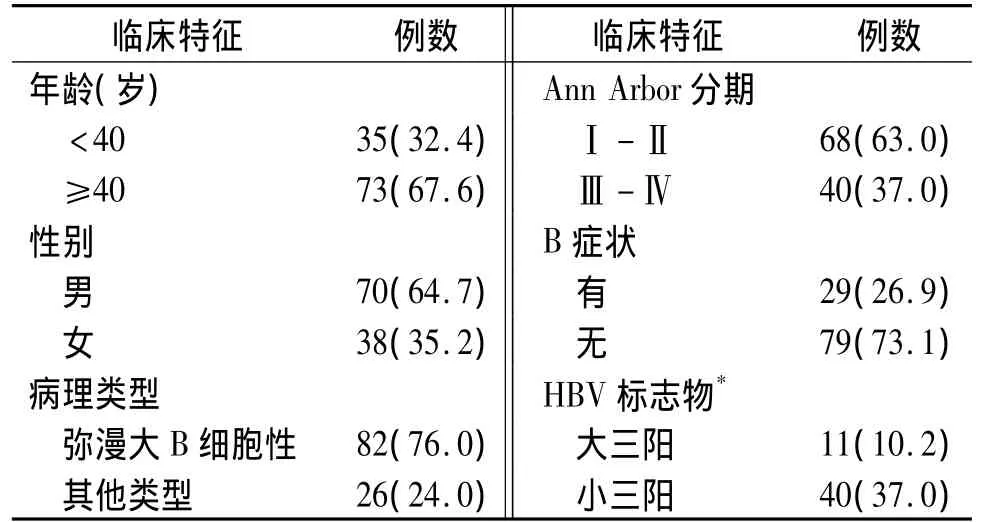
表1 美罗华联合CHOP方案治疗HBsAg+的B细胞淋巴瘤108例患者的一般资料 例(%)Table 1 The general information of 108 HBsAg+patients with B cell lym phoma treated with mabthera in com bination with CHOP regimen cases(%)
1.2 治疗方法
采取R-CHOP方案(利妥昔单抗+环磷酰胺+表柔比星+长春新碱+泼尼松)一线化疗,早期(Ⅰ、Ⅱ期)患者接受2-6个周期化疗和受累野放疗,晚期(Ⅲ、Ⅳ期)患者接受6-10个周期化疗和残留病灶或巨块处放疗;每治疗3周为一周期,化疗周期≥2周期;所有病例在应用利妥昔单抗前给予地塞米松或酚妥拉明预防过敏;初次化疗前及每个周期化疗后均进行肝功能等相关血清学检查;肝功能异常者采用护肝治疗,包括甘草酸类、谷胱甘肽及磷酯酰胆碱类等,直至肝功能恢复正常后方可继续下一个周期的治疗;化疗期间出现肝功能损害,经诊断确认为乙肝病毒再激活,给予拉米夫定抗病毒及护肝等对症治疗。
1.3 血清学检查项目
所有患者治疗前均用血清学酶联免疫法进行乙肝标志物检测,包括 HBsAg、HBsAb、HBeAg、HBeAb和HBcAb;所有患者治疗前及每个化疗周期前后均接受肝功能检查,包括谷丙转氨酶(ALT)、谷草转氨酶(AST)、胆红素(TBIL)、白蛋白(ALB)等;治疗中发现肝功能异常时检查HBV血清学及HBVDNA。所有化疗结束后,第1-3年每3个月复查血常规、肝肾功能及CT或超声,第4-5年每6个月复查肝功能,有症状时随时复查。
1.4 疗效及肝功能损害判定标准
按国际淋巴瘤工作组(IWG)疗效标准[4]评定疗效,分别为完全缓解(complete response,CR):肿瘤完全消失并至少维持4周以上;部分缓解(partial response,PR):肿瘤病灶的最大径及其最大垂直径(两径)的乘积减少50%以上,并维持4周以上,无新的病变出现;疾病稳定(stable disease,SD):肿瘤病灶的两径乘积缩小50%以下或增大25%以下,无新的病变出现;疾病进展(progressive disease,PD):肿瘤病灶的两径乘积增大25%以上或出现新的病灶。CR和PR视为总有效率,SD和PD视为无效。入组治疗后6个月、9个月、12个月,KPS评分评价化疗后生活质量,化疗4个月后评价血清学肝功能变化及肝功能损害程度。评价肝功能损害判定标准参照WHO肝损害生化判定标准[5]:丙氨酸氨基转移酶(ALT)或天冬氨酸氨基转移酶(AST)或总胆红素(TBILI)<1.25 倍正常上限为0 度;1.26-2.50倍正常上限为Ⅰ度;2.60-5.0 倍正常上限为Ⅱ度;5.10-10.0倍正常Ⅲ或绝对值达到1×109copies/ml,并且临床及实验室检查排除HAV、HCV或其他病毒性肝炎感染,可认为乙肝病毒再激活[6];化疗延迟:因肝功能损害使下一个周期化疗延迟10 d以上。
1.5 统计学方法
采用SPSS 17.0软件进行数据的统计学分析,t检验分析化疗前后血清学肝功能变化,化疗前后生活质量用F检验,两样本率的比较用χ2检验。检验水准a=0.05,以P<0.05表示差异有统计学意义。
2 结果
2.1 近期疗效
所有患者至少化疗2个周期,中位化疗5周期(2-10周期),化疗2周期后可评价近期疗效,总有效率(CR+PR)83例(76.9%),其中 CR 29例(26.9%)、PR 54 例(50.0%)、SD 14 例(13.0%)、PD 11 例(10.2%)。
2.2 生活质量
根据治疗前后计分值 Karuafsry[7]的变化对生活质量评分(KPS评分)进行评定。化疗后6个月、9个月及12个月的KPS评分均高于化疗前(F=3.123,P=0.029,见表 2),说明联合化疗后患者的生活质量有明显提高。
2.3 肝功损害程度
108例患者中有77例(71.3%)在化疗4个月后发生了不同程度的肝功能损害。其中I度20例(25.9%),Ⅱ度17 例(22.1%),Ⅲ度 10 例(13.0%),无一例Ⅳ度肝功能损害,提示联合化疗可能对肝功能具有一定的副作用,化疗前后肝功能损害程度比较差异具有统计学意义(P<0.05,见表3)。通过监测患者化疗前及化疗后4个月的血清学肝功能变化可以得知,联合化疗后患者的谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)都有明显上升,白蛋白(ALB)则下降(P<0.05,见表4),提示化疗后肝功能有所损害。本组均无因化疗而死亡病例,化疗后有2例发生了乙肝病毒再激活HBV-DNA>3.2 ×109copies/ml,经过抗病毒、护肝、降酶、退黄等保肝治疗后肝功能均恢复正常,但因肝功能损害使下一个周期化疗延迟。其余出现肝功能损害病例经鉴定均未发生乙肝病毒再激活,经护肝治疗,待肝功能恢复正常后方进入下一周期化疗。
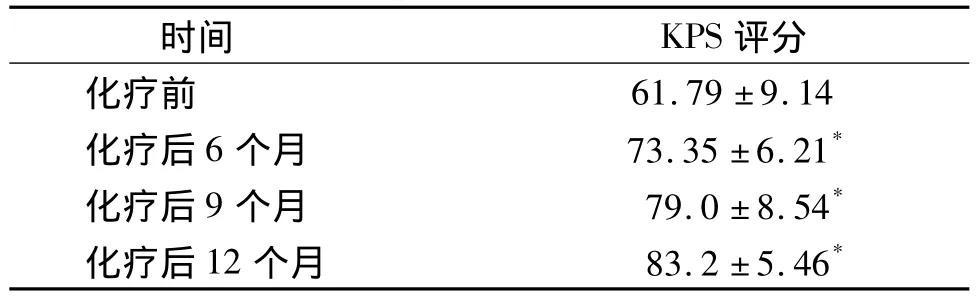
表2 化疗前后生活质量的变化Table 2 The changes of quality of life before and after chemotherapy

表3 化疗前后肝功能损害程度比较 例(%)Table 3 Com parison of liver function damage degree before and after chemotherapy cases(%)

表4 化疗前后血清学肝功能变化Table 4 The changes of serological liver function before and after chemotherapy
2.4 不良反应
其他不良反应主要表现在骨髓抑制,Ⅰ、Ⅱ度骨髓抑制56 例(51.9%),Ⅲ、Ⅳ度 34 例(31.5%),与美罗华相关的发热、寒战、血压下降、皮疹、胸闷、关节疼痛等过敏反应,在预防性应用地塞米松或酚妥拉明后明显减少,只有3例出现轻度发热,2例出现皮疹症状,均予以对症治疗后恢复。
3 讨论
近年来,淋巴瘤发病率呈现逐年增长的趋势,以B细胞淋巴瘤为主的非霍奇金淋巴瘤(B-NHL)占绝大部分。随着治疗手段的发展,针对B细胞的表面分子CD20的单克隆抗体利妥昔单抗(美罗华)的问世,B细胞淋巴瘤的治疗效果明显提高。1997年11月美国食品药品管理局(FDA)批准美罗华用于CD20阳性的恶性淋巴瘤治疗,美罗华成为首个肿瘤治疗的单克隆抗体[8]。近年,美罗华已广泛用于临床,利妥昔单抗联合CHOP方案(R-CHOP)作为一线治疗B细胞淋巴瘤的治疗手段已得到广泛认可。
相关文献表明[9,10],二者联合使 B-NHL 的治疗效果有明显的改善,延长病人的无进展生存(PFS)和总生存(OS),提高生活质量,但相关毒副反应也引起关注,特别是乙肝表面抗原阳性患者的病毒再激活问题,有研究表明R-CHOP方案可增加淋巴瘤患者HBV再激活的风险。也有报道表明,合并HBV的NHL患者,在化疗联合利妥昔单抗方案治疗后,HBV再激活的概率为50%,其相关死亡率为2%[11];我国是HBV感染高发国家,2006年全国乙型肝炎流行病学调查证实,我国15-59岁一般人群HBsAg 携带率为 8.75%[12,13]。Wang 等[14]报道,乙型肝炎病毒表面抗原(hepatitis B virus surface antigen,HBsAg)阳性的恶性淋巴瘤患者化疗后肝功能损害发生率明显高于HBsAg阴性者。
本研究回顾性分析我院2005-2013年在我科住院的经病理检查确诊,并经免疫表型证实为CD20(+)并伴HBsAg+的B细胞淋巴瘤患者。所有患者全部给予利妥昔单抗联合CHOP方案进行治疗,效果明显,患者B症状(发热、体重减轻、盗汗、鼻塞、咽痛、咳嗽、呼吸困难、皮肤红斑等)基本消失,生活质量较化疗前提高(P<0.05);而不良反应主要表现在肝功能异常,化疗前后肝功能损害程度及血清学肝功能变化的差异均具有统计学意义(P<0.01)。HBV感染者或者携带者的B细胞淋巴瘤患者中,经过化疗后,多数会有不同的肝功能损害,肝功能异常主要集中在Ⅰ-Ⅲ度,未发现有Ⅳ度肝功能异常者,也未有因爆发性肝炎死亡病例。肝功能异常的患者经过对症保肝治疗后,均能在下个周期化疗前恢复正常,对于2例乙肝病毒再激活者,给予拉米夫定抗病毒及护肝治疗后,肝功能基本恢复正常,继续下一周期化疗,未出现因肝功能异常而终止化疗者。乙肝病毒再激活的原因可能为化疗清除了体内的B淋巴细胞,免疫功能短暂缺失,体内的肝炎病毒大量复制,导致感染的肝细胞坏死[15],一般轻度肝功能损害会使转氨酶升高,出现黄疸等临床症状表现,较严重的肝损害有肝衰竭、爆发性肝炎甚至死亡。其他不良反应表现在骨髓抑制(83.3%),Ⅰ、Ⅱ度骨髓抑制56例(51.9%),Ⅲ、Ⅳ度 34例(31.5%),只有3例出现轻度发热,2例出现皮疹症状,均予以对症治疗后恢复。
从本研究可以看出,对于HBV阳性的B细胞淋巴瘤患者,采用利妥昔单抗联合CHOP方案疗效好,安全性高,能提高改善生活质量,延长生存期,不易耐药。对于化疗期间发生的肝功能损害,给予护肝对症治疗,肝功能可以恢复,并不影响进一步的化疗。我们也可以看出,当发生乙肝肝炎再激活时,及时给予拉米夫定抗病毒、护肝、退黄等对症治疗后,肝功能也可以恢复正常。目前也有报道认为利妥昔单抗联合化疗前预防性应用抗病毒药物可以减少HBV的大量复制,从而减少免疫功能恢复时由强烈的抗原抗体反应介导的肝功能损害[16],而2010年我国肝炎防治指南中也指出,对于因其他疾病而接受化疗、免疫抑制剂治疗的HBsAg阳性携带者,即使HBV-DNA阴性或肝功能正常,也需要在治疗前1周预防性应用拉米夫定或其他抗病毒药物。提示我们在临床工作中,在使用利妥昔单抗联合化疗时,在预防性应用拉米夫定抗病毒的同时,应该严密监测肝功能及HBV-DNA,一旦发现异常,应及时给予对症处理。总之,对于HBV阳性的B细胞淋巴瘤,利妥昔单抗联合化疗仍为首选治疗方案,免疫化疗仍然安全有效。
[1]Anderson LA,Pfeiffer R,Warren JL,et al.Hematopoietic malignancies associated with viral and alcoholic hepatitis[J].Cancer Epidemiol Biomarkers Prey,2008,17(11):3069-3075.
[2]Uleiekas Yood M,Quesenberry CP,Guo D,et al.Incidence of non-Hodgkin’s lymphoma among individuals with chronic hepatitisB virus infection[J].Hepatology,2007,46(1):107-112.
[3]Fwu CW,Chien YC,Nelson KE,et al.Mortalityafter chronic hepatitis B virus infection:alinkage study involving 2 millionparous women from taiwan[J].J Infect Dis,2010,201(7):1016-1023.
[4]Cheson BD,Horning SJ,Coiffier B,et al.Report of an international workshop to standardize response criteria for non-Hodgkin’s lymphomas[J].J Clin Oncol,1999,17(4):1244-1253.
[5]Perry MC.Hepatotoxicity of chemotherapeutic agents[J].Semin Oncol,1982,9(1):65-74.
[6]Yeo W,Chan TC,Leung NW,et al.Hepatitis B virus reactivation in lymphoma patients with prior resolved hepatitis B undergoing anticancer therapy with or without rituximab[J].J Clin Oncol,2009,27(4):605-611.
[7] 周际昌.实用肿瘤内科学[M].北京:人民卫生出版社,1999:22-35.
[8]Forero A,Lobuglio AF.History of antibody therapy for non-Hodgkin’s lymphoma[J].Semin Oncol,2003,30(6 Suppl 17):1-5.
[9]富博.用美罗华治疗恶性淋巴瘤发现亚急性肝坏死1例报告[J].中国工业医学杂志,2003,16(4):198-198.
[10]Soong YL,Lee KM,Lui HF,et al.Hepatitis B reactivation in a patient receiving radio labeled rituximab[J].Ann Hematol,2005,84(1):61-62.
[11]李小亮,王玫玫,朱卫健,等.利妥昔单抗联合CTOP化疗治疗感染乙肝病毒恶性淋巴瘤的临床观察[J].广东医学,2012,33(18):2836-2837.
[12]Liang X,Bi S,Yang W,et al.Epidemiological serosurvey of hepatitis B in China:declining HBV prevalence due to hepatitis B vaccination[J].Vaccine,2009,27(47):6550-6557.
[13]Liang X,Bi S,Yang W,et al.Evaluation of the impact of hepatitis B vaccination among children born during 1992-20O5 in China[J].J Infect Dis,2009,200(1):39-47.
[14]Wang F,Xu RH,Luo HY,et al.Clinical and prognostic analysis of hepatitis B virus infection in diffuse large B-cell lymphoma[J].BMC Cancer,2008,8:115.
[15]Kusumoto S,Tanaka Y,Mizokami M,et al.Reactivation of hepatitis B virus following systemic chemotherapy for malignant lymphoma[J].Int J Hematol,2009,90(1):13-23.
[16]Tsutsumi Y,Tanaka J,Kawamura T,et al.Possible efficacy of lamivudine treatment to prevent hepatitis B virus reactivation due to rituximab therapy in a patient with non-Hodgkin’s lymphoma[J].Ann Hematol,2004,83(1):58-60.

