己酮可可碱预处理对硫代乙酰胺致大鼠急性肝损伤的影响
罗妙莎,董 蕾,郭晓燕,李 晶,秦 斌(西安交通大学第二附属医院消化内科,西安 710004;通讯作者,E-mail:dong556@126.com)
急性肝损伤(acute liver injury)是由多种原因引发肝细胞炎症坏死,肝脏的解毒、合成、排泄、生物转化等功能发生障碍,引起以凝血功能障碍、黄疸、腹水、肝性脑病等症状为特征的临床综合征。目前多采取综合治疗,包括去除病因、对症支持、调节免疫功能以及防治各种并发症的发生等[1],但疗效均不满意。己酮可可碱(pentoxifylline,PTX)是甲基黄嘌呤的衍生物,是一种非选择性磷酸二酯酶抑制剂,其具有改善血流动力学、改善组织细胞功能、抗炎、抗氧化以及抗纤维化等作用。研究表明,己酮可可碱对酒精性肝炎、非酒精性脂肪肝、肝纤维化均有一定的治疗作用[2-4],但其对急性肝损伤作用的研究则较少报道。本实验旨在利用不同剂量己酮可可碱对大鼠进行预处理,观察其对硫代乙酰胺诱导的大鼠肝脏损伤的影响并探讨其可能作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康SPF级SD大鼠60只,雌雄各半,体重(200±20)g,由西安交通大学医学部实验动物中心提供,实验动物生产许可证号:SCXK(陕)08-018。所有动物实验均符合西安交通大学医学部动物实验中心管理委员会有关动物管理和使用的规定。
1.1.2 药品与试剂 己酮可可碱(pentoxifylline,PTX)、硫代乙酰胺(thioacetamide,TAA)均购自美国Sigma公司,联苯双酯(bifendate)购自北京协和制药厂,丙二醛(MDA)测定试剂盒、超氧化物歧化酶(SOD)测定试剂盒、还原型谷胱甘肽(GSH)测定试剂盒均购自南京建成生物工程研究所,实验用其余试剂均为分析纯。
1.2 实验方法
1.2.1 动物模型制备及给药方案 普通饲料适应性喂养SD大鼠1周,自由饮食饮水,温度为20-25℃,湿度为(50±5)%,光照周期为12 h∶12 h。1周后随机分为6组:正常对照组,急性肝损伤模型组,联苯双酯[100 mg/(kg·d)]阳性对照组,己酮可可碱低[50 mg/(kg·d)]、中[100 mg/(kg·d)]、高[200 mg/(kg·d)]剂量干预组,每组10只,雌雄各半。给药方案:从实验第1天起,低、中、高剂量干预组大鼠分别给予 PTX 50,100,200 mg/(kg·d)灌胃干预[5],阳性药物组给予联苯双酯100 mg/(kg·d)灌胃干预,模型组及正常组给予蒸馏水10 ml/(kg·d)灌胃,连续10 d;实验第11天,模型组、阳性药物组及低、中、高剂量干预组给予TAA 300 mg/kg腹腔注射[6],正常组给予等体积生理盐水7.5 ml/kg腹腔注射。24 h后,给予10%的水合氯醛3-4 ml/kg腹腔注射麻醉处死各组大鼠。
1.2.2 血清指标检测 大鼠麻醉后开腹,常规腹主动脉取血5 ml,应用全自动生化分析仪检测丙氨酸氨基转移酶(ALT)及门冬氨酸氨基转移酶(AST)。
1.2.3 肝组织指标检测 取相同部位的肝左叶组织,在冰生理盐水中漂洗后,滤纸拭干,用组织匀浆器将肝组织制成10%的匀浆,离心后取上清,测定丙二醛(MDA)、超氧化物歧化酶(SOD)、还原型谷胱甘肽(GSH)的含量,以上各指标的测定操作步骤均按相关试剂盒说明书进行。
1.2.4 肝组织病理学检查 取肝组织做横断面取材,置于4%的多聚甲醛溶液中固定,石蜡包埋,切片,苏木精-伊红(HE)染色,并在光学显微镜下观察肝组织病理改变。
1.3 统计学分析
采用SPSS 19.0统计软件进行数据分析,计量资料采用±s表示,在满足正态性及方差齐性的条件下,组间比较采用单因素方差分析及LSD-t检验;不满足正态性和方差齐性的条件时,采用Mann-Whitney U检验。P<0.05为差异具有统计学意义。
2 结果
2.1 血清中ALT、AST的含量
与正常组相比,模型组大鼠血清ALT、AST含量明显升高,差异具有统计学意义(P<0.01);与模型组相比,阳性对照组及中、高剂量干预组血清ALT、AST均明显下降,差异有统计学意义(P<0.01),低剂量干预组ALT、AST虽有所下降,但其差异无统计学意义(P>0.05);与阳性药物组相比,中、高剂量干预组血清 ALT、AST差异无统计学意义(P>0.05,见图1)。
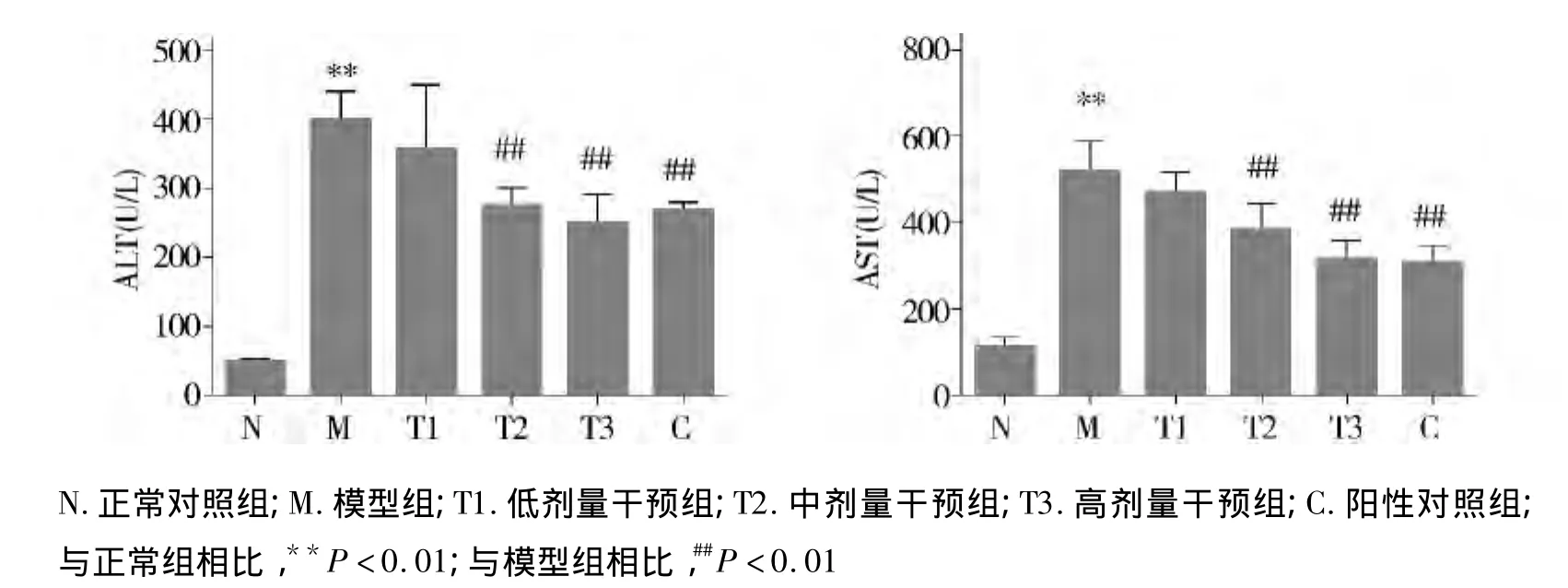
图1 各组大鼠血清中ALT、AST的浓度比较Figure 1 The serum contents of ALT and AST in each group
2.2 肝组织中MDA、SOD、GSH的含量
与正常组相比,模型组小鼠肝组织匀浆中MDA水平显著升高,同时SOD、GSH水平显著下降,差异具有统计学意义(P<0.01)。与模型组相比,阳性药物组及中、高剂量干预组MDA均显著下降,差异有统计学意义(P<0.01),SOD、GSH 水平升高,差异有统计学意义(P<0.05),低剂量干预组虽MDA下降且SOD、GSH水平升高,但其差异无统计学意义(P>0.05);与阳性药物组相比,中、高剂量干预组肝组织中MDA、SOD、GSH的含量变化差异无统计学意义(P >0.05,见图2)。
2.3 肝组织病理学检查
2.3.1 肉眼观察 正常组大鼠肝脏外观呈现深红色,表面光滑,边缘锐利,质地柔软,富有弹性;模型组及低剂量干预组大鼠肝脏表面有瘀血点,肝脏包膜无光泽;阳性药物组及中、高剂量干预组肝脏变化介于上述两种表现之间,较模型组肝脏变化明显好转。
2.3.2 光镜下观察 正常组肝小叶结构完整,以中央静脉为中心呈现放射状排列,肝索排列整齐,肝细胞无变性及坏死,肝小叶及汇管区无炎细胞浸润。模型组小叶结构破坏,肝细胞肿胀,细胞质疏松化,炎性细胞浸润;阳性药物组及中、高剂量干预组肝小叶结构较完整,肝细胞水肿较轻;低剂量干预组肝组织镜下表现介于以上两种表现之间(图3,见第502页)。
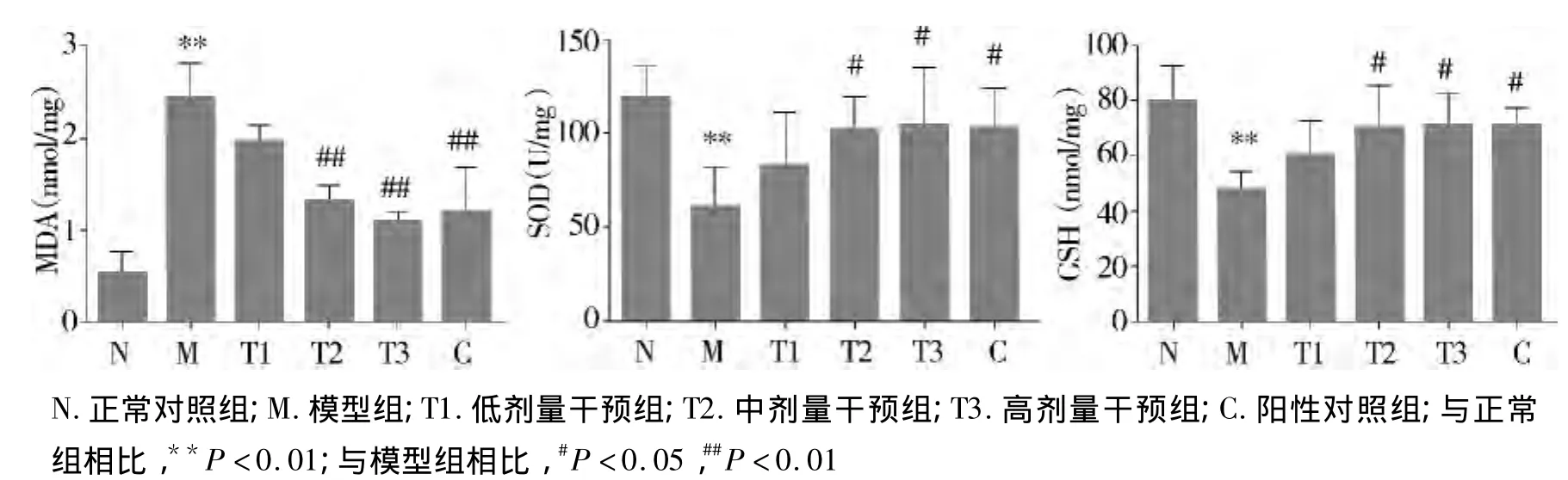
图2 各组大鼠肝组织匀浆中MDA、SOD、GSH的浓度比较Figure 2 The contents of MDA,SOD and GSH in liver tissues of each group
3 讨论
急性肝损伤时引发肝细胞炎症或坏死,并继发后续一系列病理过程,因而保护肝细胞,可减少各种有害因素对肝脏的损伤。己酮可可碱(PTX)是一种非选择性磷酸二酯酶抑制剂,因其具有扩血管、改善微循环、改善细胞缺氧、抗炎、抗氧化以及免疫调节等作用,已被研究证实能有效预防和改善脑缺血、肺纤维化、肝纤维化、脂肪肝、酒精性肝病等疾病[7]。本研究通过硫代乙酰胺(TAA)复制急性肝损伤模型,证实己酮可可碱预处理对大鼠急性肝损伤有一定的保护作用。
TAA诱导的急性肝损伤与人类肝损伤特点较为接近,能很好地反映人类肝损伤实际的情况。TAA可使血清ALT、AST水平显著升高,病理学提示肝细胞变性坏死,肝脏病理学变化也较为均一[8],因此被广泛应用于肝损伤的机制研究中。本研究结果显示,与正常对照组相比较,模型组血清中AST、ALT含量及肝组织中MDA水平明显升高,而肝组织中SOD、GSH水平显著降低(P<0.01);肝脏病理学检查提示,模型组肝脏结构破坏,出现炎性细胞浸润,这与以往研究中 TAA造模的结果相一致[6],提示本实验中TAA诱导的大鼠急性肝损伤模型是可行的。
丙氨酸氨基转移酶(ALT)及门冬氨酸氨基转移酶(AST)通常存在于正常肝细胞内,当肝细胞受损破裂时外排入血,是常用的反映肝实质损伤的酶学指标。本研究结果显示,PTX中、高剂量预处理干预后,大鼠血清AST、ALT水平显著降低。肝组织病理学检查证实肝小叶结构较完整,肝细胞水肿减轻,效果与联苯双酯阳性药物对照组接近,提示PTX预处理可有效减轻TAA诱导的大鼠急性肝损伤,且具有一定的剂量依赖性。此外,既往研究证实己酮可可碱还可有效改善慢性肝损伤的肝脏病理变化,延缓慢性肝损伤的发生、发展,对慢性肝损伤也有一定的治疗作用[9,10]。
急性肝损伤发生的机制颇为复杂,各种有害因素作用于肝脏,产生有毒中间代谢产物损伤肝脏,例如改变细胞膜的完整性、细胞线粒体功能失调、细胞内外离子浓度变化、降解肝酶的活性、自由基的作用等,同时也可诱发免疫机制,通过补体、细胞因子及免疫变态反应等产生损伤,以往的研究显示,氧化应激在肝损伤中发挥着重要作用[11]。氧化应激是由于自由基生成与清除平衡被破坏,导致自由基及其代谢产物蓄积,这些自由基可激活磷脂酶发生脂质过氧化反应,致使过氧化的终产物MDA等增加,体内抗氧化及抗脂质过氧化作用成分如SOD、GSH等含量下降,造成肝细胞变性坏死,肝功能受损[12]。因此,通过联合检测MDA、SOD及GSH的含量,可以反映机体细胞受到自由基攻击的严重程度。实验研究及临床研究显示,PTX可促进氧化和抗氧化机制平衡的恢复,阻断自由基链式反应,使细胞结构及功能恢复正常[5,13-15]。本研究结果显示,与模型组相比,PTX中、高剂量预处理能够增加大鼠肝组织中SOD及GSH水平并显著降低MDA含量。因此我们推测PTX可能通过增强体内的抗氧化剂活性,减轻脂质过氧化作用,改善体内自由基生成和清除系统的平衡状态,从而减轻肝细胞的损伤,对急性肝损伤大鼠起到一定保护作用。但本研究中并未涉及己酮可可碱增强急性肝损伤中抗氧化应激作用的具体机制,有待进一步的研究。
本研究结果显示,PTX可通过清除体内过多自由基及减轻脂质过氧化作用,减少肝细胞的损伤,改善肝组织的病理变化,从而对急性肝损伤的发生、发展起到一定的抑制作用。综上所述,PTX具有治疗急性肝损伤的潜在价值,为应用于临床治疗急性肝损伤提供了理论依据。
[1]冯艺萍.天然药物抗急性肝损伤研究进展[J].现代医药卫生,2011,21(4):3282-3284.
[2]Parker R,Armstrong MJ,Corbett C,et al.Systematic review:pentoxifylline for the treatment of severe alcoholic hepatitis[J].Aliment Pharmacol Ther,2013,37(9):845-854.
[3]Li W,Zheng L,Sheng C,et al.Systematic review on the treatment of pentoxifylline in patients with non-alcoholic fatty liver disease[J].Lipids Health Dis,2011,10(8):49-59.
[4]Movassaghi S,Sharifi ZN,Mohammadzadeh F,et al.Pentoxifylline protects the rat liver against fibrosis and apoptosis induced by acute administration of 3,4-Methylenedioxymethamphetamine(MDMA or Ecstasy)[J].Iran J Basic Med Sci,2013,16(8):922-927.
[5]Ahmed AF,El-Maraghy NN,Ghaney RHA,et al.Therapeutic effect of captopril,pentoxifylline,and cordycepssinensis in pre-hepatic portal hypertensive rats[J].Saudi J Gastroenterol,2012,18(3):182-187.
[6]Salam OMEA,Mohammed NA,Sleem AA,et al.The effect of antidepressant drugs on thioacetamide-induced oxidative stress[J].Eur Rev Med Pharmacol Sci,2013,17(6):735-744.
[7]屈耀宁,董蕾,史海涛,等.己酮可可碱对小鼠酒精性肝病酒精代谢酶和核受体PPAR-α的影响[J].实用肝脏病杂志,2014,17(2):163-167.
[8]张琪,陈辉,彭顺利,等.急性肝损伤动物模型制备研究进展[J].吉林医药学院学报,2011,38(4):216-220.
[9]Raetsch C,Jia JD,Boigk G,et al.Pentoxifylline downregulates profibrogenic cytokines and procollagen I expression in rat secondary biliary fibrosis[J].Gut,2002,50(2):241-247.
[10]Andrade W,Tannuri U,Silva LF,et al.Effects of the administration of pentoxifylline and prednisolone on the evolution of portal fibrogenesis secondary to biliary obstruction-an experimental study in growing animals[J].J Pediatr Surg,2009,44(11):2071-2077.
[11]Wu Z,Han M,Chen T,et al.Acute liver failure:mechanisms of immune-mediated liver injury[J].Liver Int,2010,30(6):782-794.
[12]Dai N,Zou Y,Zhu L,et al.Antioxidant properties of proanthocyanidins attenuate carbon tetrachloride(CCl4)-induced steatosis and liver injury in rats via CYP2E1 regulation[J].J Med Food,2014,17(6):663-669.
[13]El-Lakkany N,Seif el-Din S,Ebeid F.The use of pentoxifylline as adjuvant therapy with praziquantel downregulates profibrogenic cytokines,collagen deposition and oxidative stress in experimental schistosomiasis mansoni[J].Exp Parasitol,2011,129(2):152-157.
[14]Chae MK,Park SG,Song SO,et al.Pentoxifylline attenuates methionine-and choline-deficient-diet-induced steatohepatitis by suppressing TNF-α expression and endoplasmic reticulum stress[J].Exp Diabetes Res,2012,2012:762565.
[15]Wu J,Zhao M,Zheng H,et al.Pentoxifylline alleviates high-fat diet-induced non-alcoholic steatohepatitis and early atherosclerosis in rats by inhibiting AGE and RAGE expression[J].Acta Pharmacol Sin,2010,31(10):1367-1375.

