谷氧还蛋白在牙龈卟啉单胞菌脂多糖诱导脐静脉内皮细胞氧化应激中的作用
申道南 成伟 贾岳 赵蕾 吴亚菲
口腔疾病研究国家重点实验室 华西口腔医院牙周病科(四川大学),成都 610041
牙龈卟啉单胞菌是慢性牙周炎的主要致病菌,脂多糖(lipopolysaccharide,LPS)是其最重要的毒力因子之一[1]。牙龈卟啉单胞菌及其毒性产物能黏附并侵入到血管内壁中,参与心血管疾病的形成和发展[2-3]。氧化应激(oxidative stress,OS)是由于机体组织或细胞内氧自由基生成增加或清除能力降低导致体内活性氧(reactive oxygen species,ROS)自由基产生过多,氧化和抗氧化系统失衡,引起组织损伤[4]。
在OS引起的损伤中,蛋白质损伤可产生谷胱甘肽化蛋白质结构,是引起细胞凋亡损伤及衰老的启动因子。谷氧还蛋白(glutaredoxin,Grx)是细胞抗氧化防御体系的重要蛋白,编码基因为grx1。Grx可以通过特异性催化还原谷胱甘肽化蛋白质结构以保护细胞免受OS的损害[5]。Akt是一种丝氨酸/苏氨酸蛋白激酶,其活性表达为磷酸化Akt(phosphorylated-Akt,p-Akt),与OS密切相关。在OS诱导内皮细胞损伤过程中,Akt作为一种细胞存活信号被激活[6],增加一氧化氮生成,维持内皮细胞功能[7]。Akt也是磷脂酰肌醇3激酶(phosphatidyl inositol 3-kinase,PI3K)下游的效应分子,位于PI3K/Akt通路的中心位置,可以磷酸化多种细胞因子如核转录因子-κB(nuclear factor kappa B,NF-κB)等以抑制凋亡基因的表达。许多外部刺激因素都能够激活PI3K从而促进p-Akt的表达[8]。
基于以上研究,笔者推测Grx/Akt通路可能在调节血管内皮细胞氧化损伤过程中具有重要作用。本实验采用实时荧光定量逆转录聚合酶链反应(realtime reverse transcription polymerase chain reaction,real-time RT-PCR)及Western blot方法,研究牙龈卟啉单胞菌LPS诱导脐静脉内皮EA-hy926细胞氧化损伤时grx1基因和Grx、Akt、p-Akt(308)蛋白表达的变化,探讨Grx在OS引发的细胞凋亡中的作用。
1 材料和方法
1.1 仪器设备和主要试剂
高通量聚合酶链反应仪(Eppendorf公司,德国),ABI7300型荧光定量分析仪(Bio-Rad公司,美国)。EA-hy926细胞由上海斯信生物科技有限公司提供。LPS采用美国InvivoGen公司的LPS-PG Ultrapure,Akt、p-Akt、Grx蛋白抗体为上海Proteintech公司产品,Grx特异性抑制剂氯化亚硝脲(carmustine,BCNU)为上海迈坤化工有限公司产品。
1.2 细胞培养及实验分组
将EA-hy926细胞置于含10%胎牛血清的DMEM培养基中,在5%CO2、37 ℃条件下常规培养,传至5~7代时用于实验。
将细胞分为LPS组和对照组,LPS组用牙龈卟啉单胞菌LPS(1 000 ng·mL-1)刺激细胞4、12、18、24 h,对照组不添加任何刺激,采用real-time RTPCR检测grx1基因的表达变化。选择grx1基因表达变化最明显的时间点,将EA-hy926细胞分为3组(对照组、LPS组和BCNU组),采用Western blot检测Akt、p-Akt和Grx蛋白的表达变化;其中对照组不添加任何刺激,LPS组采用LPS(1 000 ng·mL-1)刺激细胞,BCNU组先采用BCNU(25 μmol·mL-1)预处理细胞30 min后,再加入LPS(1 000 ng·mL-1)刺激细胞。
1.3 real-time RT-PCR反应
收集细胞并匀浆后加入1 mL TRIzol试剂,室温静置5 min;4 ℃下10 000 r·min-1离心15 min;吸取上层水相,加入异丙醇,混匀;4 ℃下10 000 r·min-1离心15 min;加入1 mL 75%乙醇洗涤沉淀,4 ℃下7 500 r·min-1离心5 min;加入无RNase水RNA溶解沉淀,-80 ℃保存。将RNA逆转录成cDNA,-20 ℃保存。PCR反应体系:反应混合液Premix Ex Tap[天根生化科技(北京)有限公司]10 μL,上下游引物各0.8 μL,cDNA 2 μL,DEPC水6 μL,总体积19.6 μL。PCR引物由Primer Premier 5.0设计,由日本TaKaRa公司合成,其序列见表1。

表1 引物序列Tab 1 Primer sequence
1.4 Western blot检测
细胞培养后,加入含有蛋白酶和磷酸酶抑制剂的裂解液,静止25 min,-20 ℃保存。采用垂直板聚丙烯酰胺凝胶电泳提取蛋白质,BCA法测定蛋白质的质量浓度。实验步骤:制胶,电泳,转膜;加入一抗Akt、p-Akt和Grx蛋白抗体(稀释度1∶1 000),室温下摇床孵育1 h,使用洗膜缓冲液(Tris buffered saline Tween,TBST)在摇床上漂洗3次,每次10 min;加入二抗,37 ℃下孵育1.5 h,用TBST在室温下摇床上漂洗3次,每次5 min;然后化学发光、显影、定影,使用凝胶图像处理系统分析目标条带的相对分子质量和净光密度值。
1.5 质量控制和统计学分析
所有实验进行3次,每次实验设3组复孔,所有操作均由同一人完成。采用SPSS 17.0统计软件进行数据处理,多个样本的比较采用单因素方差分析,两个样本之间的比较采用t检验,检验水准为双侧α=0.05。
2 结果
2.1 LPS对EA-hy926细胞grx1基因表达的影响
与对照组比较,LPS刺激4、12、18、24 h后,LPS组grx1基因的相对表达量均有明显增加(P<0.05),12 h增加最为明显,18、24 h时表达量低于12 h(P<0.05)(图1);由此推断,在LPS刺激下,grx1基因的表达量随时间的增加而增加,12 h达到最高。
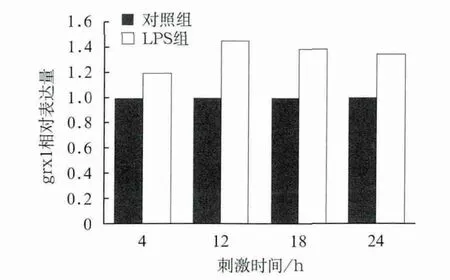
图1 grx1基因的相对表达量Fig 1 Relative expression of grx1 gene
2.2 LPS对EA-hy926细胞Grx、Akt、p-Akt(308)蛋白表达的影响
在LPS刺激下,grx1基因在12 h时相对表达量最高,在此基础上进一步研究EA-hy926细胞表达Grx蛋白和Akt的变化。LPS刺激12 h,Grx蛋白的表达量明显升高,而BCNU组的表达明显降低(P<0.05)(图2),提示LPS可提高Grx蛋白的表达,而Grx抑制剂BCNU可有效抑制Grx蛋白的表达。Akt表达量在3组间的差异无统计学意义(P>0.05),而p-Akt(308)在LPS刺激组明显增高,BCNU组明显降低(P<0.05)(图2),可见BCNU也可抑制p-Akt(308)的表达。
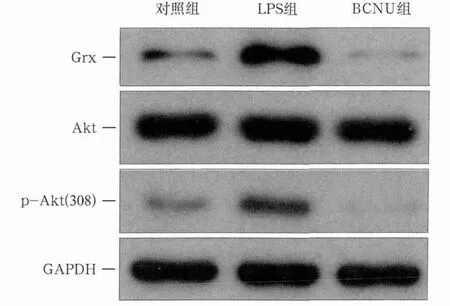
图2 Grx、Akt、p-Akt(308)蛋白的电泳图谱Fig 2 Protein electrophoresis of Grx, Akt and p-Akt (308)
3 讨论
牙周炎与冠心病的发病机制有很大的相似性[9]。在动脉粥样硬化区和心肌梗死区都能检测到牙龈卟啉单胞菌的沉积[10]。Gibson等[11]发现,人体血清中的抗牙龈卟啉单胞菌抗体水平与冠心病存在一定的相关性。牙龈卟啉单胞菌的毒力因子LPS可产生炎症因子如ROS等,从而引发机体内毒素血症。Cavrini等[12]通过一系列流行病学调查发现,内毒素感染可能是心血管疾病发生的一个危险因素。
Grx是一类小型的氧化还原酶,通过谷胱甘肽发挥生物学效用。Grx体系是抵御OS损伤的重要体系。在正常环境中,细胞体内Grx表达量恒定,当细胞内氧化物和抗氧化物比例失衡,产生超氧化自由基,机体抗OS系统Grx和硫氧还蛋白(thioredoxin,Trx)启动,Grx消耗量增加。Aesif等[13]发现,LPS可以通过LPS-IκB激酶(IκB kinase-β,IKKβ)-NF-κB-Grx途径刺激小鼠肺上皮细胞和巨噬细胞grx1基因的表达,提高其表达量。本实验结果发现,LPS刺激EA-hy926细胞后,grx1基因表达量在刺激初期随时间的增加而增加,12 h达到最高值。Murata等[14]发现,在OS条件下,grx1基因的初期表达量呈升高趋势,与本研究结果相同。Western blot检测结果显示:Akt蛋白水平的表达无明显变化,而Grx和p-Akt(308)的变化趋势基本相同。由此推测,在OS初始阶段,细胞内ROS含量增加,机体发生代偿反应,Grx增加,调节p-Akt(308)水平上升;加入BCNU预处理后,Grx表达被抑制,p-Akt(308)水平随之降低,提示p-Akt(308)可能受Grx调节。Wiedermann等[15]报道,通过下调Grx mRNA的表达,减少Grx含量,可以降低Akt的磷酸化水平。由此推测,人体细胞中Grx的高表达在组织早期抗OS过程中有十分重要的作用。在LPS刺激下,Grx通过调控Grx/Akt通路改变Grx表达水平,影响细胞的氧化敏感性,进而调控局部组织免受OS损害。
PI3K/Akt是一条经典的存活信号通路,在细胞凋亡和肿瘤发生中发挥着重要作用。 PI3K是Akt上游信号通路的主要效应物,可使其下游分子Akt磷酸化,上调Akt磷酸化水平,从而抑制细胞凋亡。Kim等[16]发现,LPS刺激肺上皮细胞能增加ROS表达,当抑制PI3K活性之后,ROS生成量升高,Akt磷酸化水平降低。另有研究[17]证实,Grx可以上调Akt的活性受体如PI3K等,也可能是调节Akt磷酸化水平的蛋白之一。此外,Reynaert等[18]发现,Grx在双氧水刺激下可以调节NF-κB的活性。NF-κB是重要的免疫信号传递因子,可以调控细胞增殖、分化以及存活,与细胞凋亡关系密切[19]。活化的Akt既可以通过磷酸化NF-κB的抑制性辅助因子激酶α调节其活性,也可以通过丝裂原活化蛋白3激酶影响IKKβ和NF-κB的活性[20]。细胞内的信息传递都是相互作用的,共同协调生命活动。由此推测,在OS条件下,Grx可以影响NF-κB活性,而NF-kB则负反馈调节Grx的表达。
本研究利用牙龈卟啉单胞菌的LPS诱导EA-hy926细胞,结果发现,LPS能在基因水平影响血管内皮细胞grx1基因的表达,Grx蛋白可能通过Grx/Akt这一通路调节p-Akt(308)的表达。Grx既是机体内调节OS反应的重要蛋白,也可能是细胞通过Akt途径调节细胞凋亡这一通路的关键蛋白。该结果在一定程度上揭示了LPS在OS导致的心血管疾病中的作用机制;并提示通过改变Grx表达水平可以改变细胞的氧化敏感性,这为牙周病和心血管疾病等由OS损伤导致的疾病治疗提供新的思路。
[1]Beck JD, Eke P, Lin D, et al. Associations between IgG antibody to oral organisms and carotid intima-medial thickness in community-dwelling adults[J]. Atherosclerosis, 2005,183(2):342-348.
[2]Urata Y, Ihara Y, Murata H, et al.17Beta-estradiol protects against oxidative stress-induced cell death through the glutathione/glutaredoxin-dependent redox regulation of Akt in myocardiac H9c2cells[J]. J Biol Chem, 2006, 281(19):13092-13102.
[3]Song JJ, Lee YJ. Differential role of glutaredoxin and thioredoxin in metabolic oxidative stress-induced activation of apoptosis signal-regulating kinase 1[J]. Biochem J, 2003,373(Pt 3):845-853.
[4]Bahekar AA, Singh S, Saha S, et al. The prevalence and incidence of coronary heart disease is significantly increased in periodontitis: a meta-analysis[J]. Am Heart J, 2007, 154(5):830-837.
[5]Lou MF. Thiol regulation in the lens[J]. J Ocul Pharmacol Ther, 2000, 16(2):137-148.
[6]Niwa K, Inanami O, Yamamori T, et al. Redox regulation of PI3K/Akt and p53 in bovine aortic endothelial cells exposed to hydrogen peroxide[J]. Antioxid Redox Signal, 2003, 5(6):713-722.
[7]Mukai Y, Rikitake Y, Shiojima I, et al. Decreased vascular lesion formation in mice with inducible endothelial-specific expression of protein kinase Akt[J]. J Clin Invest, 2006, 116(2):334-343.
[8]Buchanan BB, Balmer Y. Redox regulation: a broadening horizon[J]. Annu Rev Plant Biol, 2005, 56:187-220.
[9]Beck JD, Offenbacher S, Williams R, et al. Periodontitis: a risk factor for coronary heart disease[J]. Ann Periodontol,1998, 3(1):127-141.
[10]Puddu P, Puddu GM, Cravero E, et al. The molecular sources of reactive oxygen species in hypertension[J]. Blood Press,2008, 17(2):70-77.
[11]Gibson FC 3rd, Hong C, Chou HH, et al. Innate immune recognition ofinvasive bacteria accelerates atherosclerosis in apolipoprotein E-deficient mice[J]. Circulation, 2004,109(22):2801-2806.
[12]Cavrini F, Sambri V, Moter A, et al. Molecular detection ofTreponema denticolaandPorphyromonas gingivalisin carotid and aortic atheromatous plaques by FISH: report of two cases[J]. J Med Microbiol, 2005, 54(Pt 1):93-96.
[13]Aesif SW, Kuipers I, van der Velden J, et al. Activation of the glutaredoxin-1 gene by nuclear factor κB enhances signaling[J]. Free Radic Biol Med, 2011, 51(6):1249-1257.
[14]Murata H, Ihara Y, Nakamura H, et al. Glutaredoxin exerts an antiapoptotic effect by regulating the redox state of Akt[J]. J Biol Chem, 2003, 278(50):50226-50233.
[15]Wiedermann CJ, Kiechl S, Dunzendorfer S, et al. Association of endotoxemia with carotid atherosclerosis and cardiovascular disease: prospective results from the Bruneck Study[J]. J Am Coll Cardiol, 1999, 34(7):1975-1981.
[16]Kim HJ, Jeong JS, Kim SR, et al. Inhibition of endoplasmic reticulum stress alleviates lipopolysaccharide-induced lung inflammation through modulation of NF-κB/HIF-1α signaling pathway[J]. Sci Rep, 2013, 3:1142.
[17]杨洁, 易静, 汤雪明. 氧化修饰在调控细胞凋亡信号转导中的作用[J]. 细胞生物学杂志, 2005, 27(2):121-126.
[18]Reynaert NL, van der Vliet A, Guala AS, et al. Dynamic redox control of NF-kappaB through glutaredoxin-regulated S-glutathionylation ofinhibitory kappaB kinase beta[J].Proc Natl Acad Sci USA, 2006, 103(35):13086-13091.
[19]Qin Y, Auh S, Blokh L, et al. TNF-alpha induces transient resistance to Fas-induced apoptosis in eosinophilic acute myeloid leukemia cells[J]. Cell Mol Immunol, 2007, 4(1):43-52.
[20]Meng F, D'Mello SR. NF-kappaB stimulates Akt phosphorylation and gene expression by distinct signaling mechanisms[J]. Biochim Biophys Acta, 2003, 1630(1):35-40.

