鱼藤属植物内生真菌的分离及杀虫活性研究
孙 涛,孙之潭,胡美英,钟国华
(华南农业大学昆虫毒理研究室,广州 510642)
鱼藤,别名毒鱼藤,篓藤。为蝶形花科Papilionoideae 鱼藤属Derris 多年生木质藤本植物,产于亚洲热带和亚热带地区。鱼藤属共有70 多种,我国有20 多种,产于西南部经中部至东南部(娄予强等,2010)。鱼藤属植物具有抗氧化、抗癌、抗菌、降血糖、镇痛等功能,在医药领域发挥着重要的作用(杨巡纭等,2013)。鱼藤属植物根部含有一种重要的活性成分——鱼藤酮类化合物,其具有较广的杀虫谱,其毒性对农作物安全,对哺乳动物低毒,是一种比较理想的植物源农药(张庭英等,2005)。目前鱼藤酮主要从鱼藤的根中提取,大量提取会造成鱼藤植被的破会,生态环境的恶化,而人工种植周期长,占用大量土地,组织培养的费用又较高,很难应用于农业生产实际。因此寻找可替代鱼藤的新型生物资源具有极其重要的意义。
植物内生真菌是指在其生活史一定阶段或全部阶段生活在健康植物组织或器官内部,而被侵染的宿主植物并不表现出明显病症的一类真菌(Stone et al.,2000)。内生真菌长期生活在植株体内的特殊环境中并且与其协同进化,一方面植株为其提供生长必需的能量和营养;另一方面内生真菌又通过自身的代谢活动或者信号传导作用对植物体产生影响(Zou et al.,2000;石瑛,2010)。现代内共生理论认为,植物与内生真菌在长期的协同进化过程中,生物化学途径的连续演化会导致信息物质在内生真菌与宿主间的相互传递(邵爱娟等,2001)。大量研究表明植物内生真菌的次生代谢产物极为丰富,具有多种生物活性,如杀虫、抑菌、调节植物生长等,其中某些产物与宿主的次级代谢产物相同或相似(杨春平等,2005)。内生菌的特殊生境决定了其次级代谢产物的独特性。研究显示,51%的从植物内生真菌分离的生物活性物质是以前没有发现的化合物(Strobel,2003)。因此,利用植物内生真菌开发新药源具有极大的可能性。本文是以毛鱼藤Derris elliptica Benth.、白花鱼藤 Derris albo-rubra Hemsl.、蜜花鱼藤Derris thyrsiflora Benth.3种鱼藤属植物的内生真菌为研究对象,从中分离筛选代谢产物对昆虫具有生物活性的内生真菌。
1 材料与方法
1.1 供试菌株
本论文中的鱼藤内生青霉菌株Penicillium sp.及其他菌株均为作者从华南农业大学昆虫毒理研究室杀虫植物标本园内的毛鱼藤、白花鱼藤和蜜花鱼藤中分离得到。
1.2 供试昆虫及饲养
家蚕Bombyx mori L.:由华南农业大学蚕丝科学系提供3 龄家蚕幼虫,在实验室里(温度25℃±1℃,相对湿度70%),把家蚕放在托盘中以桑叶饲养,待长到4 龄供试。
松材线虫Bursaphelenchus xylophilus N.:供试松材线虫分离于广东省东莞市樟木头镇病区松树。在25℃±1℃培养箱中以玉米培养盘多毛孢Pestalotia sp.15 d 后,用改良贝曼漏斗法分离线虫,通过100 目筛后收集于500 目筛,用无菌水冲洗两次,配成约10000 条/mL 线虫液备用。
1.3 培养基
固体培养基:马铃薯葡萄糖琼脂培养基(PDA),马铃薯200 g;葡萄糖20 g;琼脂20 g;水1000 mL;pH 自然。马铃薯去皮,切成块煮沸2 min,打浆1-2 min,冲洗打浆机,再加葡萄糖和琼脂,溶化后补足水至1000 mL。
液体培养基:马铃薯葡萄糖液体培养基(PD)。
1.4 内生真菌的分离、纯化和培养
采用内生真菌常用的分离方法:采集新鲜供试植物的根和嫩枝,进行表面消毒。首先分别以自来水和无菌水冲洗3-4 次,然后用75%酒精漂洗(5-15 min),用无菌水冲洗3-4 次,再置于次氯酸钠溶液(有效氯体积分数为10%)漂洗1 min,最后用无菌水冲洗4 次。在超净工作台上将消毒过的植物组织切割成0.5 cm2×0.5 cm2小片,移入PDA 平板上,于25℃培养箱中恒温培养。3-5 d 待植物样品边缘长出菌丝体后,根据菌丝体的形态特点(包括菌丝体的颜色、形状和质地等),采用尖端菌丝体挑取法对不同菌株进行分离纯化。采用组织印迹法检验植物组织的灭菌效果:即将消毒而未切割的植物组织与固体平板接触3-5 min,培养3-5 d,根据平板上菌落的有无判定分离结果的有效性(Sturz et al.,1997)。
内生真菌的液体培养采用采用摇瓶发酵法。将纯化菌株在无菌条件下接入装有150 mL PD 培养基的500 mL 三角瓶中,将其置于摇床中(25℃-28℃,RH=75%-85%,L∶D=12∶12)培养,摇床转数120 r/min,培养7-9 d。
1.5 内生真菌活性物质提取
用100 目筛将菌丝体由发酵液滤出,置于45℃烘箱中鼓风烘干,得干菌丝体。菌丝体中加入10 倍体积(V/W)的甲醇冷浸提取,置于避光暗处,冷浸每次持续48 h 以上,浸提三次,提取液合并,减压浓缩得粗提物。
1.6 对家蚕的生物活性测定
采用点滴法:供试样品用丙酮稀释,用微量点滴仪将稀释液点滴于家蚕试虫的前胸背板,对照组点滴丙酮。4 龄试虫点滴5μL。处理后加入新鲜的桑叶,分别于24 h、48 h 检查试虫的生存和死亡头数,按下列公式计算死亡率和校正死亡率。计算公式如下:
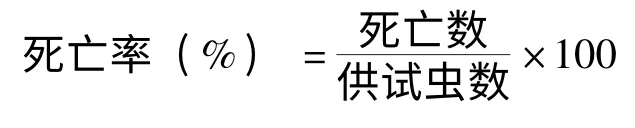
Abott 公式:

1.7 对松材线虫的生物活性测定
采用浸渍生测法:加1.5 mL 无菌水(含5%丙酮V/V)样品稀释液于直径为3 cm 小培养皿中,然后加入供试线虫30-50 头,每处理设3个重复,另设5%丙酮溶液为对照。同一处理放入直径为9 cm 的培养皿内,置于25℃培养箱中。分别于24 h 和48 h 用针刺法检查试虫的生存和死亡个数,按1.6 的公式计算死亡率和校正死亡率。
2 结果与分析
2.1 毛鱼藤等鱼藤属植物内生真菌的分离和初步鉴定结果
对毛鱼藤、白花鱼藤、蜜花鱼藤等鱼藤属植物根和茎的内生真菌进行了分离,根据其菌落形态和孢子、分生孢子梗着生状态等,对所分离纯化的部分内生真菌进行了初步鉴定,初步鉴定结果见表1。由于部分内生真菌在PDA 培养基上不能诱导产孢,难以用经典形态学的方法进行菌种鉴定,因此未能全部列出。

表1 鱼藤属植物内生真菌初步鉴定结果Table 1 Preliminary identification results of endophytic fungi isolated from the Derris
2.2 内生青霉等真菌甲醇提取物对松材线虫的生物活性
采用浸渍生测法,对鱼藤内生青霉和另外3 株代谢表现旺盛的炭疽属、拟茎点霉属和黄曲霉属内生真菌的菌丝体甲醇提取物进行了生物活性测定,结果见表2。从表中可以看出,4种内生真菌中以青霉菌的代谢产物对松材线虫的毒杀效果最强,处理24 h 和48 h 后的校正死亡率分别为85.60%和93.24%,与其他内生真菌代谢产物的生物活性差异显著。
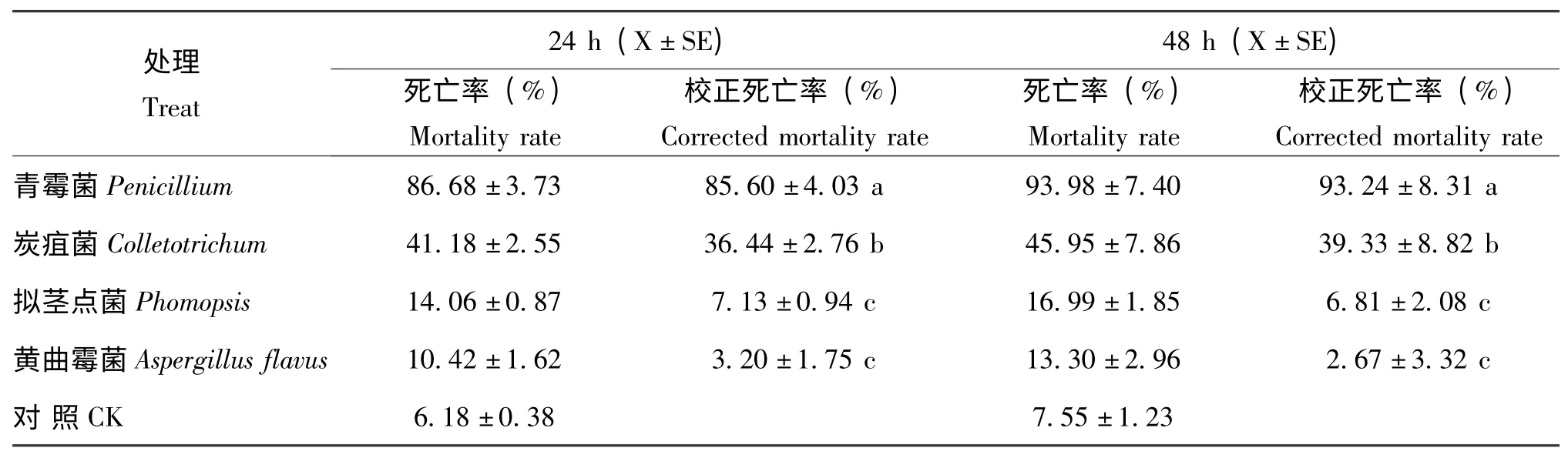
表2 4种内生真菌代谢产物对松材线虫的毒力Table 2 Toxicity of the secondary metabolites of four endophytic fungi against Bursaphelenchus xylophilus N.
2.3 内生青霉等真菌甲醇提取物对家蚕的生物活性
采用点法,对内生青霉等4种真菌菌丝体甲醇提取物对家蚕4 龄幼虫的触杀活性进行测定,结果见表2,以1.50 mg/头的剂量点滴处理家蚕4 龄幼虫时,青霉菌代谢产物对家蚕4 龄幼虫的触杀活性最高,24 h 的校正死亡率达到100%;0.50 mg/头的剂量对家蚕4 龄幼虫48 h 和72 h 的校正死亡率分别为50%和95.8%。而另外3种真菌代谢产物对家蚕4 龄幼虫无触杀活性。

表3 4种内生真菌代谢产物对家蚕4 龄幼虫的触杀毒力Table 3 Contact toxicity of the secondary metabolites of four endophytic fungi against 4th instar larvae of the silkworm Bombyx mori L.
3 结论与讨论
目前对植物病虫害的防治多采用农药来进行化学防治。但农药的不合理使用也带来了一些弊病,如对害虫天敌的毒害,对环境的污染以及导致有害物产生抗药性等。因此迫切需要开发对人畜毒副作用小,对环境友好且药效持久的农药。据文献报道,一些植物内生真菌为寻找可替代,毒副作用小,安全有效的绿色农药提供了可能(Benhamou and Nicole,1999)。目前,植物内生真菌本身及其次生代谢产物在农业方面应用的研究已经去取的较大的进展,一些非常有价值的新菌株和新化合物陆续被发现(江爱兵等,2010)。兰琪等(2004)从苦皮藤植株中分离得到一株具有杀虫活性的内生真菌,其菌丝体的丙酮粗提物对3 龄粘虫有毒杀作用,在500μg/mL 浓度处理下,24 h 后的死亡率为85.3%。Strobel 等(2004)从植物 Bontia daphnoides 中分离得到内生真菌Nodulisporium sp.,该菌会产生一种吲哚二萜类化合物Nodulisporic acids,实验证明该物质具有杀灭大苍蝇幼虫的活性。
根据某些药用植物的内生真菌能产生与宿主相同或相似的活性物质的现象,推测杀虫植物内生真菌可能产生与宿主相同或相似的杀虫活性物质。有研究发现苦楝的某些内生真菌可以产生楝科植物的活性物质——苦楝素(王琪等,2007),喜树的内生真菌可以产生喜树碱及其衍生物(潘学武等,2010;曹晋静和康冀川,2014)。本研究便是以传统杀虫植物毛鱼藤、白花鱼藤和蜜花鱼藤3种鱼藤属植物的内生真菌为研究对象,以家蚕和松材线虫为试虫,测定鱼藤属植物的内生真菌代谢产物的生物活性。4种内生真菌的的代谢产物对松材线虫都具有一定的毒杀活性,其中青霉菌的代谢产物活性最高,48 h 校正死亡率达90%以上。4种内生真菌中,只有青霉菌的代谢产物对家蚕4 龄幼虫具有触杀活性,1.5 mg/头剂量处理时,24 h 校正死亡率即达到100%。本文只对内生真菌的甲醇初提物进行了生物活性研究,其次生代谢产物的种类以及结构还待进一步鉴定。
References)
Benhamou N,Nicole M.Cell biology of plant immunization against microbial infection:The potential of induced resistance in controlling plant diseases[J].Plant Physiol.Bioch.,1999,37(10):703-719.
Cao JJ,Kang JC.The Screening of endophytic fungus producing camptothec in Camptotheca cuminata Decne.strains and the research of pharmaceutical chemistry[J].Hubei Agric.Sci.,2014,53(3):565-568.[曹晋静,康冀川.喜树内生真菌产喜树碱菌株的筛选及药化研究[J].湖北农业科学,2014,53(3):565-568]
Jiang AB,Wang KM,Zhang F,et al.Reserch progress of agro-activation plant endophytic fungi and their secondary metabolites[J].Hunan Agric.Sci.,2010,8:7-10.[江爱兵,王开梅,张凤,等.植物内生真菌及其次生代谢物的农用研究进展[J].湖南农业科学,2010,8:7-10]
Lan Q,Ji ZQ,Gu AG,et al.Preliminary study on the insecticidical and fungicidical components of endophytic fungus in Celastrus angulatus[J].Journal of Northwest A & F University(Natural Science Edition),2004,32(10):79-84.[兰琪,姬志勤,顾爱国,等.苦皮藤内生真菌中杀虫杀菌活性物质的初步研究[J].西北农林科技大学学报(自然科学版),2004,32(10):79-84]
Lou YQ,Ye YP,Zhang LH,et al.Advances in the research biological pesticide resource-Derris[J].Bull.Agric.Sic.Tech.,2010,20(1):108-111.[娄予强,叶燕萍,张林辉,等.生物农药资源—鱼藤的研究进展[J].农业科技通讯,2010,(1):108-111]
Pan XW,Han XH,Yang XL.Recent advances of camptothecin and its analogues produced by endophytic fungi[J].Journal of Wuhan Bioengineering Institute,2010 6(3):230-234.[潘学武,董妍玲,石亚亚.内生真菌产生喜树碱及其类似物的研究进展[J].武汉生物工程学院学报,2010 6(3):230-234]
Shao AJ,Lin SF,Zhang SJ,et al.Isolation of a kind of endophytic fungus which can produce taxol compounds[J].Acta Academiae Medicinae Sinicae,2001,23(6):642-644.[邵爱娟,林淑芳,张思巨,等.一种能产生紫杉醇类化合物内生真菌的分离[J].中国医学科学院学报,2001,23(6):642-644]
Shi Y.Effects of endophytic fungi on growth and development of plants[J].Modern Agricultural Science and Technology,2010,6:36-38.[石瑛.内生真菌对植物生长发育的影响[J].现代农业科技,2010,6:36-38]
Stone JK,Bacon CW,White JF,An overview of endophytic microbes:endophytism defined[J].Microbial Endophytes,2000,3:29-33.
Sturz AV,Christie BR,Matheson BG,et al.Biodiversity of endophytic bacteria which colonize red clover nodules,roots,stems and foliage and their influence on host growth[J].Biol.Fert.Soils.,1997,25(1):13-19.
Strobel G,Daisy B,Castillo U,et al.Natural products from endophytic microorganisms[J],J.Nat.Prod.,2004,67(2):257-268,
Strobel GA.Endophytes as sources of bioactive products[J].Microbes Infect,2013,5(6):535-544.
Wang Q,Fu YH,Gao JM,et al.Preliminary isolation and screen of endophytic fungi from Melia azedarach L.[J].Acta Agriculturae Boreali-Occidentalis Sinica,2007,16(2):224-227.[王琪,傅育红,高锦明,等.苦楝内生真菌的初步分离和筛选[J].西北农业学报,2007,16(2):224-227]
Yang XY,Ma RJ,Wang LQ,et al.Advances in research on chemical constituents and pharmacological activities of genus Derris[J].Nat.Prod.Res.Dev.,2013,25(1):117-128.[杨巡纭,马瑞婧,王利勤,等.鱼藤属植物的化学成分及药理作用研究进展[J].天然产物研究与开发,2013,25(1):117-128]
Yang CP,Chen HB,Wu WJ,et al.Diversity of plant endophytic fungi secondary metabolites and their potential applications[J].Acta Agriculturae Boreali-Occidentalis Sinica,2005,14(2):126-132,[杨春平,陈华保,吴文君,等.植物内生真菌次生代谢产物的多样性及潜在应用价值[J].西北农业学报,2005,14(2):126-132]
Zhang TY,Xu HH,Wang CH.Current status of rotenone utilization and existing concerns[J].Chinese Journal of Pesticides,2005,44(8):352-355.[张庭英,徐汉虹,王长宏.鱼藤酮的应用现状及存在问题[J].农药,2005,44(8):352-355]
Zou WX,Meng JC,Lu H,et al.Metabolites of Colletotrichum gloeosporioides,an endophytic fungus in Artemisia mongolica[J].J.Nat.Prod.,2000,63(11):1529-1530.

