一株珙桐耐铅、镉内生真菌的分离鉴定及生物学特性分析*
方志荣
(西昌学院,四川 西昌 615013)
一株珙桐耐铅、镉内生真菌的分离鉴定及生物学特性分析*
方志荣
(西昌学院,四川 西昌 615013)
从珙桐2年生健康实生苗的茎段中分离到一株耐铅、镉内生真菌。经形态学观察,该菌初步鉴定为链格孢属真菌。该菌的最佳培养基为PDA培养基。温度、pH、碳源和氮源对其生长有一定影响。在温度为15~35℃时均能生长,最适温度为25~30℃。该菌能适应较宽的pH值范围,在pH值5~9的条件下生长旺盛。多种碳源和氮源均能促进该菌生长,最佳的碳源为葡萄糖、可溶性淀粉、甘露糖和蔗糖,最佳的氮源为硝酸钠。该菌能在含1 000 mg/L Pb(NO2)2或100 mg/L CdCl2.2.5H2O培养基上生长,表明该菌在铅、镉胁迫下仍有较强的生长能力。
珙桐;内生真菌;链格孢属;生物学特性;铅胁迫;镉胁迫
土壤是一种极为重要、富有生命的资源。然而,近几十年来,随着我国工农业的迅速发展,大量废弃物的排放、农药和化肥的使用,加上日益剧增的城市生活垃圾,使土壤遭到了严重的重金属污染,其中铅和镉因为毒性大而受到多方关注,具体表现为极强的积累性和不可逆性[1]。重金属污染防治已成为亟待解决的问题[2]。利用重金属超富集植物吸附土壤重金属的植物修复作为生物修复的方法之一,具有成本低,修复彻底、无二次污染等优点。然而植物修复也存在一些不足,如植物生长速度慢、生物量小等缺点[3]。重金属污染土壤的植物-微生物联合修复是一种生物修复的有效措施[4]。目前该类研究主要采用根际微生物与宿主植物建立修复系统,但根际微生物在实际应用中往往不适应多变的土壤环境或受到土著微生物的竞争,效果不显著[5]。
植物的内生真菌(endophyte)是指在其生活史的一定阶段或全部阶段生活于健康植物组织内部或细胞间隙、不引起植物产生明显病症的一类真菌[6]。内生真菌在长期的进化过程中,与宿主形成了互利共生的关系。一方面,内生真菌从宿主吸收营养供自己生长需要;另一方面内生真菌产生的某些次生代谢产物对植物具有促生长、抗病虫害、抗逆境(如干旱等)以及他感等作用[7]。因此利用内生真菌构建植物-微生物联合修复系统修复重金属污染的土壤,不仅可以克服单独微生物修复中微生物难存活的缺点,还可以增加植物修复的效果,具有广阔的应用前景[8-9]。
珙桐(Davadia involucrata Baill)在晚白垩纪和第三纪时期曾广泛分布于世界许多地区,但是由于第四纪冰川的影响,仅在我国西南地区受冰川活动影响小的地方存活下来,为第三纪孑遗植物[10]。有关珙桐植株内生真菌的研究已有相关的报道。何映霞等[11]从珙桐中分离到一株产黄酮内生真菌Aspergillus fumigatus。张亮等[12]发现珙桐内生真菌Lophiostoma sp.的主要产物是萜类和脂肪酸的衍生物为主。然而,能助珙桐抗逆境的内生真菌迄今为止尚无报道。本研究以珙桐两年生实生苗为材料,分离、筛选出铅、镉的耐受菌,并对其铅、镉耐受性进行研究,旨在为构建铅、镉超富集植物-微生物修复系统提供菌种,为珙桐等珍稀野生植物资源的保护和开发提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验材料
珙桐2年生健康实生苗于2013年5月从云南省大理市喜洲镇周城苍泉植物园购买。实验前将其剪成2 cm长的茎段、根进行表面冲洗、消毒后,马上进行内生菌的分离。
1.1.2 培养基
(1)分离纯化培养基:马铃薯葡萄糖琼脂培养基(Potato Dextrose Agar,PDA):马铃薯(去皮)200 g,葡萄糖20 g,琼脂粉20 g,纯化水1 000 mL。
(2)筛选培养基:以PDA培养基为基础培养基,在培养基中加入50 mg/L的CdCl2.2.5H2O和500 mg/L的Pb(NO2)2。
(3)鉴别培养基:马铃薯胡萝卜琼脂培养基(Potato Carrot Agar,PCA):马铃薯200 g,胡萝卜25 g,琼脂15 g,蒸馏水1 000 mL。
(4)生物学特性研究培养基:查氏培养基(Czapek Agar,CA)、马铃薯蔗糖培养基(Potato Sugar Agar,PSA)、牛肉膏蛋白胨琼脂培养基(NA)[13]。
(5)胁迫培养基:以查氏培养基为基础培养基,添加Pb(NO2)2或CdCl2,均为分析纯。培养基铅的浓度梯度为250、500、750、1 000 mg/L(以Pb(NO2)2计),镉的浓度为25、50、75、100 mg/L(以CdCl2.2.5H2O计)。
1.2 方法
1.2.1 分离、纯化、鉴定
(1)分离培养经自来水冲洗的试验材料用0.5%升汞浸泡3 min,用无菌水漂洗4次,再用75%的乙醇浸泡1 min,无菌水冲洗数次[14]。把处理过的材料置于PDA培养基上,30℃生化培养箱中黑暗培养10 d。实验共设2个空白对照。最后一次漂洗液涂布于PDA培养基平板上作为对照。将表面灭菌处理的茎段、根压入PDA培养基平板内,使表面灭菌材料与PDA培养基接触2 min,移去灭菌植物材料作为另一对照[15]。
(2)纯化待组织块下或边缘的培养基上长出菌落后,采用划线稀释法进行菌种的分离纯化。
(3)筛选将纯化后的菌接种在筛选培养基上,30℃黑暗培养5 d。
(4)内生菌的鉴定将筛选到的菌株接种于PCA培养基上,30℃黑暗培养5 d。从菌落特征、孢子形态特征等对分离菌株进行鉴定。
1.2.2 生物学特性分析
参照郑文龙[13]的方法。
(1)不同培养基对菌丝生长的影响
试验前,用PDA培养基活化菌种,待该菌达到较好生长状态后统一用直径为0.7 cm的打孔器打孔。将直径为0.7 cm的供试菌块接种到各培养基的中央部位,每皿1个,每处理3皿,放入30℃生化培养箱中黑暗培养,4 d后采用十字交叉法测量菌落直径。
(2)不同pH和培养温度对菌丝生长的影响
pH:制备pH为3、4、5、6、7、8、9共6个梯度的查氏培养基,接入菌块后,培养条件和调查记载同(1)。
培养温度:将直径为0.7 cm的菌块接种于查氏培养基上,分别置于10、15、20、25、3O、35℃生化培养箱黑暗培养,调查记载同(1)。
(3)不同碳、氮源对菌丝生长的影响
碳源的筛选:选用查氏培养基为基本培养基,以供试碳源替换其中的蔗糖。供试碳源为乳糖、果糖、葡萄糖、甘露醇、糊精、可溶性淀粉共5个处理,以不加碳源的CA培养基为对照(ck),接入菌块,培养条件和调查记载同(1)。
氮源的筛选:选用查氏培养基为基本培养基,以供试氮源替换其中的NaNO3。供试氮源为硝酸钾、硝酸钙、硝酸铵、蛋白胨、尿素共5个处理,以不加氮源的CA培养基为对照(ck),接入菌块,培养条件和调查记载同(1)。
1.2.3 胁迫培养
将直径为0.7 cm的菌块接种于胁迫培养基上,培养条件和调查记载同(1)。
1.2.4 数据统计
采用SPSS软件对数据进行统计和单因素的方差分析。
2 结果与分析
2.1 形态描述
本实验从珙桐的茎段和根中共分离到43株菌,通过筛选培养基筛选出铅、镉的耐性菌3株(其中2株为酵母菌)。该菌株来源于珙桐的茎段。根据预实验的结果,该菌株可能是链格孢属。为进一步验证结果,将该菌株重新接种到PCA培养基上,30℃下暗培养5 d。该菌株在PCA培养基上菌落暗黑色,紧贴培养基表面生长。分生孢子梗颜色深,直或立,分枝或不分枝。成熟分生孢子淡褐色至褐色,倒棒状、近球形或广椭圆形,具横隔膜1~5个,纵隔膜0~2个,黑褐色(图1)。根据菌落特征和分生孢子形态确定该菌株为链格孢属Alternaria sp.[16]。
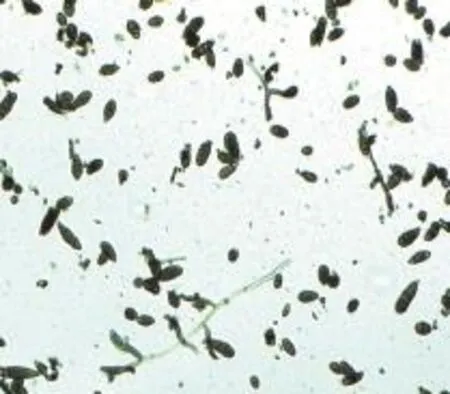
图1 显微镜下分生孢子的形态(25×)
2.2 菌株生物学特性
2.2.1 pH值、温度对菌株生长的影响
查氏培养基平板上链格孢能适应较宽的pH值范围,pH值为3.0和4.0时菌丝生长缓慢,pH值为5.0~9.0时菌丝生长缓慢。pH值为7.0最有利于菌丝的生长,但是未与pH值为5.0、6.0、8.0和9.0时表现出明显的差异(图2),不同培养温度对查氏培养基平板上链格孢菌丝生长影响差异显著。该链格孢菌在10~35℃均可生长,在25~30℃菌丝生长旺盛,其中以25℃温度为菌丝生长的最适温度(图3)。

图2 pH值对链格孢菌生长的影响
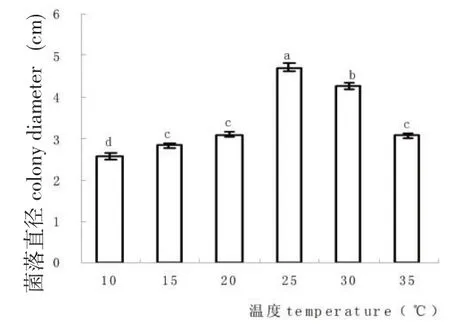
图3 温度对链格孢菌生长的影响
2.2.3 培养基种类对菌株生长的影响
不同培养基上链格孢菌丝生长有一定的影响,4种培养基中,PDA培养基最有利于菌丝的生长,其次是查氏培养基,NA培养基上长势最差(图4)。
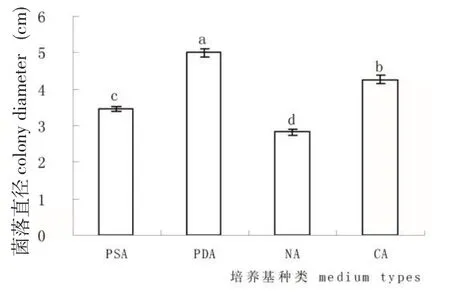
图4 培养基种类对链格孢菌生长的影响
2.2.4 不同氮源、碳源对菌株生长的影响
该链格孢菌丝在供试氮源上均能良好生长,供试氮源与对照存在极显著差异。实验结果表明,硝酸钠组菌落直径最大,硝酸钙和蛋白胨次之,以硝酸铵和尿素为氮源时生长最慢(图5)。所有供试碳源均有利于该链格孢菌丝体生长,在以葡萄糖、淀粉、甘露糖和蔗糖为碳源的查氏培养基平板上生长最快,糊精和果糖次之。
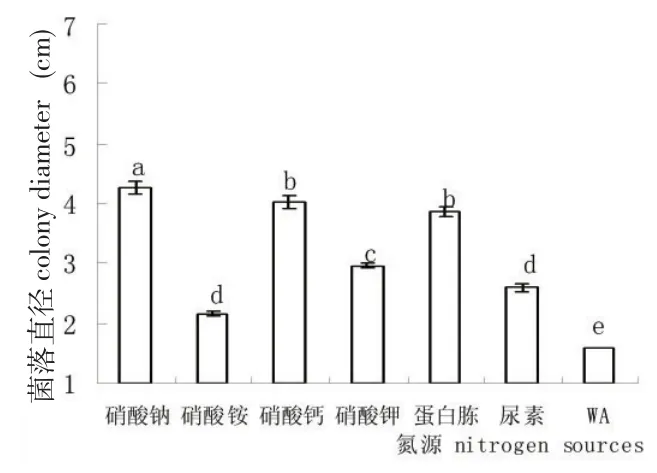
图5 氮源对链格孢菌生长的影响
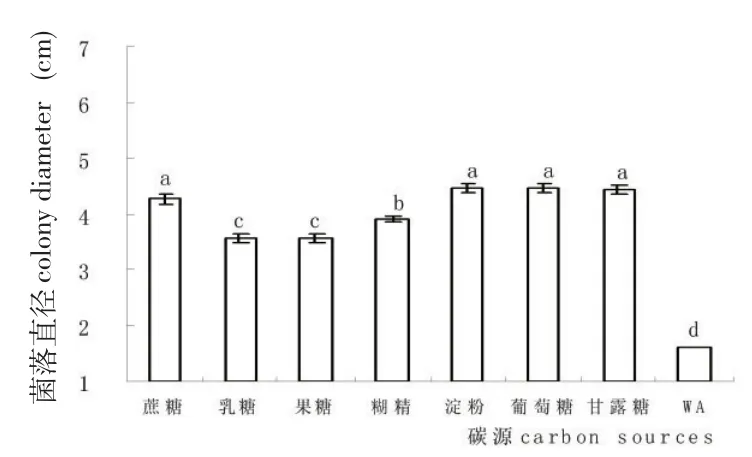
图6 碳源对链格孢菌生长的影响
2.3 菌株对铅、镉的耐受性
随着铅浓度的增加,铅胁迫对链格孢菌的生长表现出抑制作用,但是仍能生长。当铅的浓度为250、500、750、1 000 mg/L时,链格孢菌相对生长速率分别为对照的78%、69%、57%、51%(图7)。随着镉浓度的增加,镉胁迫对链格孢菌的生长表现出抑制作用,但是仍能生长。当镉的浓度为25、50、75、100 mg/L时,链格孢菌相对生长速率分别为对照的89%、73%、66%、59%(图8)。
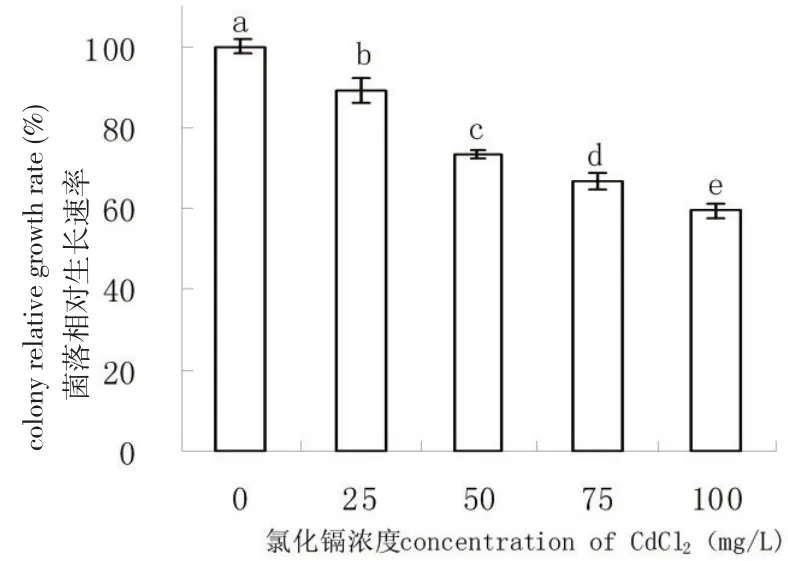
图7 铅胁迫对链格孢菌生长的影响

图8 镉胁迫对链格孢菌生长的影响
3 结论与讨论
本实验从珙桐2年生健康实生苗的茎段分离到了一株耐铅、镉的内生真菌。经鉴定,确定该菌株为链格孢属真菌。该菌株在温度为15~35℃时均能生长,最适温度为25~30℃。该菌能适应较宽的pH值范围,在pH值5~9的条件下生长旺盛。多种碳源和氮源均能促进链格孢生长,最佳碳源为葡萄糖、淀粉、甘露糖和蔗糖;最佳的氮源为硝酸钠。该菌能在含1 000 mg/L Pb(NO2)2或100 mg/L CdCl2.2.5H2O培养基上生长。这说明该菌在铅、镉胁迫下仍有较强的生长能力。
宋益民等[17]发现银杏链格孢菌在pH为9~12时,96 h前菌丝生长缓慢,96 h后生长迅速增加,推测链格孢在生长过程中可能产生酸性代谢物。王娜等[18]发现了一株链格孢真菌菌丝醇提取物对植物生长具有明显的促进作用,并对其真菌培养基进行了优化。赵明治等[19]从极细链格孢菌JH505菌株中分离纯化出一种35KD植物激发分子,该纯化蛋白能提高小麦根系琥珀酸脱氢酶活性、促进小麦根的生长。这说明珙桐链格孢内生真菌可能对植物生长具有促进作用,具体的促进作用还需要进一步的试验进行验证。目前已发现500多种链格孢属真菌,大部分属于病原菌。该属菌适应性强,95%以上的种能兼性寄生于植物上[20]。本实验分离纯化的珙桐链格孢属内生真菌尚未发现其致病性,因而可能作为一种铅、镉的耐受菌构建铅、镉超富集植物-链格孢菌的修复系统。
注释及参考文献:
[1]OUYANGH,VOGELHJ.Metalion binding to calmodulin:NMR and fluorescence studies[J].Biometals,1998(11):212-213.
[2]傅国伟.中国水土重金属污染的防治对策[J].中国环境科学,2012,32(2):373~376.
[3]BAKER A J M,MCGRATH S P,SIDOLIC M D.The possibility of in situ heavy metal decotaminatim of polluted soils using crops of metal-accumulating plants[J].Resour Conserv Recy,1994(11):41-49.
[4]MORGAN JAW,BENDING G D and White P J.Biological costs and bene?ts to plant-microbe interactions in the rhizosphere[J].J Exp Bot,2005,56(417):1729-1739.
[5]STURZ A V,CHRISTIE BR,NOWAK J.Bacterial Endophytes:Potential Role in Developing Sustainable Systems of Crop Production.Crit Rev Plant Sci,2000,19(1):1-30.
[6]PETRINI O.Fungal endophytes of tree leaves.In:Andrews JH,Hirano SS(eds.)Microbial ecology of leaves.Springer -Verlag,New York:1991,179-197.
[7]任爱梅,张丽珂,孟宪刚.植物内生真菌研究进展与存在问题[J].广东农业科学,2010(2):103-106.
[8]王银科,宋剑飞.内生菌在修复重金属污染土壤的研究进展[J].北方环境,2013,25(12):68-71.
[9]刘劲松,张健君,杨淑芳,等.内生菌参与植物/微生物联合修复重金属污染土壤的研究进展)[J].中国植保导刊,2014(2): 27-30.
[10]傅立国.中国植物红皮书:第一册[M].北京:科学出版社,1991:474-475.
[11]何映霞,冉雪琴,王嘉福.珙桐产黄酮内生真菌的分离和鉴定[J].贵州农业科学,2008,36(3):3-6.
[12]张亮,刘艳辉,罗薇,等.珙桐内生真菌Lophiostoma sp.(X1-2)石油醚部位化学成分研究[J].三峡大学学报(自然科学版), 2012,34(1):92-94.
[13]郑文龙,朱慧芳,刘璐,等.产紫杉醇内生真菌EFY-21的鉴定与生物学特性研究[J].菌物研究,2010,8(1):35-40.
[14]邵爱娟,林淑芳,张思巨,等.一种能产生紫杉醇类化合物内生真菌的分离)[J],中国医学科学院学报,2001,23(6): 642-644.
[15]王利娟,贺新生.植物内生真菌分离培养的研究方法[J].微生物学杂志,2006,26(4):55-60.
[16]王洪凯,张天宇,张猛.链格孢属真菌分类研究进展)[J].山东农业大学学报(自然科学版),2001,32(3):406-4.
[17]宋益民,印建峰.银杏链格孢菌生物学特性研究[J].长江大学学报(自然科学版):农学卷,2008,5(3):1-4.
[18]王娜,杨镇,杨涛.一株促植物生长链格孢真菌培养基优化的研究)[J].辽宁农业科学,2012(3):22-24.
[19]赵明治,杨秀芬,张明,等.一种促进植物根系生长的极细链格孢菌蛋白质分离、纯化和生物功能[J].中国生物防治,2007, 23(2):170-173.
[20]康子腾,姜黎明,罗义勇,等.植物病原链格孢属真菌的致病机制研究进展[J].生命科学,2013,25(9):908-914.
Isolation,Identification of a Endophytic Fungus With Lead and Cadmium Tolerance from Davidia Involucrata Baill and Its Biological Characteristics
FANG Zhi-rong
(Xichang College,Xichang,Sichuan 615013)
A endophytic fungus with lead and cadmium tolerance was isolated from the two-year-old healthy Davidia involucrate stem.It was initially identified as Alternaria sp.According to the characteristics of morphology,the optimal medium was PDA for the growth of the fungus.Temperature,pH,nitrogen sources and carbon sources affected the growth of the fungus.The fungus could grow at 15~35℃.The optimal growth temperature was 25~35℃. It was adaptable to the properties in a broader pH value range.It could grow well between pH 5.0 and pH 9.0.Many carbon sources and nitrogen sources tested could obviously make the fungus grow.The best carbon source was glucose,soluble starch,mannose or sugar.The best nitrogen source was sodium nitrate.It could grow on the Czapek Agar with a concentration of 1 000 mg/L Pb(NO2)2or 100 mg/L CdCl2.2.5H2O.The results showed that the fungus had stronger adaptability under lead stress and cadmium stress.
Davidia involucrate;endophytic fungus;Alternaria sp.;biological characteristics;lead stress; cadmium stress
S792.99;Q949.9
A
1673-1891(2015)04-0001-04
2015-08-11
四川省教育厅项目(08zb015);西昌学院自立项目(ZZSSA0808)。
方志荣(1981-),女,讲师,在读博士,研究方向:植物学。

