松树皮多聚原花青素片段化产物的分离鉴定及活性*
松树皮多聚原花青素片段化产物的分离鉴定及活性*
李娜1,但汉龙1,姜永新1,李美娟2,张加研2,赵平1
(1.西南林业大学 云南省木材胶黏剂及胶合制品重点实验室,云南昆明650224;2.西南林业大学 材料工程学院,云南昆明 650224)
摘要:采用多种柱层析手段,分别从基于茶多酚的思茅松和马尾松树皮多聚原花青素片段化反应产物中分离得到1个主要产物。通过MS、1H NMR和13C NMR波谱解析,其化学结构鉴定为(-)-表儿茶素-(4β-8)-(-)-表没食子儿茶素3-O-没食子酸酯(1)。结果表明,茶多酚中的(-)-表没食子儿茶素3-O-没食子酸酯(EGCG)在片段化反应中扮演着重要角色,化合物1是EGCG通过4β-8与(-)-表儿茶素C-4位上的正离子键合形成而来。采用DPPH、ABTS自由基清除活性测定方法评价了化合物1的抗氧化活性,其清除DPPH、ABTS自由基的能力均高于茶多酚、多聚原花青素及其片段化总产物,SC50值分别为6.12±0.03 g/mL和41.41±0.66 g/mL。
关键词:松树皮;思茅松;马尾松;多聚原花青素;片段化产物;分离鉴定;抗氧化活性
原花青素(proanthocyandins,PC)是植物中由不同数目的黄烷3-醇单元通过C4-C8、C4-C6或C2-O-C7等不同键合方式聚合而成的一大类多酚类物质。按其聚合度大小,PC分为低聚原花青素(oligomeric proanthocyanidins,OPC)和多聚原花青素(polymeric proanthocyanidins,PPC)[1]。与PPC相比,OPC在抗氧化、清除自由基等方面具有显著的生物活性,但大多数植物PC主要以PPC的形式存在,如松树皮PC的平均分子量为2 800,平均聚合度为9~10[2]。由于PPC分子量大、水溶性较差,导致其不易透过生物膜,从而影响其生物活性,并随聚合度的增加其抗氧化作用显著降低[3~5]。
通过黄烷3-醇单元之间连接键的酸催化裂解实现PPC片段化是PC最重要的化学反应之一[6],半胱氨酸、半胱胺、谷胱甘肽等先后被应用于葡萄籽、松树皮、荔枝PPC的片段化反应中,并发现其片段化产物具有良好的抗氧化、抗肿瘤、免疫调节和神经保护等活性[7~13]。近年来,本研究组开发了基于茶多酚的PPC片段化技术,李美娟等[14]对云南松(Pinusyunnanensis)树皮等几种植物PC及其基于茶多酚的片段化产物进行了体内抗ROS活性比较,发现片段化产物的活性得到显著提高;姜永新等[15]、尹继庭等[16]和姜力等[17]进一步对源于马尾松(Pinusmassoniana)树皮、葡萄籽皮和木瓜(Chaenomelessinensis)原花青素的茶多酚片段化产物进行了液质联用分析,发现他们的片段化主产物均为同一物质,并推测其可能结构为(表)儿茶素和(表)没食子儿茶素3-O-没食子酸酯结合的二聚体。本研究采用多种柱层析手段并结合质谱(MS)、核磁共振(NMR)波谱技术,对基于茶多酚的思茅松(P.kesiyavar.langbianensis)和马尾松树皮PPC的片段化反应主产物进行分离鉴定,并采用DPPH和ABTS自由基清除活性测定方法评价其抗氧化活性,以期为PPC/茶多酚片段化反应机理的阐明以及片段化反应产物进一步的高值化开发利用等提供依据。
1材料与方法
1.1材料
思茅松树皮(云南省景谷林业股份有限公司提供)、马尾松树皮(PC购自桂林莱茵生物科技有限公司)、茶多酚(云南省红河唐人生物科技发展有限公司)。Sephabeads LP-20、Diaon HP-20、MCI GEL CHP20/P120和CG161M大孔吸附树脂、Sephadex LH-20凝胶(北京慧德易科技有限责任公司)。1,1-二苯基-2-三硝基苯肼(DPPH)(Sigma公司)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)(BomeiBio公司)。化合物分离用甲醇、乙醇为化学纯,过硫酸钾、Vc、HCl、H2SO4以及TLC用氯仿、甲醇和乙醇均为分析纯。TLC展开剂为氯仿:甲醇:水(7:3:0.5),显色剂为10 % H2SO4乙醇溶液。
主要仪器有赛特路斯BT244S型万分之一电子天平(北京赛多利斯仪器系统有限公司)、HH-2型数显恒温水浴锅(国华电器有限公司)、EYELA旋转蒸发仪N-1001型(日本东京理化器械有限公司)、UV1000紫外可见分光光度计(北京莱伯泰科仪器有限公司)、BRUKER AM-400MHz超导核磁共振仪(瑞士布鲁克公司)、Autospec Premier P776双聚焦三扇型磁质谱仪(美国沃特斯公司)。
1.2思茅松树皮PPC的制备
干燥思茅松树皮8 kg用80 %乙醇25 L冷浸3次,合并提取液减压浓缩后分别用石油醚和乙酸乙酯萃取,所得水溶液经减压浓缩去除残留有机溶剂后上Sephabeads LP-20柱(10 cm×80 cm),用2个柱体积的蒸馏水洗脱,水洗脱部分再经Diaion HP-20柱(8 cm×80 cm)吸附,用1个柱体积的蒸馏水洗脱去杂后,用2个柱体积的乙醇进行洗脱,乙醇洗脱液合并后经减压浓缩、冷冻干燥得到思茅松树皮PPC(271.4 g)。
1.3片段化总产物的制备
参照PPC/茶多酚片段化反应方法[15~17],分别称取思茅松树皮PPC和马尾松树皮PC各10 g,溶解于1 L含茶多酚10 g、10 μmol/L Vc的1 % HCl水溶液中,在70℃恒温水浴中加热反应90 min后,置于室温冷却以终止反应。各反应溶液经Diaon HP-20柱(5 cm×60 cm)分别吸附,用2倍柱体积的蒸馏水洗脱去除Vc和HCl后,用甲醇洗脱至洗脱液近无色,所得甲醇洗脱液在50℃下减压浓缩干燥,分别得到思茅松树皮PPC片段化总产物16.8 g和马尾松树皮PC片段化总产物17.0 g。
1.4片段化产物1的分离鉴定
取思茅松树皮PPC片段化总产物4.84 g溶解于少量50 %甲醇水溶液后,经MCI GEL CHP20/P120柱(4 cm×40 cm)吸附,用30 %、40 %、50 %、60 %、70 %、80 %的甲醇水溶液各400 mL进行梯度洗脱,经TLC检测合并,得到10个组分(Fr1-Fr10)。Fr.2(733.6 mg)用少量乙醇溶解后上Sephadex LH-20(2.5 cm×35 cm)柱层析,用乙醇等度洗脱,经TLC检测合并,得到11个组分(Fr2.1-Fr2.11)。其中,Fr2.4(41.2 mg)经CG161M(1.5 cm×40 cm)柱层析,用30 %、50 %和80 %甲醇水各150 mL进行梯度洗脱,得到化合物1(7.5 mg)。
取马尾松树皮PC片段化总产物5.23 g溶解于少量乙醇后上Sephadex LH-20(3.5 cm× 40 cm)柱层析,用乙醇等度洗脱,经TLC检测合并,得到11个组分(Fr1-Fr11)。其中,Fr10(418 mg)进一步经Sephadex LH-20(2.0 cm×30 cm)柱层析,用乙醇等度洗脱,得到5个组分(Fr10.1-Fr10.5)。Fr10.3(140.8 mg)经CG161M(1.5 cm×20 cm)柱层析,用10 %、30 %、50 %和80 %甲醇水溶液各200 mL进行梯度洗脱,得到化合物1(15.0 mg)。
采用BRUKER AM-400MHz超导核磁共振仪和Autospec Premier P776双聚焦三扇型磁质谱仪对化合物1进行波谱测定。
1.5抗氧化活性测定
参照DPPH自由基清除活性测试方法[18],用70 %的乙醇配制成浓度为0.2 mmol/L的DPPH溶液备用。化合物1、茶多酚、思茅松树皮PPC及其片段化总产物分别用70 %乙醇溶解配制成不同浓度的溶液,并各取2 mL不同质量浓度的溶液于棕色小瓶中,分别加入0.2 mmol/L的DPPH乙醇溶液2 mL,在避光条件下混均,反应20 min后,在波长517 nm处测定吸光度。以70 %乙醇调零,用70 %乙醇2 mL加入0.2 mmol/L的DPPH乙醇溶液2 mL作为空白对照。按如下公式计算供试样品的DPPH自由基清除率。DPPH自由基清除率(%)=[(AX0-AX)/ AX0]×100。式中,AX为供试样品溶液加入DPPH自由基溶液反应后的吸光度;AX0为空白对照溶液的吸光度。根据供试样品的DPPH自由基清除曲线,计算它们的SC50值(清除率为50 %时所需供试样品的质量浓度)。测定时每个样品进行3次平行重复实验。
参照ABTS自由基清除活性测试方法[19],称取38.5 mg的ABTS,6.6 mg的过硫酸钾用70 %乙醇溶解定容于10 mL的棕色容量瓶,避光反应12-16 h之后,用70 %乙醇稀释,使其在734 nm处的吸光度值为0.70±0.02,即得ABTS工作液。化合物1、茶多酚、思茅松树皮PPC及其片段化总产物分别用70 %乙醇溶解配制成不同浓度的溶液,取0.1 mL不同质量浓度的溶液于棕色小瓶中,分别加入ABTS工作液3.9 mL,在避光条件下混均,反应6 min后,在波长734 nm处测定吸光度。以70 %乙醇调零,用70 %乙醇0.1 mL加入ABTS工作液3.9 mL作为空白对照。按如下公式计算供试样品的ABTS自由基清除率。ABTS自由基清除率(%)=[(AX0-AX)/ AX0]×100。式中,AX为供试样品溶液加入ABTS工作液反应后的吸光度;AX0为空白对照溶液的吸光度。根据供试样品的ABTS自由基清除曲线,计算它们的SC50值(清除率为50 %时所需供试样品的质量浓度)。测定时每个样品进行3次平行重复实验。
2结果与分析
2.1片段化产物1的结构鉴定
化合物1为淡黄色无定形粉末,ESI--MS显示其分子离子峰m/z 746 [M]-,表明其分子量为746。其1H NMR谱显示出典型的黄烷3-醇二聚体的质子信号,其中δ5.24(1H,br s),4.00(1H,br s)和δ5.12(1H,br s),5.56(1H,m)分别为黄烷3-醇C环2位和3位上的质子信号,且H-2和H-3、H-2′和H-3′均处于同侧。 δ6.02(3H,m)为典型的黄烷3-醇骨架A环6位和8位上的质子。δ7.02(2H,s)为典型的没食子酰基(galloyl)上的芳香质子信号,结合分子量信息,推测该化合物为(-)-表儿茶素结构上附加了(-)-表没食子儿茶素3-O-没食子酸酯(EGCG),分子式为C37H30O17。结合C-4位上的质子信号[δ4.84(1H,br s),2.80~3.10(2H,m)],表明(-)-表儿茶素和EGCG通过4β-8位相连[20]。其1H NMR和13C NMR谱数据与文献报道的(-)-表儿茶素-(4β-8)-(-)-表没食子儿茶素3-O-没食子酸酯[20]完全一致,因此该化合物的结构鉴定为(-)-表儿茶素-(4β-8)-(-)-表没食子儿茶素3-O-没食子酸酯(1)(图1)。
化合物1的波谱数据:ESI--MS: m/z 746 [M]-.1H NMR(acetone-d6,400 MHz): δ7.02(2H,s,galloyl H),6.63~6.92(5H,m,B,B′-ring H),6.02(3H,m,H-6,8,6′),5.56(1H,m,H-3′),5.24(1H,br s,H-2),5.12(1H,br s,H-2′),4.84(1H,br s,H-4),4.00(1H,br s,H-3),2.80~3.10(2H,m,H-4′).13C NMR(acetone-d6,100 MHz,):δ166.9(COO),157.7,157.3,155.8,155.6,155.4(s,C-5,7,9,5′,7′,9′),146.0,145.7,145.4,145.1(B-ring C-3,4,B′-ring C-3,5,galloyl C-3,5),139.1(galloyl C-4),132.8,132.1,130.3(B-ring C-1,B′-ring C-1,4),121.3(galloyl C-1),119.1,115.7,115.2(B-ring C-2,5,6),110.2(galloyl C-2,6),107.6(C-8′),106.3(B′-ring C-2,6),101.5(C-10),99.2(C-10′),97.0,96.2,95.6(C-6,8,6′),77.8(C-2),76.8(C-2′),73.2(C-3),72.9(C-3′),36.5(C-4),26.7(C-4′)。
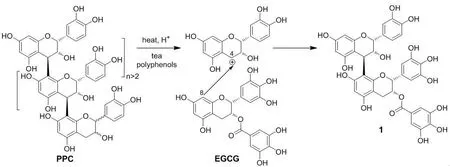
图1化合物1的化学结构及其形成机理
Fig.1Chemical structure of compound 1 and its formation mechanism
依据原花青素酸催化降解反应原理,化合物1的形成机理如图1所示。在加热和适当的酸性条件下,“直链型”结构的松树皮PPC[2]中的黄烷3-醇单元之间的C4-C8连接键容易发生断裂,其上部延伸单元中C-4位形成的(-)-表儿茶素碳正离子容易被适当的亲核剂所捕捉,从而形成亲核剂附加产物[6]。由于茶多酚主要由EGCG等儿茶素类物质所构成,在反应体系中EGCG扮演亲核试剂的主要角色,与(-)-表儿茶素碳正离子发生C4-C8化学键合,从而形成片段化主产物1。
2.2片段化产物1的抗氧化活性
按照1.5的实验方法分别测定了化合物1、茶多酚、思茅松树皮PPC及其片段化总产物对DPPH自由基和ABTS自由基的清除率,清除活性测定结果见图2所示。从图2可知,供试样品对DPPH自由基都具有较高的清除能力,它们的最大清除率分别达到71.28 %、73.10 %、75.70 %和77.32 %。其中,化合物1对DPPH自由基的半清除浓度(SC50=6.12±0.03 μg/mL)明显低于思茅松树皮PPC的半清除浓度(SC50=15.23±0.63 μg/mL),同时也低于茶多酚的半清除浓度(SC50=8.28±0.45 μg/mL)和PPC片段化总产物的半清除浓度(SC50=9.01±0.14 μg/mL),表明化合物1的DPPH自由基清除能力最强。
化合物1、茶多酚、思茅松树皮PPC及其片段化总产物对ABTS自由基同样也具有较高的清除能力,它们的最大清除率分别达到了100 %、99.82 %、92.49 %和99.74 %。其中,化合物1对ABTS自由基的半清除浓度(SC50=41.41±0.66 μg/mL)远远低于思茅松树皮PPC的半清除浓度(SC50=105.85±1.33 μg/mL),并且也低于茶多酚的半清除浓度(SC50=65.32±0.71 μg/mL)和PPC片段化产物的半清除浓度(SC50=64.02±2.59 μg/mL),同样表明化合物1的ABTS自由基清除能力最强。

图2 供试样品的DPPH、ABTS自由基清除率
3结语
本研究采用多种柱层析手段,分别从基于茶多酚的思茅松树皮PPC和马尾松树皮PC片段化总产物中分离得到1个主要产物,通过MS、1H NMR和13C NMR波谱解析,其化学结构鉴定为(-)-表儿茶素-(4β-8)-(-)-表没食子儿茶素3-O-没食子酸酯(1)。该主产物是EGCG通过4β-8与(-)-表儿茶素C-4位上的碳正离子键合形成而来,表明源于茶多酚的EGCG在思茅松树皮PPC和马尾松树皮PC片段化反应中扮演着非常重要的角色。抗氧化活性实验结果显示化合物1的DPPH和ABTS自由基清除能力均明显高于茶多酚、思茅松树皮PPC及其片段化总产物,其SC50值分别为6.12±0.03 μg/mL和41.41±0.66 μg/mL。研究结果表明通过基于食品来源茶多酚的多聚原花青素片段化技术,其片段化产物的抗氧化能力得到了显著提高,该技术的推广应用可望为植物PPC进一步的高值化开发利用提供一条新的途径。
参考文献:
[1]Cos P,De Bruyne T,Hermans N,etal.Proanthocyanidins in health care: current and new trends[J].Curr Med Chem,2004,11(10): 1345-1359.
[2]孙达旺.植物单宁化学[M].北京:中国林业出版社,1992.
[3]Lotito SB,Actis-Goretta L,Renart ML,etal.Influence of oligomer chain length on the antioxidant activity of procyanidins[J].Biochem Biophys Res Commun,2000,276(3):945-951.
[4]孙芸,徐宝才,谷文英,等.葡萄籽原花青素的聚合度与抗氧化活性关系[J].食品与发酵工业,2006,32(10):41-46.
[5]Deprez S,Mila I,Huneau JF,etal.Transport of proanthocyanidin dimmers,trimers,tetramers,and polymers across monolayers of human intestinal epithelial caco-2 cells[J].Antioxid Redox Signal,2001,3(6):957-967.
[6]Hemingway RW.Reactions at the interflavonoid bond of proanthocyanidins.In Chemistry and significance of condensed tannins[M].Hemingway RW,Karchesy JJ(ed.).New York:Plenum Press,1989.
[7]Torres JL,Lozano C,Julià L,etal.Cysteinyl-flavan-3-ol conjugates from grape procyanidins.antioxidant and antiproliferative properties[J].Bioorg Med Chem,2002,10(8):2497-2509.
[8]Selga A,Torres JL.Efficient preparation of catechin thio conjugates by one step extraction/deplymerization of pine(Pinus pinaster) bark procyanidins[J].J Agric Food Chem,2005,53(20):7760-7765.
[9]Nonaka G-I,Sun BX,Yuan L,etal.Sulfur-containing proanthocyanidin oligomer composition and process for producing the same[P].PCT WO 2004/103988 A1,2004.
[10]Mitjans M,Del Campo J,Abajo C,etal.Immunomodulatory activity of a new family of antioxidants obtained from grape polyphenols[J].J Agric Food Chem,2004,52(24):7297-7299.
[11]Torres JL,Lozano C,Maher P.Conjugation of catechins with cysteine generates antioxidant compounds with enhanced neuroprotective activity[J].Phytochemistry,2005,66(17):2032-2037.
[12]Tomobe K,Fujii H,Sun BX,etal.Modulation of infection-induced inflammation and locomotive deficit and longevity in senescence-accelerated mice-prone(SAMP8) model by the oligomerized polyphenol oligonol[J].Biomed Pharmacother,2007,61(7):427-434.
[13]Tanaka T,Yoshitake N,Zhao P,etal.Production of oligomeric proanthocyanidins by fragmentation of polymers[J].Jap J Food Chem,2007,14(3):134-139.
[14]李美娟,劳乔聪,姜永新,等.几种植物原花青素及其片段化产物的抗ROS活性评价[J].西部林业科学,2014,43(1):99-103.
[15]姜永新,朱宏涛,王军民,等.松树皮原花青素片段化产物的LC-ESI-MS分析[J].林产化学与工业,2013,33(4):117-120.
[16]尹继庭,朱宏涛,王军民,等.葡萄籽原花青素降解产物的LC-ESI-MS分析[J].食品研究与开发,2013,34(20):76-78.
[17]姜力,朱宏涛,王军民,等.木瓜多聚原花青素降解产物的液相色谱-电喷雾质谱分析[J].安徽农业科学,2012,40(31):15095-15096.
[18]张镜,廖富林,陈梓云,等.阴香果实花色苷的体外抗氧化活性[J].食品科学,2011,32(17):128-132.
[19]Zhu F,Cai YZ,Sun M,etal.Comparison of major phenolic constituents and in vitro antioxidant activity of diverse Kudingcha genotypes fromIlexkudingcha,Ilexcornuta,andLigustrumrobustum[J].J Agric Food Chem,2009,57(14):6082-6089.
[20]Hashimoto F,Nonaka G-I,Nishioka I.Tannins and related compounds.XC.8-C-Ascorbyl(-)-epigallocatechin 3-O-gallate and novel dimeric flavan-3-ols,oolonghomobisflavans A and B,from oolong tea.(3)[J].Chem Pharm Bull,1989,37(12):3255-3263.
Identification and Activities of the Fragmented Product of
Polymeric Proanthocyanidins from Pine Barks
LI Na1, DAN Han-long1, JIANG Yong-xin1, LI Mei-juan2, ZHANG Jia-yan2, ZHAO Ping1
(1.Yunnan Key Laboratory of Wood Adhesives and Glue Products,Southwest Forestry University,Kunming Yunnan 650224,P.R.China;
2.College of Material Engineering,Southwest Forestry University,Kunming Yunnan 650224,P.R.China)
Abstract:A principal product in the fragmented reaction of polymeric proanthocyanidins from the barks of Pinus kesiya var.langbianensis and P.massoniana with tea polyphenols was isolated by column chromatographies,respectively.On the basis of MS,1H NMR and13C NMR spectroscopic analyses,its structure was established as (-)-epicatechin-(4β-8)-(-)-epigallocatechin 3-O-gallate (1).The results showed that the EGCG in tea polyphenols plays an important role in the fragmentation reaction,which attached to the cation at C-4 of (-)-epicatechin by 4β-8 linkness to form 1.The antioxidant activities of 1 were evaluated by DPPH and ABTS radical scavenging activity assays.Its scavenging capacities against DPPH and ABTS free radicals with SC50values of 6.12±0.03 g/mL and 41.41±0.66 g/mL were higher than those of tea polyphenols,polymeric proanthocyanidins and their fragmented products,respectively.
Key words:Pine barks;Pinus kesiya var.langbianensis; Pinus massoniana; polymeric proanthocyanidins; fragmented product; isolation and identification; antioxidant activity
中图分类号:TQ 35
文献标识码:A
文章编号:1672-8246(2015)05-0076-05
通讯作者简介:赵平(1965-),男,研究员,博士,主要从事天然产物化学研究。E-mail:hypzhao@yahoo.com
作者简介:第一李娜(1990-),女,硕士研究生,主要从事天然产物化学研究。E-mail:576909424@qq.com
基金项目:国家自然科学基金地区科学项目(31260163)、云南省教育厅科学研究基金重大专项(ZD2010006)。
收稿日期:*2015-04-07
doi10.16473/j.cnki.xblykx1972.2015.05.015

