青贮饲料用乳酸菌发酵剂冻干保护剂的筛选
焦月华,张爽,黄晓峰,姜波,赵良友,严妍,朴成玉
(1.黑龙江省中医药大学药物安全性评价中心,哈尔滨150040;2.东北农业大学食品学院,哈尔滨150030;3.黑龙江生物科技职业学院,哈尔滨150025)
0 引言
青贮饲料的质量直接影响反刍动物的生产性能,而青贮饲料所用乳酸菌对其质量起决定性作用,我国在青贮饲料用直投式乳酸菌发酵剂的研究与应用方面十分薄弱。乳酸菌直投式发酵剂的制备通常采用真空冷冻干燥技术,在冻干过程中部分菌体细胞会受损甚至死亡[1],使菌体细胞的发酵活力下降,冻干保护剂可有效减少菌体所受伤害。本研究以从青贮饲料中分离并筛选得到的1株用于青贮饲料制作的优良植物乳杆菌(Lactobacillus plantarum,Lp1)为研究对象,选取了4种公认保护效果较好的冻干保护剂[2-5],采用单因素和正交试验比较了不同的冻干保护剂对其菌体细胞冻干后存活率的影响,以期确定最佳的冻干保护剂配方,从而为青贮饲料用乳酸菌直投式发酵剂在畜牧行业的应用奠定基础。
1 实验
1.1 材料与设备
1.1.1 菌株来源
植物乳杆菌(Lactobacillus plantarum)Lp1,本实验室保存。分离自优质的青贮玉米饲料,经前期实验已初步确定具有较强的产酸能力和产酸速率,可用于制作青贮饲料。
1.1.2 试剂和培养基
脱脂乳粉(进口),海藻糖,三聚磷酸钾,抗坏血酸,葡萄糖,蛋白胨,牛肉膏,酵母粉,其余试剂均为国产或进口分析纯。
MRS培养基:蛋白胨10 g,牛肉膏10 g,酵母粉5 g,葡萄糖20 g,Tween-80 1g,乙酸钠5 g,硫酸镁0.58 g,硫酸锰0.25 g,柠檬酸氢二铵2 g,磷酸氢二钾2 g,蒸馏水1L,pH值为5.8~6.0,121℃灭菌15 min。
1.1.3 仪器和设备
高速冷冻离心机(TGL-16G),培养箱(DHPP272),光学显微镜,超净工作台(VD-1320),CHRIST ALPHA 1-4型冻干机。
1.2 方法
1.2.1 菌体的活化与培养
将实验室保存的植物乳杆菌Lp1接入到MRS液体培养基中,在37℃下培养,每24 h传代一次,均按照体积分数为1.5%的接种量接种,活化两次。随后将活化后的菌液以体积分数为3%的接种量接种到100 mL的MRS液体培养基中,在37℃下培养至稳定期初期(14 h)后收集菌体。
1.2.2 浓缩发酵剂的制备和真空冷冻干燥
将植物乳杆菌Lp1的发酵液在4℃下,以6 000 g,离心20 min,在无菌操作台中弃掉上清液,用灭菌生理盐水洗涤菌泥2次,随后用1/10原发酵液体积的灭菌生理盐水充分悬浮混合菌体,接着4℃离心收集菌体,弃去上清液,然后加入等体积的不同浓度的冻干保护剂后充分震荡,混匀菌悬液。将菌悬液样品放置在-80℃预冻12 h后,放入真空冷冻干燥机中进行冻干,利用冻干后菌体细胞的存活率来比较冻干保护剂的效果。
1.2.3 菌体细胞存活率计算
采用梯度稀释平板活菌计数法,分别对冻干前的菌悬液样品和冻干后的样品进行活菌计数,其中冻干后的菌粉计数时,先向冻干菌粉中加入与冻干前等体积的灭菌生理盐水进行复水,随后将平板在37℃下培养48 h后计活菌数,测定菌体细胞冻干存活率。
菌体细胞存活率=1mL冻干后样品中的活菌数/1mL冻干前样品中的活菌数×100%。
1.2.4 冻干保护剂单因素的确定
根据目前的研究进展,选取的4种保护剂的质量浓度分别如下:海藻糖为10,20,40,60,80 g/L[3,6-7];脱脂乳为10,50,100,150,200 g/L[2,4,7];三聚磷酸钾为5,10,15,20,25 g/L[5];抗坏血酸为10,20,30,40,50 g/L[4-5,7]。
1.2.5 冻干保护剂的正交组合确定
根据单因素的变化趋势,综合考虑保护效果和成本因素,选出各因素最适宜的质量浓度水平范围,设计正交组合优化冻干保护剂的复配,具体的因素水平如表1所示。
1.3 统计分析
试验数据采用SPSS 17.0软件进行单因素方差分析,并用Duncan's法进行多重比较,结果以“平均值±标准误”表示。

表1 因素水平编码 g/L
2 结果与分析
2.1 冻干保护剂的单因素实验结果
图1为冻干保护剂对冻干后菌体细胞存活率的影响。由图1可以看出,与不添加任何冻干保护剂相比,所有冻干保护剂在冻干过程中对菌体细胞都具有不同程度的保护作用。其中,由图1(a)可知脱脂乳质量浓度选为50,100,150 g/L时保护效果较好;由图1(b)可以看出,海藻糖质量浓度为20,40,60 g/L和80 g/L时菌粉冻干存活率较高,由于考虑成本,所以选择质量浓度为20,40,60 g/L作为后续正交实验的水平;由图1(c)可以看出,三聚磷酸钾的质量浓度为10,15,20g/L时保护效果最佳;由图1(d)可以看出,抗坏血酸质量浓度为20,30,40 g/L时保护效果较好。
2.2 冻干保护剂的正交组合优化实验结果
比较图1和表2可知,添加各单一冻干保护剂的乳酸菌在冻干后细胞的存活率在30.25%~70.43%,而添加正交实验中9种复合冻干保护剂的乳酸菌菌体细胞的冻干存活率在71.45%~92.18%,表明复合冻干保护剂对乳酸菌菌体细胞的保护效果比单一冻干保护剂的保护效果好。
由表2可以看出,影响植物乳杆菌Lp1冻干后菌体细胞存活率的因素主次顺序为B>C>D>A,海藻糖的效果最明显,三聚磷酸钾次之,再次为抗坏血酸,影响最小的为脱脂乳,最佳保护剂配方为A2B2C3D2,但是优化出的最优组合未出现在正交实验组,为了进一步确定正交实验的准确性,在相同条件下,对A2B2C3D2组合与A2B3C1D2组合进行了一次验证实验。结果表明,植物乳杆菌Lp1菌体细胞的冻干存活率为95.47%,高于实验组细胞存活率的最大值。因此确定A2B2C3D2为最佳的复合冻干保护剂组合,即脱脂乳100 g/L,海藻糖40 g/L,三聚磷酸钾20 g/L,抗坏血酸30 g/L(均为质量浓度)。
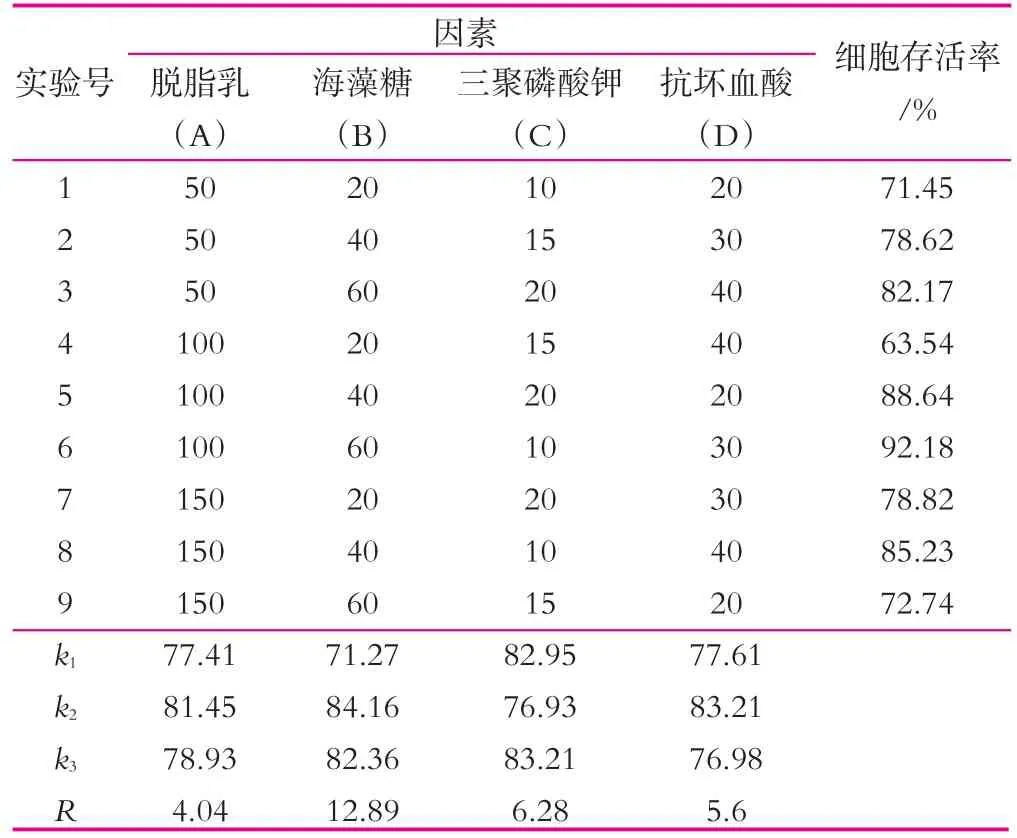
表2 因素水平编码 g/L

图1 对冻干后菌体细胞存活率的影响
3 讨论
乳酸菌直投式发酵剂一般是通过真空冷冻干燥制备而成的,它具有活菌数高、菌体细胞活力强、不易被污染和易于运输保藏等优点。许多研究表明[2,5],在乳酸菌的冷冻干燥过程中,若直接进行冷冻干燥,其死亡率将达90%以上,因此选择合适的冻干保护剂至关重要,单一保护剂不能满足菌体抵抗外界恶劣条件的要求[8],本研究也证实了这一点,正交试验中9种复合冻干保护剂对菌体细胞的保护效果全部都优于各单一冻干保护剂的保护效果,而未添加冻干保护剂的植物乳杆菌菌体细胞在冻干后的死亡率接近96%。本研究选择脱脂乳、海藻糖、三聚磷酸钾和抗坏血酸作为保护剂,主要原因包括如下几点。脱脂乳不管单独使用还是与其他冻干保护剂混合使用均具有良好的保护作用,它在冻干过程中能使溶液呈过冷状态[2],抑制细胞内蛋白质的变性失活,维持细胞内稳态以降低细胞死亡率,另外,它含有大量的蛋白质,能够减少细胞暴露于氧气和介质中的表面积,给细胞提供了保护性的外衣,减少细胞壁损伤[9]。海藻糖在冻干过程中能扩散至胞内并填充在胞内酶和其他蛋白质等活性大分子周围,当细胞失水时,海藻糖的羟基可与胞内的生物活性大分子的极性基团形成氢键,代替极性基团周围失去的水分子,从而维持胞内蛋白质分子的稳定性[3]。抗坏血酸的羟基能够与乳酸菌菌体细胞壁中磷脂分子的磷酸基团之间形成氢键,从而抑制细胞膜因失水而受损。此外,抗坏血酸还能够减少氧气分子对冻干菌粉的氧化作用,如不添加抗坏血酸,则在储存过程中,冻干菌粉会随着水分活度的增加而发生褐变,从而导致颜色变深[10]。三聚磷酸钾能够在胞内液中结合水分子,发生水合作用,使胞内液的粘性增加[5],从而在冻干过程中弱化了水的结晶过程,降低了体系中水转化成冰的比例,使其直接进入升华阶段。
4 结论
通过单因素和正交试验筛选出最佳的冻干保护剂配方为:脱脂奶粉100 g/L,海藻糖40 g/L,三聚磷酸钾20 g/L,抗坏血酸30 g/L(均为质量浓度)。,冻干后的发酵剂中菌体细胞的存活率为95.47%,对植物乳杆菌Lp1具有良好的保护效果,为青贮用直投式乳酸菌发酵剂的大规模应用奠定了基础。
[1]HAN B,BISCHOF J C.Direct cell injury associated with eutectic crystallization during freezing[J].Cryobiology,2004,48(1):8-21.
[2]赵静,梁金钟.直投式产γ-氨基丁酸植物乳杆菌冻干保护剂生产工艺的优化[J].食品工业科技,2015,36(09):140-143.
[3]陈俊亮,张慧芸,田芬,等.乳酸乳球菌乳脂亚种冷冻干燥保护剂优化及其贮藏稳定性[J].食品科学,2014,35(11):109-114.
[4]方义川,杨虹坤,何谦,等.直投式乳酸菌发酵剂的研制[J].现代食品科技,2012,28(08):990-994.
[5]沈国华,华颖,刘大群,等.乳酸菌发酵剂冻干工艺优化及过程机理分析[J].中国食品学报,2010,10(3):152-156.
[6]PATIST A,ZOERB H.Preservation mechanisms of trehalose in food and biosystems[J].Colloids and Surfaces B:Biointerfaces,2005,40(2):107-113.
[7]田芬,陈俊亮,霍贵成.益生菌冻干保护剂优化及菌粉保存稳定性研究[J].食品科技,2012,37(2):15-19.
[8]朱东升,马鎏鎏,李青青,等.嗜酸乳杆菌冷冻干燥过程中保护剂的筛选及液氮预冻[J].食品科学,2010,31(1):198-200.
[9]CARBALHO A,SILVA J,HO P,et al.Relevant factors for the prepa⁃ration of freeze-dried lactic acid bacteria[J].International Dairy Jour⁃nal,2004,14(10):835-847.
[10]KURTMANN L,CARLSEN C U,RISBO J,et al.Storage stability of freeze-dried Lactobacillus acidophilus(La-5)in relation to water activity and presence of oxygen and ascorbate[J].Cryobiology,2009,58(2):175-180.

