外科治疗食管呼吸道瘘
——附7例报道
王洪涛,王国磊,王文光,陈宇航
河南省胸科医院胸部肿瘤科,河南 郑州 450008
外科治疗食管呼吸道瘘
——附7例报道
王洪涛,王国磊,王文光,陈宇航
河南省胸科医院胸部肿瘤科,河南 郑州 450008
背景与目的:食管呼吸道瘘常存在危及生命的肺部感染,临床上处理较棘手,虽经内科保守治疗或支架介入治疗可短期控制肺部感染,但患者的生活质量低,总生存期短。该研究旨在探讨食管呼吸道瘘外科治疗的手术效果及安全性。方法:回顾性分析河南省胸科医院2009年6月—2013年10月外科治疗7例食管呼吸道瘘患者的临床资料。致瘘原因为食管癌4例,先天性1例,食管憩室1例,外伤性1例。7例患者均行开胸手术治疗,其中食管部分切除(胃代食管)+肺叶切除2例;食管部分切除(胃代食管)+气管瘘口修补1例,残胃瘘口修补+肺叶切除1例,食管瘘口修补+肺叶切除2例,食管气管瘘与瘘管双重结扎1例。结果:围手术期无死亡情况发生。术后并发症发生率为57%(4/7),2例术后并发严重肺部感染;1例术后出现食管胃吻合口气管瘘,择期行空肠造瘘;1例术后并发胸腔感染。6例患者恢复后均经口正常进食。术后随访:3例良性病变患者1年无复发;4例恶性病变患者平均生存时间为18.8个月(11~28个月)。结论:良性食管呼吸道瘘一旦确诊,应积极行手术治疗;恶性食管呼吸道瘘依据患者病情和体质选择手术治疗,改善生活质量,延长生存时间。
食管气管瘘;食管支气管瘘;外科治疗
食管呼吸道瘘临床少见,病因复杂,治疗方法多样,疗效不一。本研究总结河南省胸科医院2009年6月—2013年10月外科手术治疗7例食管呼吸道瘘患者的技术方法和诊治体会,以提供临床参考借鉴。
1 资料和方法
1.1 一般资料
本组7例患者中男性5例,女性2例;年龄35~69岁,平均年龄50.6岁,发病到确诊1周~20余年。7例患者均有咳嗽、咳痰及发热病史,流质进食后出现不同程度的咳嗽加重或呛咳。致瘘病因:食管胸中段癌1例;食管癌全量放疗后2例,其中1例放疗结束因食管狭窄置入支架后出现食管气管瘘;食管癌术后1例;食管憩室穿孔1例;先天性1例;外伤致食管破裂修补术后1例。全部患者诊断明确,经食管造影(钡餐或泛影葡胺)确诊5例(图1),支气管镜及胃镜确诊1例(图2、3为同一患者),胸部CT确诊1例(图4)。食管气管瘘2例,食管支气管瘘5例,其中右主支气管4例,左主支气管1例,患者临床资料见表1。
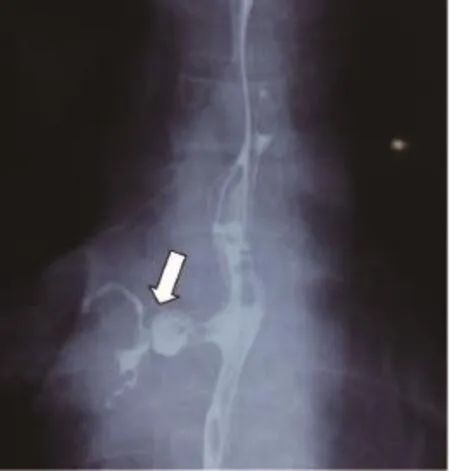
图 1 食管造影见食管支气管瘘口Fig. 1 Esophagogram revealed esophagobronchial fistula
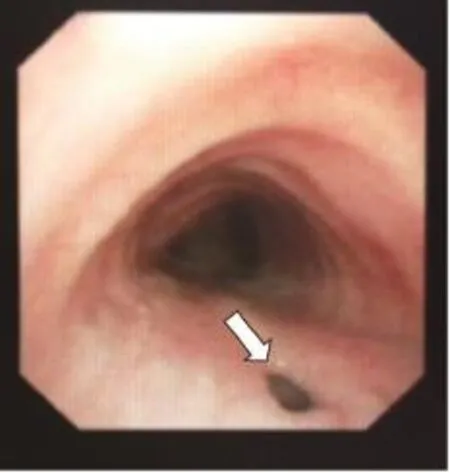
图 2 支气管镜下见气管瘘口Fig. 2 Bronchoscopy showed tracheal fistula
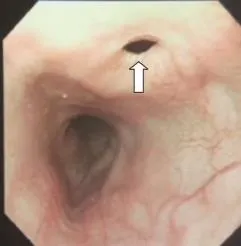
图 3 胃镜下见食管瘘口Fig. 3 Gastroscopy showed esophageal fistula
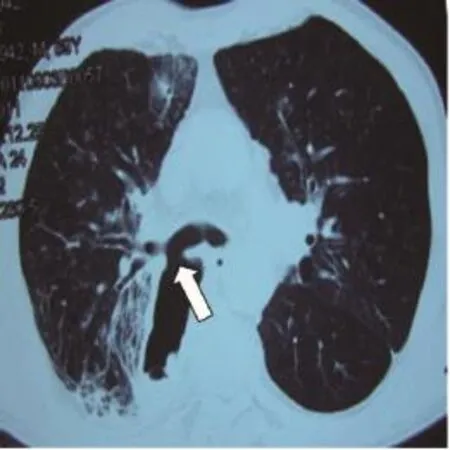
图 4 胸部CT示胸胃支气管瘘Fig. 4 Computed tomography showed thoracic-gastric-bronchial fistula
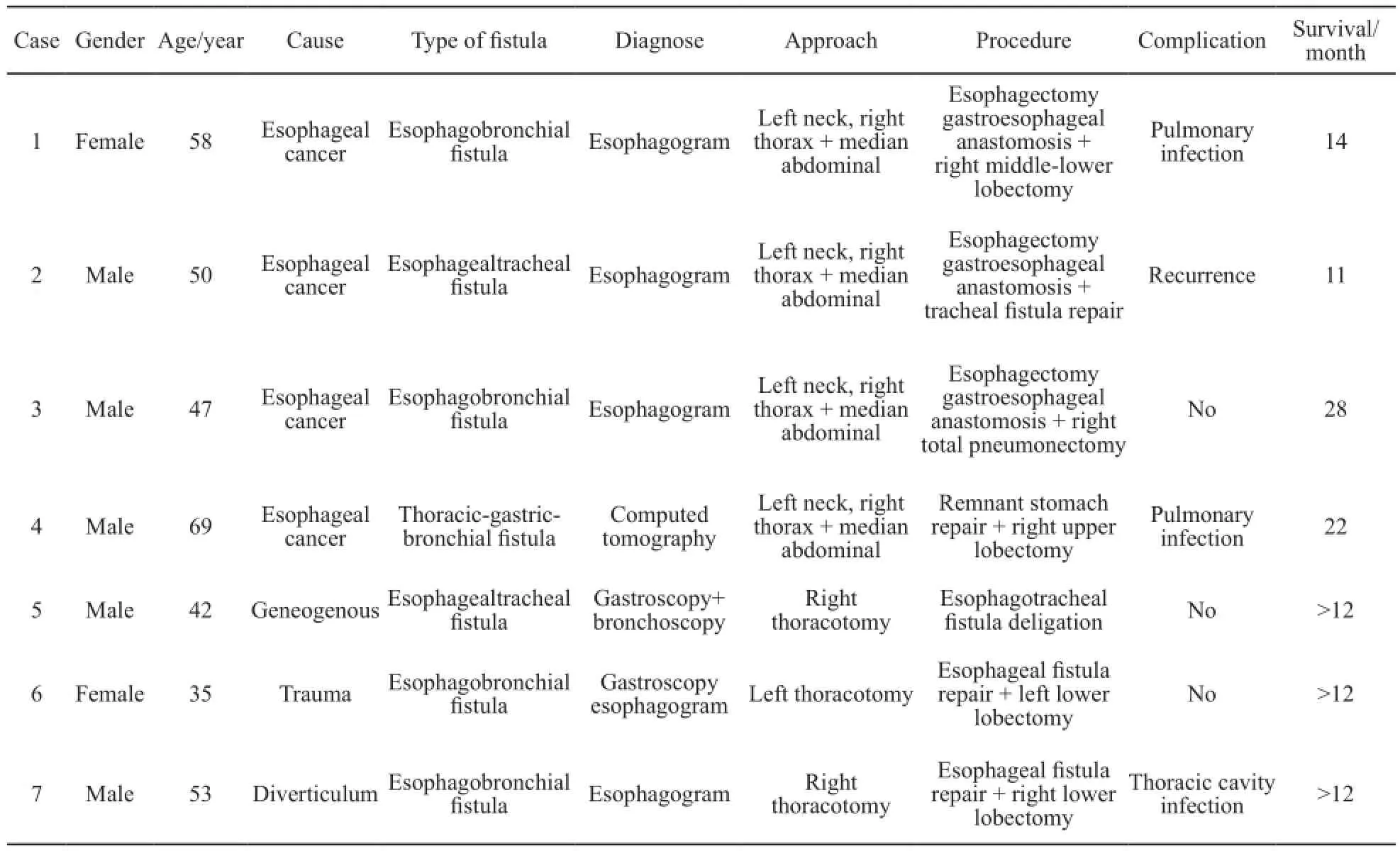
表 1 7例患者临床资料Tab. 1 The clinical data of 7 patients
1.2 术前准备
1.2.1 术前评估
全组患者术前行常规心肺功能检查,了解手术耐受性。对食管癌及食管癌放疗后患者行胸、腹部增强CT检查,了解肿瘤外侵及纵隔和上腹部淋巴结情况,同时排除肿瘤远处转移,判断手术的可行性,制定手术方案。
1.2.2 营养支持
由于患者存在食管呼吸道瘘不适合经口正常进食,造成营养摄取不足,且反复的肺部感染,加重自身营养的消耗,术前给予静脉高营养,同时留置胃十二指肠营养管肠内营养治疗,纠正贫血、低蛋白血症、电解质及酸碱平衡紊乱。
1.2.3 控制感染
禁食水,避免食物进一步漏入呼吸道,给以雾化吸入,鼓励患者有效咳嗽、排痰,结合痰培养及药敏结果合理联合应用敏感抗菌药物。
1.3 手术方式
依据患者病因及瘘口位置选择不同的手术方式:①食管癌并右肺下叶支气管瘘,因右下肺感染严重并形成巨大脓腔(图5),右开胸行食管部分切除(胃代食管)+右肺中下叶切除术;②食管癌放疗结束食管狭窄因支架置入磨损形成食管气管瘘,右开胸行食管部分切除,胃代食管+气管瘘口修补术;③食管癌放疗后食管右主支气管瘘,右开胸术中见肿瘤侵犯右主支气管累及中间干支气管管口,行食管部分切除胃代食管+右全肺切除术(图6~7);④食管癌术后食管右主支气管瘘,因瘘口较大,先行给予带膜支架封堵,封堵后仍有线性外漏,改善患者一般状况后,右开胸行残胃瘘口修补+右肺上叶袖式切除术;⑤先天性气管食管瘘右开胸术中探查见瘘管呈条索状(图8),给予瘘管双重结扎;⑥食管外伤破裂外院行食管修补后继发食管左下叶支气管瘘,左开胸行食管瘘口修补+左肺下叶切除术;⑦食管憩室穿孔右肺下叶形成食管右下叶支气管瘘,右开胸行憩室切除食管瘘口修补+右肺下叶切除术。
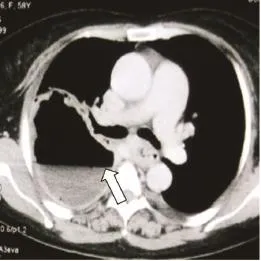
图 5 食管支气管瘘并巨大脓腔Fig. 5 Esophagobronchial fistula and giant abscess cavity
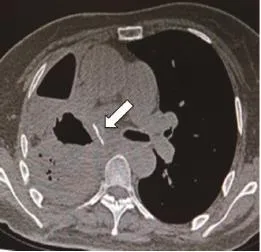
图 6 胸部CT示术后右主支气管残端Fig. 6 CT scan showed right main bronchial stump after operation
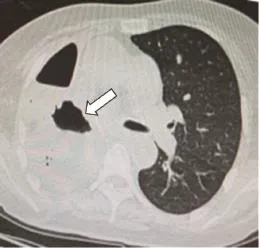
图 7 胸部CT示术后胸腔胃Fig. 7 CT scan showing thoracic stomach after operation
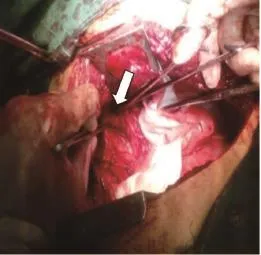
图 8 术中见食管支气管瘘管Fig. 8 Esophagobronchial fistula during operation
2 结 果
全组患者围手术期无死亡发生。术后4例出现并发症,明显较一般的食管或肺叶切除手术并发症增高,其中2例术后并发严重肺部感染,经痰培养联合应用敏感抗菌药物,反复床旁支气管镜吸痰后康复出院;1例术后食管残端阳性并发颈部吻合口瘘局部感染致气管瘘口修补失败,再次出现食管胃吻合口气管瘘,依靠鼻十二指肠营养管肠内营养支持,恢复后无明显肺部感染,但反复咳嗽、白痰,术后4个月余出院,患者出院3个月后因觉得置鼻十二指肠营养管外出活动时遭受歧视而入院择期行空肠造瘘;1例术后并发胸腔感染,经全身抗炎,充分引流及营养支持后出院。6例患者术后恢复后均经口正常进食。术后随访良性病变致瘘1年无复发,恶性病变致瘘生存时间最短11个月,最长28个月,3例死于肿瘤复发转移,1例死于肺部感染。
3 讨 论
食管呼吸道瘘是胸外科少见疾病,分为先天性和获得性,以后者居多。良性获得性食管呼吸道瘘最常见的病因是气管插管相关性损伤[1],亦可见于手术、创伤及憩室等,而恶性获得性食管呼吸道瘘往
往是恶性肿瘤自身发展或放化疗治疗过程中出现的严重并发症,常见于食管癌和肺癌。
瘘的临床症状取决于瘘口的位置及大小,常表现为反复的呼吸道感染,典型的进食呛咳食物症状并不多见,有时亦因临床医师经验不足或症状轻微而被忽视。本组中1例先天性食管气管瘘患者以“肺部感染及支气管扩张症”误诊20余年,因胃部不适胃镜检查时发现食管瘘口方得以确诊;另1例食管癌术后残胃支气管瘘患者,术中清扫淋巴结损伤右侧喉返神经出现声音嘶哑,当患者经口流质进食出现呛咳时误以为声带麻痹所致,术后复查胸部CT发现存在瘘口。
临床诊断主要依靠食管造影剂及内窥镜检查。对于疑似食管呼吸道瘘的患者,我们认为首选可吸收的水溶性造影剂(如泛影葡胺),与钡餐相比,一方面更容易发现较小的瘘口,另一方面即使造影剂漏入气管和支气管也可以吸收,不会加重肺部感染的症状。支气管镜及胃镜均可直视瘘口的大小和部位,至于在发现瘘口敏感性的程度上两种内镜检查方法存在不同的看法,但对于准备外科手术治疗的患者,同时进行两种内镜检查将有助于制定手术治疗方案。
食管呼吸道瘘可引起不同程度的难治性肺部感染,治疗困难,病死率较高,需全面评估治疗风险,选择合理的治疗方案。食管呼吸道瘘治疗关键是处理食管和呼吸道之间的异常交通,避免消化液污染呼吸道,恢复患者经口正常进食。近年来不断有报道[2-3]通过应用支架封堵瘘口的介入方法治疗食管呼吸道瘘,虽然在临床上取得了一定的短期效果,但该方法为姑息性治疗,且临床并发症较多。本组1例食管癌放化疗后食管狭窄患者行金属支架置入,2个月后因支架磨损出现食管气管瘘,我们认为该方法仅适合于不能手术的晚期肿瘤或体质差患者,缓解终末期的痛苦。外科手术治疗既能切除肿瘤病灶,又能清除胸腔内感染源,特别对于良性食管呼吸道瘘则可以达到完全治愈的目的。因此,它是治疗食管呼吸道瘘的主要手段,只要存在手术指征,就应该积极准备手术治疗[1,4-5]。
手术原则上,良性食管呼吸道瘘以瘘口修补为主,恶性食管呼吸道瘘以最大程度切除肿瘤组织,尽可能切除病变肺组织及丧失功能的肺组织。对于良性瘘口修补首要的是瘘口寻找和分离,术中借助胃镜检查光源易于确定瘘口位置,食管瘘口采取黏膜层和肌层的分层缝合;气管瘘口多切除吻合,小的瘘口亦可直接缝合修补;因支气管瘘常合并肺部反复感染多行肺叶切除。多数学者提出在瘘口修补后使用胸膜、肌瓣等活组织再行覆盖预防复发[6-7]。我们对本组中4例患者在完成瘘口修补后也尝试此方法促进组织再血管化并用生物胶进行局部喷洒,除1例高位气管瘘患者因并发颈部吻合口瘘引发局部感染,造成气管瘘口修补失败外,其他患者均获得良好的效果。对于恶性食管呼吸道瘘需按恶性肿瘤扩大手术切除处理,一般食管次全切除,同时切除支气管瘘口及受侵犯的病变肺组织和无功能肺组织。胃是最常用的食管替代器官,其次是结肠。本组中3例食管癌患者行食管部分切除胃代食管手术,考虑到3例患者中或存在胸腔感染或放射治疗史,为避免影响吻合口愈合,我们全部选择胃代食管的颈部吻合。我们不赞成雷杰等[8]提出的“术前呼吸系统症状严重,瘘口直径大,肺部感染重或伴有胸腔内感染者,首选结肠代食管术”的做法,我们认为只有在做过胃部手术或其他不适合胃代食管的情况下选择结肠代食管,因为结肠代食管术前肠道准备要求高,手术复杂、创伤大,且术中增加了两个吻合口,在肺部或胸腔感染严重的情况下存在吻合口愈合不良的风险。近年来胸腔镜微创技术的日益成熟,已有胸腔镜下行简单先天性食管气管瘘手术治疗的报道[9],预示着微创手术有可能作为一种新的治疗手段,给部分食管气管瘘患者提供创伤小、痛苦少、恢复快的治疗选择。
在治疗过程中我们有几点体会:
①严控手术指征:恶性食管呼吸道瘘毕竟是恶性肿瘤的局部晚期表现,需全面评估手术可行性,一般胸中上段食管癌穿孔多侵犯周围组织,切除困难或无法完全切除,本组2例患者病情局部较晚,行放疗或化疗,出现瘘时之所以能够手术切除是经前期治疗后病情缓解,瘤体缩小,其中1例患者仍未能完全切除,食管残端见癌细胞,术后出现吻合口瘘;②充分的术前准备:特别是患者营养及体质的改善和对肺部感染的控制,对创造手术条件起着非常重要的作用,同时有必要备足血源,术中均见不同程度的胸腔或瘘口周围粘连、纤维化,长期慢性炎性反应刺激致滋生血管丰富,操作时渗出、出血较多,备足血源保证术中安全,本组1例患者术中因持续性渗血及出血约4 000 mL而出现血流动力学不稳定,经及时输血和加快输液速度才避免了严重后果;③适当延长经口进食时间:对于食管瘘口修补的患者术后不宜过早进食,进食前经多体位上消化道造影证实,瘘口完全愈合,因若存在线性瘘口,进食后将可能造成瘘口修补手术的失败;④术后加强营养支持及呼吸道管理:给予雾化吸入同时经静脉给予大剂量化痰药物,充分稀释痰液,协助患者有效咳嗽、排痰,常规痰培养联合使用敏感抗菌药物,必要时反复床旁吸痰,减少肺部并发症,本组2例出现严重肺部感染,1例为食管癌术后右侧喉返神经损伤患者,术后咳嗽效果差,经反复床旁支气管镜吸痰,感染逐步得以控制而治愈,另1例食管部分切除胃代食管+右全肺切除患者手术创伤较大,经应用卡文营养,血浆和人血白蛋白支持及三代头孢菌素治疗,术后仅出现低热(考虑胸腔积液吸收热)而未发生严重并发症,除与患者年轻和自身体质好有关外,重要的是术后的营养支持及呼吸道管理。
良性病变所致的瘘经手术治疗能够达到根治的目的。恶性病变所致的瘘患者预后较差,内科保守治疗和内镜介入治疗为姑息性治疗方法,患者的生存时间较短,而外科手术治疗则能够为患者争取更长的生存时间和较好的生活质量,从本组手术治疗结果看,虽然恶性食管呼吸道瘘术后并发症相对较高,只要有手术机会,经过术前充分准备和术后加强管理仍可取得良好的治疗效果(1例患者即使术后食管残端阳性仍存活11个月)。所以对于良性病变所致的食管呼吸道瘘患者一旦确诊,应积极行手术治疗,恶性病变所致的食管呼吸道瘘应依据患者病情和体质选择性手术治疗,达到改善生活质量,延长生存时间的目的。
[1] REED M F, MATHISEN D J. Tracheoesophageal fistula[J]. Chest Surg Clin N Am, 2003, 13(2): 271-289.
[2] LEHNERT T, BALZER J O, SACHS M. Covered stenting in patients with lifting of gastric and high esophago-tracheal fistula[J]. Eur Radiol, 2011, 13(11): 2548-2551.
[3] RODRIGUEZ A N, DIAZ-JIMENEZ J P. Malignant respiratory-digestive fistulas[J]. Curr Opin Pulm Med, 2010, 16(4): 329-333.
[4] BURT M, DIEHL W, MARTINI N, et al. Malignant esophagorespiratory fistula: management options and survival[J]. Ann Thorac Sury, 1991, 52(6): 1222.
[5] MARULLI G, LOIZZI M, CARDILLO G, et al. Early and late outcome after surgical treatment of acquired non-malignant tracheo-oesophageal fistulae [J]. Eur J Cardiothorac Surg, 2013, 43(6): e155- e161.
[6] 高成新, 黄偶麟, 顾恺时, 等. 成人良性食管气管支气管屡的诊断和治疗[J]. 中华外科杂志1995, 33(2): 71-72.
[7] SHEN K R, ALLEN M S, CASSIVI S D, et al. Surgical management of acquired nonmalignant tracheoesophageal and bronchoesophageal fistulae [J]. Ann Thorac Surg, 2010, 90(3): 914-918.
[8] 雷杰, 张娜, 骆晴, 等. 食管癌食管支气管瘘的外科治疗[J]. 中国胸心血管外科临床杂志, 2012, 19(1): 36-38.
[9] PAROLINI F, MORANDI A, MACCHINI F, et al. Cervical/ thoracotomic/thoracoscopic approaches for H-type congenital tracheo-esophageal fistula: a systematic review[J]. Int J Pediatr Otorhinolaryngol, 2014, 78(7): 985-989.
Surgical treatment for esophagorespiratory fistula: a report of 7 cases
WANG Hongtao, WANG
Guolei, WANG Wenguang, CHEN Yuhang (Department of Thoracic Oncology, Henan Province Chest Hospital, Zhengzhou Henan 450008, China)
CHEN Yuhang E-mail: 441409480@qq.com
Background and purpose: Esophagorespiratory fistula is often accompanied with life-threatening pulmonary infection. Though the pulmonary infection can be controlled temporarily by conservative medical treatment or stent placement, but patients have a poor quality of life and short survival time. This study was to investigate the effectiveness and security of surgical treatment for patients with esophagorespiratory fistula. Methods: We retrospectively analyzed the clinical data of 7 patients with esophagorespiratory fistula after surgical treatment between Jun. 2009 and Oct. 2013 in Henan Province Chest Hospital. The causes were the following: esophageal cancers (4 cases), congenital fistula (1 case), diverticulum (1 case) and trauma (1 case). All patients underwent surgical treatment through thoracotomy. Surgical treatment consisted of esophagectomy gastroesophageal anastomosis and pulmonary lobectomy in 2 patients, esophagectomy gastroesophageal anastomosis and tracheal fistula repair in 1 patient, remnant stomach repair and pulmonary lobectomy in 1 patient, esophageal fistula repair and pulmonary lobectomy in 2 patients and esophagotracheal fistula double deligation in 1 patient. Results: There was no perioperative death. The incidence rate of postoperative complications was 57% (4/7). Two patients got severe pulmonary infection. One patient suffered from esophageal-tracheal fistula recurrence and underwent elective jejunostomy. One patient had thoracic cavity infection. Six patients resumed normal eating after postoperative recovery. Follow-up was acquired in all cases. Three cases with benign fistula remained well without recurrence. Four cases with malignant fistula had an average survival time of 18.8 months (11–28 months). Conclusion: Once congenital esophagorespiratory fistula is confirmed, surgical management is recommended as early as possible. The selective surgical treatment for malignant esophagorespiratory fistulas according to patient’s condition could improve the life quality and lengthen the survival time.
Esophagotracheal fistula; Esophagobronchial fistula; Surgical treatment
10.3969/j.issn.1007-3969.2015.07.010
R735.1
A
1007-3639(2015)07-0549-06
2014-12-17
2015-02-11)
陈宇航 E-mail:441409480@qq.com

