上海人群结直肠癌生存率分析
龚杨明,吴春晓,张敏璐,彭鹏,顾凯,鲍萍萍,黄哲宙,向 梅,郑莹
上海市疾病预防控制中心肿瘤防治科,上海 200336
上海人群结直肠癌生存率分析
龚杨明,吴春晓,张敏璐,彭鹏,顾凯,鲍萍萍,黄哲宙,向 梅,郑莹
上海市疾病预防控制中心肿瘤防治科,上海 200336

郑莹,毕业于上海医科大学,医学硕士,主任医师。现任上海市疾病预防控制中心肿瘤防治科主任。多年从事肿瘤预防控制工作,涵盖肿瘤登记和监测、常见肿瘤社区防治干预、肿瘤筛查和早发现,肿瘤流行病学研究工作以及肿瘤防治的健康教育和科普。共发表学术论文100余篇,其中第一作者或通讯作者的文章40余篇,参加多部专著编写,获得市级以上成果4项,中华预防医学科技奖1项,上海市科技进步奖1项,上海医学科技奖1项。参与制定国际乳腺健康行动组织(The Breast Health Global Initiative,BHGI)《国际乳腺健康和乳腺癌控制指南——实施方案》。兼任中华医学会肿瘤学分会委员、上海市医学会肿瘤专业委员会委员、中国抗癌协会小儿肿瘤专业委员会常务委员、中国卫生信息学会肿瘤登记与监测专业委员会副主任委员。
背景与目的:中国结直肠癌的发病率和死亡率逐年上升,该研究分析了结直肠癌生存率资料,以促进结直肠癌的防治。方法:根据上海市肿瘤登记处收集的2002—2006年结直肠癌登记和生存随访报告资料,采用寿命表法和Ederer Ⅱ法对结直肠癌患者的观察生存率(observed survival,OS)和相对生存率(relative survival,RS)及其相关人口学和疾病状况特征资料进行分析,以反映上海地区人群结直肠癌的生存现况。结果:纳入分析的上海市2002—2006年诊断的结肠癌和直肠癌病例分别为16 682例和11 906例,5年OS分别为48.84%和51.65%,5年RS分别为70.50%和71.31%。各种不同诊断时期别间的生存率差异有统计学意义(P<0.05)。Ⅰ期患者的生存率明显高于Ⅲ期和Ⅳ期。不同性别、年龄、肿瘤组织学类型和居住区域的结直肠癌患者生存情况差异有统计学意义(P<0.05)。女性生存率较男性高,>44~54岁年龄段患者生存率高于其他年龄组,上皮型肿瘤的结肠癌患者生存率高于其他组织学类型的结肠癌患者,非上皮型肿瘤的直肠癌患者生存率高于其他组织学类型的直肠癌患者。过去30年来,上海地区结直肠癌的5年OS和RS都有明显改善。结论:上海市结直肠癌患者的生存水平较高,接近发达国家水平。不同特征人群结直肠癌生存的差异为进一步改善早期筛查和临床诊治提供了发展方向。
结直肠癌;生存率;相对生存率
结直肠癌包括结肠癌和直肠癌,是全球最常见的恶性肿瘤之一。在欧美发达国家,其发病率和死亡率在恶性肿瘤中分别列第4和第2位[1]。在我国,随着经济的发展,居民生活方式日益西方化,倾向于高脂肪和高热量的饮食,结直肠癌的发病率和死亡率逐年上升。根据2012年中国肿瘤登记年报资料显示,结直肠癌无论发病率还是死亡率均居于我国癌症的前列[2]。目前世界各国结直肠癌患者5年相对生存率差异较大,从发展中国家的30%到发达国家的60%[3-4]。各国生存率的差异与当地的结直肠癌早期诊断率有关。生存率作为反映疾病预后及危害程度的重要指标,对于结直肠癌的防治有着非常重要的意义。本研究根据上海市肿瘤登记处收集的结直肠癌登记和生存随访报告资料,对结直肠癌患者的观察生存率(observed survival,OS)和相对生存率(relative survival,RS)及其相关人口学和疾病状况特征资料进行分析,以反映中国大城市地区人群结直肠癌的生存现况。
1 资料和方法
1.1 资料
1.1.1 病例资料
本研究病例资料来源于上海市肿瘤登记处的肿瘤登记系统数据库。根据上海市恶性肿瘤报告办法,全市具有肿瘤诊断能力的180家医院参与恶性肿瘤报告。报告的范围是具有上海市户籍的恶性肿瘤病例。本研究共纳入2002—2006年登记的28 588例结直肠癌病例。本研究中提及的“市区”指中心城区,包括黄浦区、徐汇区、长宁区、静安区、普陀区、虹口区、闸北区和杨浦区,本研究提及的“郊区”指其他9个周围城区,包括闵行区、宝山区、嘉定区、浦东新区、金山区、松江区、奉贤区、青浦区和崇明县。
结直肠癌的组织病理学类型分类按照世界卫生组织出版的《结直肠肿瘤病理学分类》(WHO Histological Classification of Tumors of the Colon and Rectum)分为上皮型肿瘤(epithelial tumors)、非上皮型肿瘤(non-epithelial tumors)和未特指(not specific)[5]三类。
1.1.2 随访资料
所有的病例通过核对死亡信息和社区主动随访获得生存结局资料。随访截止时间为2011年12月31日,所有2002—2006年诊断的病例诊断后随访满5年。
用于核对的死亡资料来源于上海市疾病预防控制中心的上海全死因登记报告系统以及医院报告的恶性肿瘤死亡病例,其中上海全死因登记报告系统覆盖上海户籍的所有死亡病例。通过定期核对,获得并补充病例死亡的结局、
死亡原因和死亡日期等信息。若同一病例不同来源的资料有所不同,则采用全死因登记系统的资料。纳入本研究的病例中,到随访中止时,结肠癌和直肠癌患者死亡的比例分别为64.28%和63.15%,结肠癌和直肠癌患者中死于肿瘤的比例分别为56.43%和55.62%。
上海社区卫生服务系统向所有存活的癌症患者提供规范化的社区随访服务,同时收集生存情况的资料。通过社区主动随访获得的资料,在2002—2006年诊断的病例中,完全随访的比例为99.70%,失访的比例为0.30%,从未随访的比例为0.06%。
在随访中止期满后,对于随访资料中历年撤销随访和未落实随访的病例还进行了入户调查和公安局资料核对两种方式进行再次调查,获得随访期内的生存结局资料。
去除死亡认证病例(death certification only,DCO)29例和从未随访到的病例18例,本研究实际纳入分析的病例为28 588例,其中结肠癌病例16 682例(58.4%),直肠癌病例11 906例(41.6%);男性病例14 752例(51.6%),女性病例13 836例(48.4%)。
1.1.3 人口资料
人口资料来源于上海市公安局定期发布的年中人口数和人口构成。
1.2 数据质量
全部病例的疾病分类编码采用ICD-10(国际疾病分类第10次修订本),肿瘤病理组织学类型编码采用ICD-O-3(国际疾病分类-肿瘤学第3版)。结肠癌的编码为C18,直肠癌的编码为C19和C20。病理组织学诊断比例(histologically verified percentage,HV%)是评价恶性肿瘤登记质量的最重要指标之一,显示了被登记的恶性肿瘤病例的可靠性。纳入分析的病例的病理组织诊断比例为77.76%。
1.3 统计学处理
OS是指观察对象活过多个单位时间的概率,RS为OS与期望生存率之比。期望生存率估算所使用的分析为同年份的人群简略寿命表,由上海市疾病预防控制中心全死因统计系统根据当年死亡实际情况编制。OS采用寿命表法计算,根据同期简略寿命表中的生存概率,用EdererⅡ法计算1~5年RS,不同特征患者间的OS比较采用log-rank检验[6-7],均数的比较采用独立样本的t检验。本研究采用SPSS 22.0软件对数据进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 患者的一般情况
结肠癌患者平均发病年龄为(67.72±0.19)岁,市区患者9 488例(56.9%),郊区患者7 194例(43.1%),诊断时期别中Ⅰ期的比例为4.7%,分期不详的比例为48.5%。组织学类型分类中大部分为上皮型肿瘤,占74.6%。
直肠癌的平均发病年龄为(65.92±0.23)岁,市区患者6 068例(51.0%),郊区患者5 838例(49.0%),诊断时期别中Ⅰ期的比例为6.7%,分期信息不详的比例为52.5%。组织学类型分类中上皮型肿瘤占75.7%。
经检验,结肠癌患者和直肠癌患者的平均发病年龄差异有统计学意义(P<0.05)。结肠癌的平均发病年龄高于直肠癌。无论结肠癌还是直肠癌,发病高峰都在65岁以上,结肠癌患者中65岁及以上占66.0%,直肠癌中65岁及以上患者占59.2%(表1)。
2.2 总生存率
上海市2002—2006年诊断的结直肠癌患者5年OS为50.01%(95%CI:49.42%~50.60%),5年RS为70.86%。结肠癌患者5年OS为48.84%(95%CI:48.02%~49.58%),直肠癌患者5年OS为51.65%(95%CI:50.72%~52.68%),两者间差异有统计学意义(P<0.05),直肠癌患者5年OS略高于结肠癌患者。结肠癌和直肠癌患者的5年RS分别为70.50%和71.31%。
2.3 结肠癌生存率
不同性别结肠癌患者的5年OS差异有统计学意义(P<0.05),女性高于男性。男性和女性结肠癌患者的5年RS分别为72.71%和68.10%。
结肠癌患者中市区和郊区患者的5年OS差异有统计学意义(P<0.05),其中郊区患者的5年OS高于市区患者。市区和郊区的结肠癌患者5年RS分别为69.77%和69.43%。
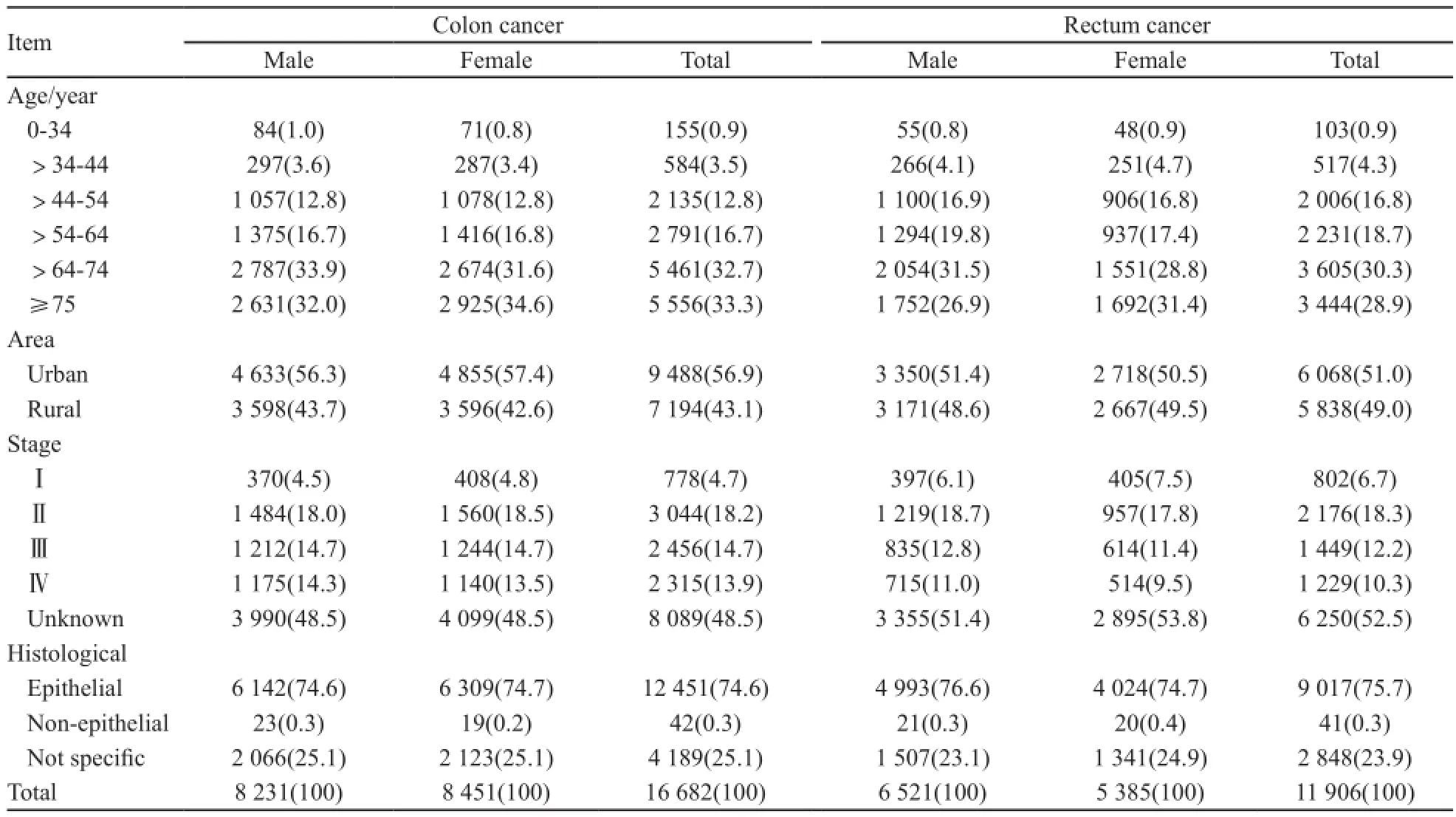
表 1 上海市2002—2006年结直肠癌患者一般情况Tab. 1 Characteristics of colorectal cancer cases in Shanghai from 2002 to 2006[n(%)]
结肠癌患者各年龄段的5年OS差异有统计学意义(P<0.05),其中>44~54岁年龄段5年OS最高。各年龄段结肠癌患者5年RS分别为56.95%、62.58%、65.50%、64.82%、67.63%和90.58%。
不同诊断时期别的结肠癌患者5年OS差异有统计学意义(P<0.05),诊断时为Ⅰ期的结肠癌患者5年OS最高。各个不同期别的结肠癌患者5年RS分别为Ⅰ期98.88%、Ⅱ期96.21%、Ⅲ期71.82%、Ⅳ期28.59%和不详68.01%。
各种不同组织学类型的结肠癌患者5年OS差异有统计学意义(P<0.05),上皮型肿瘤的5年OS高于非上皮型和未特指。同时,上皮型肿瘤的5年RS也高于其他2种类型(表2)。
2.4 直肠癌生存率
不同性别直肠癌患者的5年OS差异有统计学意义(P<0.05),女性高于男性。男性和女性直肠癌患者的5年RS分别为71.70%和71.97%。
市区和郊区直肠癌患者的5年OS差异有统计学意义(P<0.05),郊区患者的5年OS高于市区患者。市区和郊区的直肠癌患者5年RS分别为72.25%和70.48%。
各年龄段直肠癌患者的5年OS差异有统计学意义(P<0.05),>44~54岁年龄段5年OS最高。各年龄段直肠癌患者5年RS分别为56.38%、60.33%、68.02%、68.25%、70.37%和87.56%。
各不同期别的直肠癌患者5年OS差异有统计学意义(P<0.05),诊断时为Ⅰ期的直肠癌患者5年OS最高。各不同期别的直肠癌患者5年RS分别为97.57%、89.94%、65.56%、31.81%和69.15%。
各种不同组织学类型的直肠癌5年OS差异有统计学意义(P<0.05)。非上皮型肿瘤的5年OS高于其他2种类型,各组织学类型直肠癌5年RS分别为76.44%、86.36%和50.29%(表3)。
2.5 生存率的时间变化
从历史资料来看,上海市结直肠癌患者生存率逐年升高[8],自1972—1976年至2002—2006年,男性结肠癌患者5年OS从24.0%上升至
46.3%,女性结肠癌患者5年OS从30.4%上升至48.3%。男性直肠癌患者5年OS从24.9%上升至48.3%,女性结肠癌患者5年OS从26.8%上升至52.6%。结直肠癌患者的RS也同时升高,男性结肠癌患者5年RS从27.4%上升至72.7%,女性结肠癌患者5年RS从33.3%升至68.1%,男性直肠癌患者5年RS从28.0%上升至71.7%,女性直肠癌患者5年RS从29.2%上升至72.0%(图1~4)。
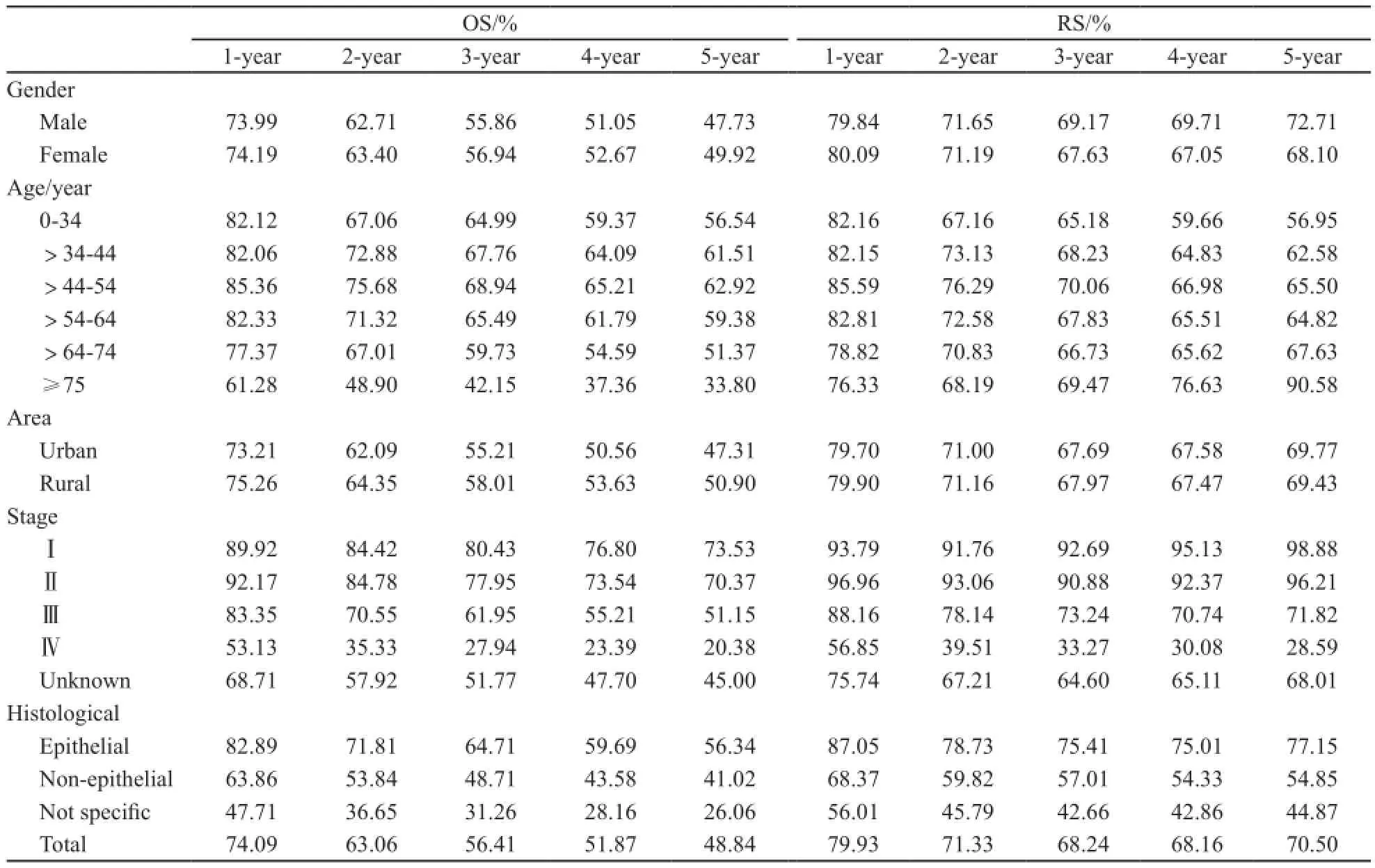
表 2 上海市2002—2006年结肠癌患者OS和RS情况Tab. 2 OS and RS of colon cancer in Shanghai from 2002 to 2006
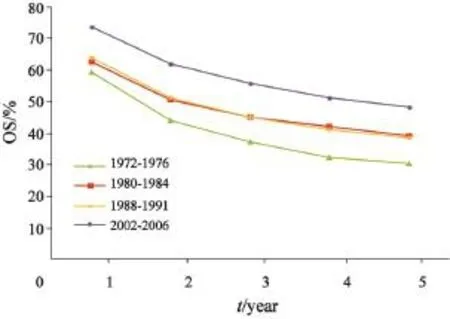
图 2 1972—2006年上海市区女性结肠癌患者OS变化趋势Fig. 2 Trends of OS changes for female colon cancer patients from 1972 to 2006 in Shanghai
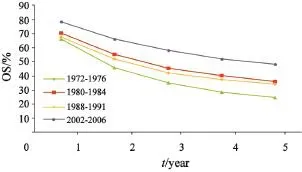
图 3 1972—2006年上海市区男性直肠癌患者OS变化趋势Fig. 3 Trends of OS changes for male rectal cancer patients from 1972 to 2006 in Shanghai
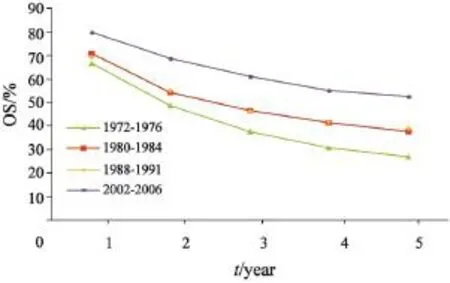
图 4 1972—2006年上海市区女性直肠癌患者OS变化趋势Fig. 4 Trends of OS changes for female rectal cancer patients from 1972 to 2006 in Shanghai
3 讨 论
生存率的分析在恶性肿瘤的研究中非常重要[9]。不同的恶性肿瘤对生存的关注点不同,对于肺癌和胰腺癌等预后较差的恶性肿瘤,通常关注短期生存率,而对于乳腺癌和结直肠癌等预后较好的恶性肿瘤,5年生存率能更好地反映来其长期的生存情况。对于不同人群、不同疾病的患者的生存期及其差异的研究分析,对临床诊治更有重要参考和指引价值。中国结直肠癌生存资料的报道非常罕见,基于临床的资料居多。本研究详细报道了基于人群的大规模病例长期生存的详细资料,数据可靠,随访时间长,失访率低,并深入分析了生存率与人口学和疾病特征的分布和差异,为深入了解我国人群大肠癌的生存状况具有重要价值。
本研究表明,上海地区直肠癌患者的5年OS和RS高于结肠癌患者,结肠癌和直肠癌患者5年OS及RS女性高于男性,郊区患者5年OS高于市区患者,不同诊断时期别的生存率差异较大,Ⅰ期患者的生存情况明显好于其他期别的患者,不同组织学类型的生存率结肠癌和直肠癌呈现出不同的特点。本研究结果显示,直肠癌患者5年OS较结肠癌患者更高。以往研究证据表明,这可能是由于局部和综合性治疗方案的运用增多,如围手术期放疗、全结肠系膜切除术等,使直肠癌患者的5年生存率比结肠癌患者得到更明显的提高[10]。
对不同性别结直肠癌患者的生存情况分析
显示,女性患者的5年OS和RS都高于男性患者,提示女性结直肠癌患者的长期生存情况好于男性。但目前有研究报道性别因素对结直肠癌患者远期生存的影响不显著[11-12]。
无论结肠癌还是直肠癌,上海市郊区患者的5年OS高于市区患者,与国内其他地区的研究结果不同[13]。通常郊区患者的经济条件和医疗条件均低于市区。美国和加拿大的研究结果证明黑人结直肠癌患者的5年OS远低于白人患者,造成这一现象的原因为黑人的社会经济状况低下[14-15]。上海是全国经济最发达的城市之一,市民的社会保障制度比较完善,市区和郊区的资源配置差别越来越小,同时,分析还显示郊区结肠癌和直肠癌患者的5年RS均低于市区患者。通过对不同年龄组市区和郊区结直肠癌患者的5年OS进行比较后发现,无论是结肠癌患者还是直肠癌患者,郊区>44~54岁及>54~64岁年龄段患者的5年OS高于市区且差异有统计学意义(P<0.05),提示郊区患者的5年OS高于市区患者可能是受到年龄因素的影响。
不同年龄段的结肠癌和直肠癌患者的5年OS差异有统计学意义(P<0.05)。>44~54岁年龄段5年OS最高,75岁以上年龄段5年OS最低,0~34岁年龄段结肠癌和直肠癌患者的5年OS都处于各年龄段中较低水平,同时,RS为各年龄段中最低。其中0~34岁年龄段患者Ⅲ期和Ⅳ期5年OS差异无统计学意义(P>0.05)。而其他年龄段患者Ⅲ期5年OS都高于Ⅳ期,造成这一现象的原因可能与中青年结直肠癌患者的恶性程度较高有关[16-17]。Wang等[18]通过分析1992—2006年以来接受根治性切除的结肠癌患者的数据,对40岁及以上和以下的患者进行对比,发现手术中获取的淋巴结平均数和平均受累数量在40岁以下患者中更高,这一结论提示年轻的结直肠癌患者可能面临更大的转移威胁,但年龄是否是影响长期生存的独立因素依然存在争议[19-20]。
对不同诊断时期别的结直肠癌患者生存情况分析显示,无论是OS还是RS都随着期别的升高而降低,结肠癌患者的5年OS从Ⅰ期的73.53%到Ⅳ期的20.38%,5年RS从Ⅰ期的98.88%到Ⅳ期的28.59%,直肠癌患者的5年OS从Ⅰ期的75.93%到Ⅳ期的23.60%,5年RS从Ⅰ期的97.57%到Ⅳ期的31.81%,说明结直肠癌的早期诊断对患者的生存有非常大的影响。美国的研究结果显示,结直肠癌的死亡率下降有50%可归因于筛查工作的开展[21]。本研究中分期不详的病例较多,可能会对结果造成影响。
分析结果显示,不同组织学类型的结直肠癌生存率有差异,且结肠癌和直肠癌的情况不同,结肠癌中上皮性肿瘤的生存率较高,而直肠癌中非上皮性肿瘤生存率较高。有研究表明不同的组织学类型会对生存造成影响[22-23]。但这些资料主要来自于临床,尚未有大规模的人群研究来明确组织学类型和生存率间的关联,同时,本研究分类中非上皮性肿瘤的例数远少于上皮性肿瘤的例数,未特指的组织学类型中包含哪些组织学类型尚不明确。
根据上海市1972—1976年至2002—2006年的结直肠癌患者生存情况历史资料分析显示,结直肠癌患者的5年生存率有了明显的增加。有研究[24-25]报道,结直肠癌的生存率在近30年的持续改善主要是由于综合性治疗方案的普及如联合放化疗,以及新的检测技术的使用,减少了复发和转移的发生,或使得更多发生转移的结直肠癌在早期被发现,这都有助于生存率的改善。另外,诊断时期别对生存率有显著的影响[26],对过去30年各种诊断时期别所占比例的分析将有助于明确生存率改善的原因,但目前这方面的资料无论上海还是全国其他地区都非常缺乏。
欧洲EUROCARE对2000—2007年登记的结直肠癌患者的生存分析显示,有全人群肿瘤登记覆盖的丹麦结直肠癌5年RS为53.6%和54.6%,芬兰为61.2%和60.1%,冰岛为62.0%和73.2%,挪威为59.2%和62.5%,瑞典为61.1%和60.8%,英格兰为51.3%和53.7%[27]。美国对2003—2009年登记的结直肠癌患者的生存分析显示,5年RS为65.4%和67.7%[28]。目前上海地区结直肠癌的5年RS已达到发达国家水平,但单
个城市的水平和整个国家的水平是否存在可比性尚有疑问,需要进一步的研究。
上海地区2002—2006年结直肠癌生存分析结果显示,上海市结直肠癌5年RS已高于世界主流发达国家水平,各种不同诊断时期别间的生存率差异显著。Ⅰ期的5年OS和RS远高于Ⅳ期,说明早期诊断对于改善结直肠癌的生存情况有非常重要的作用。此外,不同性别、年龄、肿瘤组织学类型和居住区域的结直肠癌患者生存情况存在差异,为进一步的研究各种因素对生存和预后的影响提供了线索。
[1] US Cancer Statistics Working Group. United States Cancer Statistics (USCS): 1999-2007 incidence and mortality data[EB/OL]. Atlanta, GA: U.S. Department of Health and Human Services, CDC, National Cancer Institute; 2010, http:// www.cdc.gov/uscs.[2015-01-07].
[2] 赫捷, 陈万青. 2012中国肿瘤登记年报[M]. 北京: 军事医学科学出版社, 2012.
[3] CDC. Screening for colorectal cancer-United States, 1997[EB/OL]. http://www.cdc.gov/mmwr/preview/ mmwrhtml/00056494.htm.[2014-12-18].
[4] 徐富星. 大肠癌研究现状[J]. 国际消化病杂志, 2006, 26: 365-366.
[5] HAMILTION S R, AALTONEN L A. WHO classification of tumours, pathology and genetics of tumors of the digestive system[M]. Fourth edition, Lyon France: IAPC Scientific Publications, 2010(2):104-105.
[6] KAPLAN E L, MEIER P. Nonparametric estimation from incomplete observations [J]. J Am Stat Soc, 1958, 53: 457-481.
[7] ESTEVE J, BENHAMOU E, RAYMOND L. Statistical methods in cancer research, volume Ⅳ: descriptive epidemiology[M]. Lyon France: IARC Scientific Publications, 1994: 247-255.
[8] 高玉堂, 卢伟. 上海市区恶性肿瘤发病率、死亡率和生存率(1973-2000)[M]. 第二军医大学出版社, 2007: 417-419.
[9] 李立明. 流行病学[M]. 第六版, 北京: 人民卫生出版社, 2008, 11: 19.
[10] RENOUF D J, WOODS R, SPEERS C, et al. Improvements in 5-year outcomes of stage Ⅱ/Ⅲ rectal cancer relative to colon cancer [J]. Am J Clin Oncol, 2013, 36(6): 558-564.
[11] 肖景榕, 陈建顺, 周衍. 1989-1998年长乐市10409例恶性肿瘤生存率分析[J]. 中国慢性病预防与控制, 2005, 5: 225-227.
[12] 陈永胜, 丁璐璐, 张永辉. 江苏省启东市2001--2007年结直肠癌患者生存率分析[J]. 中国癌症杂志, 2011, 21(2): 134-139.
[13] 明恒泰, 刘爱民, 顾晓平. 江苏省大丰市恶性肿瘤患者生存率分析[J]. 中国慢性病预防与控制, 2006, 14(5): 325-327.
[14] COLEMAN M P, QUARESMA M, BERRINO F, et al. Cancer survival in five continents: a worldwide population-based study (CONCORD) [J]. Lancet Oncol, 2008, 9: 730-756.
[15] GOREY K M, LUGINAAH I N, HOLOWATY E J. Mediation of the effects of living in extremely poor neighborhoods by health insurance: breast cancer care and survival in California, 1996 to 2011[J]. 2013, 14(12): 6.
[16] 许岸高, 姜泊, 钟旭辉. 广东地区3870例大肠癌的临床流行病学特征[J]. 中华内科杂志, 2006, 45(1): 9-12.
[17] 陈创奇, 方乐堃, 马晋平. 结直肠癌2 042例临床病理特点及预后回归分析[J]. 中华医学杂志, 2010, 26(90): 1804-1807.
[18] WANG L, HOLLENBECK C S, STEWART D B. Node yield and node involvement in young colon cancer patients: is there a difference in cancer survival based on age? [J]. J Gastrointestinal Surg, 2010, 13(9): 1355-1361.
[19] 董丹凤, 李恩孝, 王举波. 结直肠癌预后因素与治疗[J].现代肿瘤医学, 2010, 18(5): 944-947.
[20] 张彬彬. 结直肠癌临床病理特征及预后因素分析[D].山东济南, 山东大学, 2012: 32-33.
[21] EDWARDS B K, WARD E, KOHLER B A, et al. Annual report to the nation on the status of cancer, 1975-2006, featuring colorectal cancer trends and impact of interventions(risk factors, screening, and treatment)to reduce future rates[J]. Cancer, 2010, 116: 544-573.
[22] 梁君林, 万德森, 潘志忠, 等. Dukes C期结直肠癌根治术后复发转移因素的Logistic回归分析[J]. 实用癌症杂志,2003, 18: 495-497.
[23] DICULESCU M, LACOB R, LACOB S, et al. The importance of histopathological and clinical variables in predicting the evolution of colon cancer[J]. Rom J Gastroenterol, 2002, 11: 183-189.
[24] VAN DER GEEST L G, LAM-BOER J, KOOPMAN M, et al. Nationwide trends in incidence, treatment and survival of colorectal cancer patients with synchronous metastases [J]. Clin Exp Metastasis, 2015, 32(5): 457-465.
[25] RODER D, KARAPETIS C S, WATTCHOW D, et al. Colorectal cancer treatment and survival: the experience of major public hospitals in south Australia over three decades[J]. Asian Pac J Cancer Prev, 2015, 16(6): 2431-2440.
[26] JUNG K W, WON Y J, KONG H J, et al. Cancer statistics in Korea: incidence, mortality, survival, and prevalence in 2012[J]. Cancer Res Treat, 2015, 47(2): 127-141.
[27] DE ANGELIS R, SANT M, COLEMAN M P, et al. Cancer survival in Europe 1999-2007 by country and age: results of EUROCARE-5-a population-based study [J]. Lancet Oncol, 2014, 15(1): 23-24.
[28] SIEGEL R, DESANTIS C, JEMAL A. Colorectal cancer statistics, 2014 [J]. CA Cancer J Clin, 2014, 64(2): 104-117.
Colorectal cancer survival analysis in major areas in shanghai China
GONG Yangming, WU
Chunxiao, ZHANG Minlu, PENG Peng, GU Kai, BAO Pingping, HUANG Zhezhou, XIANG Yongmei, ZHENG Ying (Department of Tumor Prevention and Treatment, Shanghai Municipal Center for Disease Control and Prevention, Shanghai 200336, China)
ZHENG Ying E-mail: zhengying@scdc.sh.cn
Background and purpose: The incidence and mortality of colorectal cancer increased gradually in China, cancer survival rate plays an important role in guiding cancer prevention and treatment. Methods: Data of
Colorectal cancer; Survival rate; Relative survival
10.3969/j.issn.1007-3969.2015.07.002
R735.7+5;R735.7+7
A
1007-3639(2015)07-0497-08
2015-02-15
2015-06-20)
郑莹 E-mail:zhengying@scdc.sh.cn
colorectal cancer cases diagnosed during 2002-2006, follow-up information and death report were from Shanghai Cancer Registry, Life Table and Ederer Ⅱ were used to calculate observed survival (OS) and relative survival (RS), the related demographic characteristics and status were also analyzed to reflect the survival situations of the colorectal cancer survivors in major areas in Shanghai. Results: In this study, 16 682 colon cancer cases and 11 906 rectum cancer cases were included in analysis, 5-year OS rates for colon cancer and rectum cancer were 48.84% and 51.65%, RS rates were 70.50% and 71.31%. Significant difference in survival had been found among the various diagnostic stages, the survival rate in stageⅠ was much higher than those in stage Ⅲ and stage Ⅳ. The survival of colorectal cancer patients with different gender, age, tumor histological and residential areas were also found with differences, female was higher than male, age ranged from >44-54 years had the highest survival rates than other age groups. The survival of epithelial tumors was higher than other histologic types in colon cancer, and the survival of non-epithelial tumors was higher than other histologic types in rectum cancer. Over the past 3 decades, the 5-year OS increased dramatically in Shanghai. Conclusion: The level of survival of colorectal cancer in Shanghai is similar with it in developed counties. Colorectal cancer survival rate with different population characteristics may provide suggestions and evidence for further improvement of early screening, diagnosis and treatment.

