雌激素及其代谢产物对去势低氧肺动脉高压大鼠烷烃单加氧酶和低氧诱导因子-1α表达的影响
郑泉,袁雅冬,赵靖
雌激素及其代谢产物对去势低氧肺动脉高压大鼠烷烃单加氧酶和低氧诱导因子-1α表达的影响
郑泉*,袁雅冬,赵靖
目的:探讨17β-雌二醇(E2)及2甲氧基雌二醇(2ME)对去势低氧肺动脉高压大鼠模型中烷烃单加氧酶(AlkB)和低氧诱导因子-1α(HIF-1α)的影响。
方法:选6~7周龄雌性SD大鼠60只,去势手后采用随机数字表法将大鼠随机分为6组:常氧组(n=10),常氧+E2组(n=10),常氧+2ME组(n=10),低氧组(n=10),低氧+E2组(n=10),低氧+2ME组(n=10)。低氧组持续低氧(24 h,8周);2ME组自造模之日起,每日皮下注射2ME(240 μg /kg);E2组每日皮下注射E2(20 μg/kg)。连续饲养8周,以建立低氧性肺动脉高压模型。测量平均肺动脉压(mPAP)后放血处死大鼠,观察右心室肥厚指数(RVHI),苏木素-伊红(HE)染色观察肺小动脉重构情况。采用免疫蛋白印迹法、反转录聚合酶链反应(RT-PCR)测定AlkB、HIF-1α的表达水平。
结果:与常氧组比较,低氧组大鼠肺小动脉管壁增厚管腔变窄明显,mPAP、RVHI均显著升高,低氧+E2组和低氧+2ME组上述形态学改变相对较轻,mPAP、RVHI均显著高于常氧组,且低氧+E2组和低氧+2ME组间无明显差异,常氧+E2组和常氧+2ME组肺小血管形态学无明显变化。HIF-1α表达水平在低氧组显著高于常氧组,低氧+E2组、低氧+2ME组亦升高,升高幅度不及低氧组,常氧+E2组、常氧+2ME组无明显变化。AlkB表达水平在低氧组显著低于常氧组,低氧+E2组、低氧+2ME组亦降低,降低幅度不及低氧组,常氧+E2组、常氧+2ME组无明显变化。
结论:E2和2ME可能通过上调低氧性肺动脉高压大鼠肺组织AlkB的表达,降低HIF-1α表达,进而缓解肺动脉高压。
肺动脉高压;缺氧;17β-雌二醇;2甲氧基雌二醇;低氧诱导因子-1α
Methods: A total of 60 healthy female SD rats with castrated surgery were randomly divided into 6 groups: ①Routine oxygen group, ②Routine oxygen + E2 group, the rats received subcutaneous injection of E2 (20 μg/kg·d), ③Routine oxygen + 2ME group, the rats received 2ME (240 μg/kg·d) and④Hypoxia group,⑤Hypoxia + E2 group, ⑥Hypoxia + 2ME group. n=10 in each group and all animals were treated for 8 weeks to establish the hypoxic pulmonary hypertension model. The mean pulmonary artery pressure (mPAP) was measured after bloodletting, right ventricle hypertrophy index (RVHI) was calculated and small pulmonary artery
remodeling was observed by HE staining. The expression level of HIF-1α and AlkB were examined by RT-PCR and Western blot analysis.
Results: Compared with Routine oxygen group, the rats in Hypoxia group had obviously thickened small pulmonary artery wall with narrowed lumen, increased mPAP and RVHI; the above changes in Hypoxia + E2 and Hypoxia + 2ME groups were relatively smaller, their mPAP and RVHI were higher than Routine oxygen group, while mPAP and RVHI were similar between Hypoxia + E2 and Hypoxia + 2ME groups. There were no real morphological changes in small pulmonary vessels in Routine oxygen + E2 and Routine oxygen + 2ME groups. The HIF-1α expression was obviously elevated in Hypoxia group than Routine oxygen group, while the elevation was less in Hypoxia + E2 and Hypoxia + 2ME groups. HIF-1α expression had no real changes in Routine oxygen+E2 and Routine oxygen + 2ME groups. The AlkB expression was obviously reduced in Hypoxia group than Routine oxygen group, while the reduction was less in Hypoxia + E2 and Hypoxia + 2ME groups. AlkB expression had no real changes in Routine oxygen + E2 and Routine oxygen + 2ME groups.
Conclusion: Estradiol E2 and 2ME could remit pulmonary hypertension which might be via up-regulating AlkB expression and down-regulating HIF-1α expression in experimental rats with hypoxic pulmonary hypertension.
(Chinese Circulation Journal, 2015,30:884.)
肺动脉高压是一组以血管增殖、重构、肺血管床进行性闭塞,肺血管阻力进行性增加为特征,常导致右心衰竭。缺氧性肺动脉高压的形成主要与早期低氧性肺血管收缩和后期肺血管重建有关。缺氧时,低氧诱导因子-1α(HIF-1α)可激活下游靶基因从而调节一系列细胞因子和生长介质的基因表达及蛋白合成,在血管反应性、血管重构以及细胞增殖等过程中发挥着重要作用。17β-雌二醇(E2)的生物活性在体内三种天然雌激素中最强,被认为起主要生理作用。近年来,雌激素对肺血管保护作用的研究日益增多,既能减轻内皮细胞和平滑肌细胞的功能损伤,又能舒张血管、改善肺血管重构,但具体机制尚未完全明了。本实验建立去势大鼠低氧性肺动脉高压模型,探讨E2及2甲氧基雌二醇(2ME)对低氧性肺动脉高压大鼠模型中烷烃单加氧酶(AlkB)和HIF-1α的影响。
1 材料与方法
实验动物及分组:6~7周雌性SD大鼠60只(河北医科大学实验动物中心提供,许可证编号:1312033),体重(190±10)g。行去势手术并适应性饲养1周后采用随机数字法将大鼠随机分为6组:常氧组(n=10)、常氧+E2组(n=10)、常氧+2ME组(n=10)、低氧组(n=10)、低氧+E2组(n=10)、低氧+2ME组(n=10)。
主要仪器及材料:常压低氧环境动物实验箱(长沙长锦科技有限公司);RM3000四导联生理记录仪(日本光电公司);光学显微镜及照相系统(日本Olympus公司);756MC型紫外-可见分光光度计(上海精密科学仪器有限公司);2ME(湖北康宝泰精细化工公司);碘[125I]-雌二醇放射免疫分析药盒(深圳拉尔文生物工程技术有限公司);PE-9600基因扩增仪(美国PE公司);BioID数码成像分析系统(法国VilberLourmat公司);Powlab测压软件(美国匹兹堡AD器械有限公司);引物由上海生物工程技术公司合成;大鼠抗HIF-1α单克隆抗体、大鼠抗alkB单克隆抗体、辣根过氧化物酶标记的二抗(美国Santa Cruz公司)。
模型建立:低氧组、低氧+E2组、低氧+2ME组大鼠放入低氧箱中饲养,调整低氧箱参数,保持舱内氧浓度为(10.0±0.5)%,每天持续低氧24 h,连续8周。常氧组、常氧+E2组、常氧+2ME组大鼠置于同一室内饲养。常氧+2ME组、低氧+2ME组自造模之日起,每日皮下注射2ME(240 μg /kg)。常氧+E2组、低氧+E2组每日皮下注E2(20 μg/kg)。常氧组、低氧组则每日皮下注射等量的生理盐水。
肺动脉压力测定:大鼠经腹腔内麻醉后,右颈纵形切口,分离出右侧颈外静脉,结扎远心端后,作静脉“V”形切口,经右颈外静脉插入微导管,通过压力传感器连接四导生理记录仪RM-3000连续测压,观察压力波形变化来判断导管头端位置,待至肺动脉干后稳定10 min,随后记录压力波形,计算大鼠平均肺动脉压(mPAP)。
标本的留取:压力测量结束后抽取大鼠颈静脉血4 ml分别置于若干2 ml消毒EP管中,以1006.2 g离心,离心后用移液器将上清液移至2 ml消毒EP管中,放入-70℃冰箱冷冻保存。将胸腔打开取出全肺,以生理盐水冲洗肺外表并放入洁净玻璃皿内,
取左肺上叶制成石蜡标本观察肺动脉形态,余肺叶待测HIF-1α、AlkB。
右心室肥厚指数(RVHI)的测定:经以上检测后将大鼠放血处死,取出心脏置于10%中性甲醛固定48 h,沿房室沟切除心房和大血管根部,再沿至后室间沟将右心室游离壁分离,吸干水分后用电子天平分别称取右心室和左心室+室间隔的重量,计算RVHI来反映右心室肥厚程度的变化。
大鼠肺小动脉形态学分析:将肺组织石蜡切片进行苏木素-伊红(HE)染色和弹性纤维染色,显微镜下观察肺动脉大体形态变化。
应用反转录聚合酶链反应(RT-PCR)测定肺组织中HIF-1α及AlkB mRNA水平:取100 mg肺组织置入匀浆器内,按Trizol法提取组织总RNA 2 μg,加入RT反应体系(含AMV Buffer、dNTPs、OligodT Primer、AMV、Rnase Inhibitor等)管中,并用焦碳酸二乙酯处理水补足至50 μl反应液体积,震荡混匀后短暂离心,加少许矿物油于PCR仪42℃ 30 min(cDNA合成),99℃ 5 min(逆转录酶失活),5℃5 min。-20℃情况下保存备用。PCR扩增引物经PAGE纯化。Rat AlkB的序列:上游引物 5'-GATGAAGCTCCCACAGCCAT-3'。下游引物 5'-ACAGAACAGGGCTCAAGCAA-3' 扩增片段为 188 bp。Rat HIF-1α的序列:上游引物 5'- CTCAGAGGAAGCGAAAAATGG -3'。下游引物 5'-AAT TCT TCA CCCTGCAGTAGG -3' 扩增片段为 307bp。Rat GAPDH 的序列:上游引物5'- CCTTCATTGACCTCAACTAC -3 '。下游引物5'- GGAAGGCCATGCCAGTGAGC -3 ' 扩增片段为594bp。PCR扩增条件:94℃变性3 min;(94℃ 40 s,各自的退火温度 50 s,72℃ 90 s)× 30个循环;72℃延伸10 min。PCR产物在1%的含GV核酸染料的琼脂糖凝胶电泳中加入的每个标本扩增产物,量为6 μl,以DNA Marker(DL2000)作为标准片段标记,电泳后在紫外透射仪下观察,并且用数码相机照相,输入微机中后应用Quantity One凝胶图象分析软件对目的电泳条带进行分析,把内参电泳条带作为参照,结果以两者之间的吸光度比值表示。
免疫蛋白印迹法(Western blot )检测肺组织中AlkB、HIF-1α 蛋白质的表达:取大鼠左侧肺组织于 4℃用磷酸盐缓冲液(PBS,10 mmol/L Na2HPO4,2 mmol/L KH2PO4,pH 7.4,137 mmol/L NaCl,2.7 mmol/L KCl)充分洗涤,加 5 倍体积用冰预冷的悬浮缓冲液,迅速剪碎组织,冰浴中匀浆,加入等体积的 2×SDS 凝胶加样缓冲液,再将样品置于沸水浴中加热 10 min,将上清液移于另一管中为待测样品。采用改良酚试剂法(Lowry 法)进行蛋白定量,用于免疫蛋白印迹法分析。用8%SDS-聚丙烯酰胺凝胶电泳分离蛋白,电转移至聚偏氟乙烯(PVDF)膜上。随即与一抗及二抗结合于室温反应 2.5~3 h。用 TTBS液(20 mmol/L Tris-HCl,pH 8.0,150 mmol/L NaCl)洗膜3次,每次10 min,然后用 TBS液(10 mmol/L Tris-HCl,pH 8.0,150 mmol/L NaCl)洗膜 1 次,约5 min。用化学发光法检测膜上的抗原抗体结合区带。采用VilberLourmat公司 ID 数码成像分析软件对免疫蛋白印迹显色区带的信号强度进行相对定量分析,扫描灰度值用积分光密度值(IOD)表示。
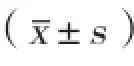
2 结果
2.1 大鼠平均肺动脉压和右心室肥厚指数的改变(表1)
与常氧情况下大鼠比较,低氧情况下的三组大鼠mPAP明显升高,符合肺动脉高压的压力水平;其中低氧组大鼠的mPAP较低氧+2ME组和低氧+E2组均明显升高,差异有统计学意义(P<0.05);而低氧+2ME组与低氧+E2组比大鼠mPAP差异无统计学意义(P>0.05)。
表1 6组大鼠体重、平均肺动脉压和右心室肥厚指数的比较

表1 6组大鼠体重、平均肺动脉压和右心室肥厚指数的比较
注:E2:雌激素; 2ME: 2甲氧基雌二醇。1 mmHg=0.133 kPa。与常氧组比aP<0. 05bP<0.01;与低氧组比cP<0. 05dP<0.01;与常氧+E2组比eP<0.05;与常氧+2ME组比fP< 0. 05
?
2.2 大鼠肺小血管及右心室形态学变化(图1)
光镜下,常氧组、常氧+E2组、常氧+2ME组大鼠肺动脉血管内皮细胞扁平连续,细胞分布均匀,大小厚薄一致,无细胞水肿或坏死,肺动脉管壁结构正常;而低氧组、低氧+E2组、低氧+2ME组大
鼠肺内血管壁明显增厚,肺细小动脉中膜平滑肌细胞增多,中膜增厚,管腔变窄;低氧+E2组及低氧+2ME组肺动脉管壁结构介于常氧组和低氧组之间。各组右心室肥厚指数的变化趋势同mPAP变化。

图1 6组大鼠肺组织形态和病理变化(×100)
2.3 大鼠肺组织中HIF-1αmRNA及AlkBmRNA表达水平变化(图2、表2)
低氧组大鼠HIF-1αmRNA表达水平显著高于常氧组,低氧+E2组、低氧+2ME组亦升高,升高幅度不及低氧组,常氧+E2组、常氧+2ME组无明显变化。AlkBmRNA表达水平在低氧组显著低于常氧组,低氧+E2组、低氧+2ME组亦降低,降低幅度不及低氧组,常氧+E2组、常氧+2ME组无明显变化。
表2 6组大鼠肺组织中HIF-1αmRNA和AlkBmRNA表达水平

表2 6组大鼠肺组织中HIF-1αmRNA和AlkBmRNA表达水平
注:AlkB:烷烃单加氧酶;HIF-1α:低氧诱导因子-1α。与低氧组比aP<0. 05bP<0.01;与低氧+E2组比cP<0.05dP<0.01;与低氧+2ME组比eP<0. 05fP<0.01。余注见表1
?
2.4 大鼠肺组织中HIF-1α及AlkB蛋白表达水平的变化(图3、表3)
低氧组HIF-1α蛋白表达水平显著高于常氧组,低氧+E2组、低氧+2ME组亦较常氧组升高,但升高幅度不及低氧组,常氧+E2组、常氧+2ME组与常氧组比较无明显变化。低氧组AlkB蛋白表达水平显著低于常氧组,低氧+E2组、低氧+2ME组较常氧组亦降低,降低幅度不及低氧组,常氧+E2组、常氧+2ME组与常氧组比较无明显变化。
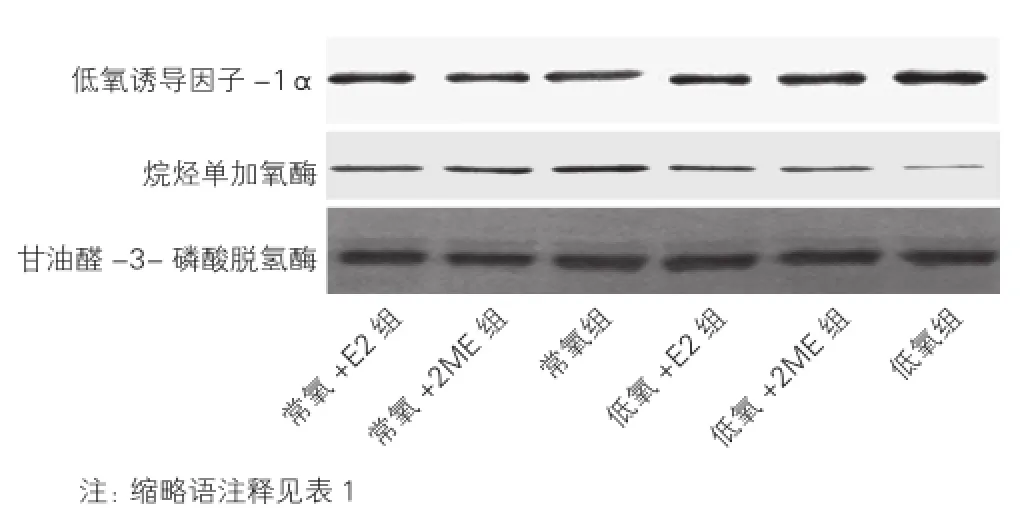
图3 6组大鼠肺组织中低氧诱导因子-1α蛋白和烷烃单加氧酶蛋白的免疫印迹图
表3 6组大鼠肺组织中低氧诱导因子-1α蛋白和烷烃单加氧酶蛋白表达水平

表3 6组大鼠肺组织中低氧诱导因子-1α蛋白和烷烃单加氧酶蛋白表达水平
注:与低氧组比aP< 0.05bP<0.01;与低氧+E2组比cP<0.05dP<0.01;与低氧+2ME组比eP<0.05fP<0.01。余注见表1
?
3 讨论
肺动脉高压的主要病理变化为肺动脉收缩反应增强及以平滑肌细胞增生为主要特征的肺血管结构
重建[1]。缺氧性肺动脉高压的形成主要与低氧性肺血管收缩和肺血管重构相关。HIF-1α是一种随胞内氧浓度变化而调节基因表达的转录激活因子,其活化后,能激活如血管内皮生长因子等40种调控代谢、细胞迁移和血管生成的蛋白信号。常氧时HIF-1α蛋白的氧依赖性降解功能区调节HIF-1α与希佩尔—林道病肿瘤抑制蛋白作用,后者能识别泛素化连接酶E3导致HIF-1α发生泛素化降解[2]。缺氧时HIF-1α不能被希佩尔—林道病肿瘤抑制蛋白识别从而无法被泛素化降解,其表达量在细胞内呈指数式增加[3]。
本研究显示在去势和低氧并存条件下,无论右心室及肺血管形态学还是mPAP等均变化较大,且肺组织中HIF-1α的表达呈明显升高趋势;推测缺氧是肺动脉高压发展的始动因素,而雌激素的缺失加剧低氧所致肺动脉高压。给予E2及2ME干预后右心室及肺动脉管壁结构发生逆转,肺组织中HIF-1αmRNA表达水平明显低于低氧组。Miyamoto等[4]研究发现,E2在低氧时呈剂量、时间依赖性降低肺组织中HIF-1α的表达。研究认为雌激素对HIF-1α的影响可通过其受体介导和下游代谢产物2ME来发挥作用,E2通过与受体结合具有促进细胞外信号调节蛋白激酶和p38丝裂原活化蛋白激酶磷酸化、下调细胞周期素依赖性蛋白激酶抑制蛋白、刺激内皮细胞迁移及增殖及抑制内皮细胞凋亡等作用[5-8]。此外,植物雌激素对氧感受信号具有调制作用,通过作用与细胞内自由基,影响细胞内各种信号传导途径从而下调HIF-1α的表达[9]。
2ME由雌二醇2位碳原子先羟化再甲基化形成;对雌激素受体的亲和力较低[10]。有学者采用在低氧下培养HEK293细胞,发现经2ME处理后可显著降低HIF-1α的转录活性,推测其抑制HIF-1α的功能是通过促进HIF-1α蛋白降解[11]。也有观点认为经2ME作用后,HIF水平降低是由于HIF-1α合成受抑制[12],研究者们普遍认为2ME是不通过雌激素受体而独立发挥对HIF-1α的拮抗作用。外源性雌激素进入机体后约80%经17β脱氢酶氧化为雌酮或硫酸雌酮,仅约20%可能转化为雌三醇、2ME等。缺氧以及氧化应激又进一步下调2-羟基化通路关键酶2-CYP1A1/2的表达,导致E2转化为2ME减少。故缺氧时2ME所发挥的抑制HIF-1α作用将被减弱。本研究中未观察到上述现象,推测2ME对HIF-1α的抑制作用不存在类似E2的时间、剂量依赖性,这进一步提示二者的作用机制不同。达到一定浓度后,2ME对HIF-1α的抑制作用将与浓度无关。
缺氧时胞浆内HIF-1α发生核移位与核内HIF-1β 结合,调控相关基因的转录。本研究观察到大鼠肺组织中ALKBmRNA及蛋白水平与HIF-1α的增加存在着一定的关系。AlkB为单核非血红素Fe2+和α-酮戊二酸依赖的双加氧酶超家族成员,通过激活双氧分子催化氧化与稳定杂环上氮原子相接触的甲基团,使之构象发生改变,从而以释放甲醛的形式移除甲基团。低氧使AlkB表达下调,致其修复DNA和RNA异常甲基化的能力有所下降从而导致HIF-1α的活性增加[13]。E2、2ME干预作用是否通过HIF-1α为介质来发挥对AlkB的影响尚需进一步研究证实。
[1] 朱锋, 董琳, 熊长明. 解读2009欧洲心脏病学会肺动脉高压诊断和治疗指南解析肺动脉高压新分类. 中国循环杂志, 2010, 25: 657.
[2] Park J. STAT3 inhibits the degradation of HIF-1 α by pVHL-mediated ubiquitination. Exp Mol Med, 2008, 40: 479-485.
[3] Lakham NJ, Sarkar MA, Venitz J, et al. 2-methoxyestradiol, a promising anticancer drug. Pharmacotherapy, 2003, 23: 165-172.
[4] Miyamoto N, Mandai M, Takagi H, et al. Contrasting effect of estrogen on VEGF induction under different oxygen status and it s role in murine ROP. Ophthalmol Vis Sci, 2002, 43: 2007-2014.
[5] Lippert C, Seeger H, Mueck AO, et al. The effects of A-ring and D-ring metabolites of estradiol on the proliferation of vascular endothelial cells. Life Sci, 2000, 67: 1653-1658.
[6] Dupont J, Karas M, LeRoith D. The potentiation of estrogen of insulinlike growth factor I action in MCF-7 human cancer cells includes cell cycle components. J Bio Chem, 2000, 275: 35893-35900.
[7] Suzuma I, Mandai M, Takagi H, et al. 17-Estradiol increases VEGF receptor-2 and promotes DNA synthesis in retinal microvascular endothelial cells. Invest Opthalmol Vis Sci, 1999, 40: 2122-2129.
[8] Geraldes P, Sirois MG, Bernatchez PN, et al. Estrogen regulation of endothelial and smooth muscle cell migration and proliferationw. Role of p38 and p42/44 mitogen-activate protein kinase. Arterioscler Thromb Vasc Biol, 2002, 22: 1585-1590.
[9] Alsharnoubi JM, Odland HH, Saugstad OD. Nicotine does not influence NF-κB activity in neonatal mice reoxygenated with room-air or 100% oxygen. J Matern Fetal Neonatal Med, 2012, 25: 2102-2105.
[10] 郑泉, 邓华君, 袁雅冬. 雌激素及其代谢产物与肺动脉高压的相关性研究. 中国循环杂志, 2015, 30: 184-186.
[11] Gestl SA, Green MD, Shearer DA, et al. Expression of UGT2B7, a UDP-Glucuronosyltransferase Implicated in the Metabolism of 4-Hydroxyestrone and All-Trans Retinoic Acid, in Normal Human Breast Parenchyma and in Invasive and in Situ Breast Cancers.Am J Pathol, 2002, 4: 1467-1479.
[12] Mabjeesh NJ. 2ME2 inhibits tumor growth and angiogenesis by disrupting microtubules and dysregulating HIF. Cancer Cell, 2003, 3: 363-375.
[13] 邓华君, 袁雅冬. 烷烃单加氧酶和低氧诱导因子-1α在大鼠低氧性肺动脉高压模型肺组织中的表达及其意义. 中华医学杂志, 2013, 93: 3226-3231.
Effect of Estradiol and its Metabolite on Hypoxic Induced Factor-1αand Alkane Hydroxylase in Experimental Rats With Ovariectomy and Hypoxic Pulmonary Hypertension
ZHENG Quan, YUAN Ya-dong, ZHAO Jing.
Department of Respiratory and Critical Care Medicine, The Second Hospital, Hebei Medical University, Shijiazhuang (050000), Hebei, China
Objective: To explore the effects of 17 β-estrogen (E2) and 2-methoxyestradiol (2ME) on hypoxic induced factor-1α (HIF-1α) and alkane hydroxylase (AlkB) in experimental rats with ovariectomy and hypoxic pulmonary hypertension.
Pulmonary hypertension; Anoxia; 17 β-estrogen; 2-methoxyestradiol; Hypoxia induced factor-1
2015-01-28)
(编辑:许 菁)
河北省自然科学基金(H2013206403)
050000 河北省石家庄市,河北医科大学第二医院 呼吸与危重症医学科
郑泉 主治医师 硕士 主要从事肺血管病研究 Email:xk9032@163.com*现就职于武汉市第三医院呼吸内科 通讯作者:袁雅冬
Email:yyd1108@126.com
R54
A
1000-3614(2015)09-0884-05
10.3969/j.issn.1000-3614.2015.09.015

