水貂阿留申病毒环介导等温扩增(LAMP)检测方法的建立
田国宁,张金玲,李 凯,田国华,丁葵英
(潍坊出入境检验检疫局,山东潍坊 261041)
水貂阿留申病毒环介导等温扩增(LAMP)检测方法的建立
田国宁,张金玲,李 凯,田国华,丁葵英
(潍坊出入境检验检疫局,山东潍坊 261041)
为建立一种简便、快速、特异的水貂阿留申病毒(ADV)检测方法,根据GenBank中已登录的ADV基因组序列,选择水貂阿留申病毒VP2基因作为靶基因,设计并合成5套环介导等温扩增(LAMP)反应所需的引物,通过试验筛选出最佳引物,并进行最佳引物的特异性及敏感性试验,建立了LAMP快速检测方法。试验结果表明,该方法比普通PCR方法灵敏性高10倍,与其他的水貂源病毒不发生非特异性反应,并且具有良好的重复性。利用建立的LAMP检测方法对30份临床样品的阳性检出率为6.7%。该方法简便快速,为水貂阿留申病的检测提供了新的发展方向,有望成为简易的常规检测手段,尤其适用于基层应用。
水貂;阿留申病毒;环介导等温扩增(LAMP);检测;VP2基因
水貂阿留申病(Aleutian disease of mink,AD)又称浆细胞增多症(Plasmacytosis)[1]。是由水貂阿留申病病毒(Aleutian mink disease virus,ADV)侵害水貂引起的一种慢性进行性传染病,以水貂繁殖能力下降、貂体消瘦、自身免疫病、高免疫球蛋白血症、对细菌的易感性增加、肾衰竭死亡为基本特点[2],一直是危害世界养貂业健康发展的重要疫病之一。该病几乎存在于所有养貂的国家和地区,呈世界性分布的特点[1]。
目前,实验室检测ADV的方法主要有病毒分离[1]、血清学诊断[3]、聚合酶链式反应(PCR)[4]、荧光定量PCR[5]、基因检测芯片[6]等,这些方法耗时较长,操作较为复杂,且需要特殊的仪器设备。环介导等温扩增(LAMP)技术是由日本学者Notomi等[7]开发的一种恒温核酸扩增方法,其特点是针对靶基因的6个区域设计4条特异引物,在恒温条件下利用一种链置换DNA聚合酶,几十分钟即可完成核酸扩增反应,具有快速、简便等特点,有着广泛的应用前景[7-9]。本研究参考GenBank中已发表的ADV基因组序列,选择水貂阿留申病毒
VP2基因作为靶基因,根据LAMP 引物设计软件,设计并合成5套LAMP反应所需的引物,通过试验筛选出最佳引物,并进行最佳引物的特异性及敏感性试验。
1 材料与方法
1.1 样品与标准品
水貂阿留申病毒、犬瘟热病毒、细小病毒由中国农业科学院特产研究所提供;人基因组、鼠基因组由北京蓝谱生物科技有限公司提供。
阳性质粒标准品的制备:根据水貂阿留申病毒VP2基因序列,由大连宝生物公司纯人工合成质粒,基因全长528bp。
1.2 仪器
实时浊度仪:日本荣研LA-320c;核酸蛋白分析仪:Beckman DU800;PCR仪 ATC401,凝胶成像仪:法国VILBER 3026。
1.3 试剂
环介导等温扩增法FDR荧光检测试剂盒:北京蓝谱生物科技有限公司;病毒DNA提取纯化 试 剂 盒:Promega;2xTaq PCR Master mix:TIANGEN;引物合成:大连宝生物工程有限公司。
1.4 方法
1.4.1 DNA 模板的制备。利用病毒DNA提取纯化试剂盒说明书进行制备。
1.4.2 LAMP 反应引物的设计。选择水貂阿留申病毒VP2基因作为靶基因,根据LAMP引物设计软件网址:http://primerexplorer.jp/e/,将待扩增的DNA 分为六个独立的区域,根据这六个区域分别设计LAMP 反应所需的引物(内引物FIP 和BIP、外引物F3 和B3、环引物LB、LF),共设计5套LAMP引物扩增VP2基因。
1.4.3 LAMP 反应。根据环介导等温扩增法FDR荧光检测试剂盒配制26μL 反应混合物,将混合物置于65℃恒温反应60min。以双蒸水为阴性对照。
1.4.4 LAMP 反应结果检测
1.4.4.1 浊度法检测 采用实时浊度仪检测,每隔6秒测定反应管的浊度并绘制成曲线来判断反应的阴阳性。
1.4.4.2 显色法检测 基于钙黄绿素颜色改变检测,阴性时为橙色,阳性时为绿色。
1.4.5 LAMP 方法敏感性实验。为验证LAMP方法的检测灵敏度,以含VP2片段的质粒为检测对象,定量后将总DNA按10倍稀释度稀释,使得最终拷贝数为105拷贝/μL、104拷贝/μL、103拷贝/μL、102拷贝/μL、101拷贝/μL、100拷贝/μL,并以双蒸水作为阴性对照。然后进行LAMP反应,分别采用浊度法和显色法来检测结果。
2 结果与分析
2.1 最佳引物的筛选
以本研究设计的5套引物对含VP2片段的质粒(质粒浓度108拷贝/μL)进行LAMP扩增,最先发生LAMP反应的引物组合为最佳引物,从图1中看出ADV21、ADV8、ADV55、ADV46、ADV37引物组开始发生LAMP反应的时间是分别是第16min、22min、24min、29min、40min,故将ADV21引物组选为最佳引物。
ADV21引物组:
ADV21-F3:GATAGACAATGTAACCATAAAGACT
ADV21-B3:TTGGTTTGGTTGCTCTCC
ADV21-FIP:CGACGCAGTTAAGTCATTGTTGATTTT GTAACAGAAACCAACCAAGGTA
ADV21-BIP:TACAGGTTGCTTTAGACACTAACAAT TTTAAGGAACAAAGCCCAGTG
ADV21-LB:CATATACTCCAGCTGCGCCGTT

图1 最佳引物筛选实验结果
2.2 最佳引物的特异性实验
阴性对照以水作为模板,阳性对照用含VP2
的质粒作为模板,并用人基因组、鼠基因组、细小病毒、犬瘟热病毒作为对照以检测特异性。当反应体系中存在VP2基因时,便发生LAMP 扩增反应,产生大量的白色沉淀,反应液的浊度表现为曲线上升,从图2中可以看出只有阳性对照的曲线发生了上升,其他曲线均没有变化,表明设计的引物具有良好的特异性。采用钙黄绿素染色来观察结果,与浊度法一致(图3)。

图2 最佳引物的特异性浊度法实验结果
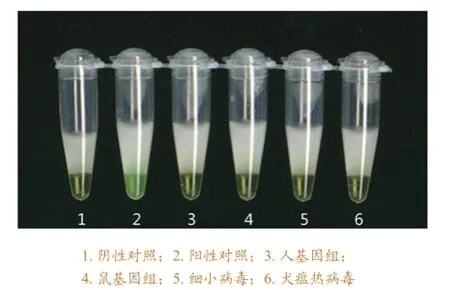
图3 最佳引物的特异性染色法实验结果
2.3 最佳引物的敏感性试验与PCR方法的比较及LAMP最佳反应时间的确定
2.3.1 最佳引物的敏感性试验与PCR方法的比较。将10倍梯度稀释的含VP2基因的质粒模板(105拷贝/μL、104拷贝/μL、103拷贝/μL、102拷贝/ μL、101拷贝/μL、100拷贝/μL)用于LAMP 反应和PCR反应。LAMP 反应检测结果见图4,显色法与浊度法实验结果一致,LAMP最低检测浓度为101拷贝/μL(见图5)。PCR反应引物为ADV21-F3,ADV21-B3,凝胶电泳检测结果见图6。可以看出,PCR最低检测浓度为102拷贝/μL。
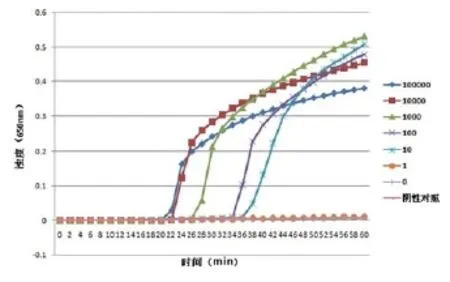
图4 最佳引物检测的敏感性浊度法实验结果
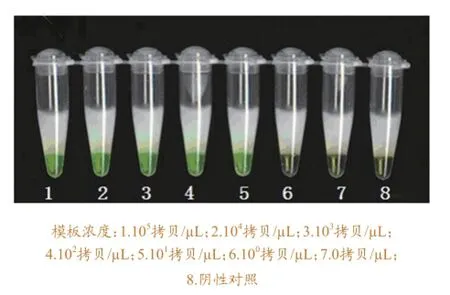
图5 最佳引物检测的敏感性染色法实验结果
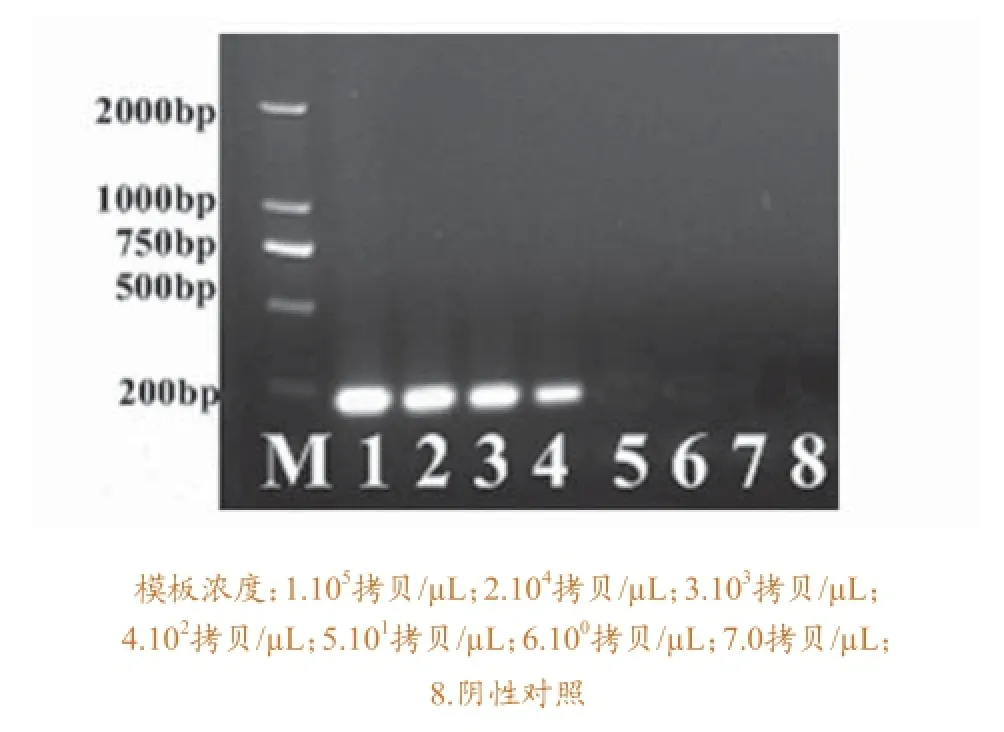
图6 PCR敏感性的实验结果
2.3.2 LAMP最佳反应时间的确定。LAMP反应时间定为能检测到质粒103拷贝/μL的时间为最佳,但是不能过分追求其敏感性以防止假阳性的出现,故结合本实验最佳引物的敏感性,将LAMP反应时间定为50分钟。
3 采集水貂样品用LAMP方法检测ADV
到本辖区水貂养殖场采集水貂病料(粪便、尿液、血清、脾脏、肠系膜淋巴结),共采集样本30份。经LAMP浊度法和显色法检测,30份样本中检出了2份阳性样本,试验结果见图7、图8。从图中可以看出,样品8号和19号为阳性样本。

图7 浊度法检测结果

图8 显色法检测结果
4 讨论与结论
本研究探索建立了水貂阿留申病毒VP2基因LAMP的诊断方法。经验证,本方法具有良好的稳定性,从结果中可以看到,与常规PCR方法比较,当样品模板稀释至10拷贝/μL时PCR反应已经很难得到明确的结果,而LAMP反应结果稀释到10拷贝/μL依然能够清晰地通过肉眼判断(图5),由此可见LAMP具有较高的灵敏度。通过肉眼判断LAMP结果十分困难,要求更精确的结果可用浊度仪进行检测,而采用显色法,我们可轻松准确地判读至10拷贝/μL稀释样品,检测过程无须额外设备,同时也省去了常规PCR方法需要电泳分析的操作,大大降低了技术的使用成本,易于普及推广。
综上所述,本研究建立的水貂阿留申病LAMP检测方法具有特异性强、灵敏度高、方便快捷、成本低等特点,为水貂阿留申病的检测提供了新的发展方向,有望成为简易的常规检测手段,尤其适合在基层推广、应用。通过进一步的优化和完善,该技术方法可在ADV的诊断及防控方面发挥作用,为水貂阿留申病的诊断与防控提供技术支持。
[1] 白文彬,于康震.动物传染病诊断学[M].北京:中国农业出版社,2002:901-903.
[2] Porter D D,Larsen A E,PorterH G.Aleutian disease of mink [J].Adv Immun01.1980,29:261-286.
[3] 薛强,郭绍聪.水貂阿留申病的检测技术及应用效果[J].当代畜牧,2006,(12):40-41.
[4] 马建,王玉龙,曾祥伟,等.ADV感染阳性母貂产仔情况及幼仔分窝时ADV的感染率[J].东北林业大学学报,2005,33(6):62-63,99.
[5]张秀丽,于慧娟,徐超,等.水貂阿留申病毒荧光定量PCR检测方法的建立及初步应用[J].中国畜牧兽医,2014,41(9):1-5.
[6] 朱善元,王健.水貂阿留申病基因检测芯片的研究与初步应用[J].中国预防兽医学报,2006,28(6):688-691.
[7]Notomi T,Okayama H,Masubuchi H,et al.Loop-me-diated isothermal amplification of DNA[J].Nucleids Acids Res,2000,28(12):63.
[8]匡燕云,李思光,罗玉萍.环介导等温扩增核酸技术及其应用[J].微生物学通报,2007,34(3):557-560.
[9]Mori Y,Nagamine K,Tomita N,et al.Detection of Loop-Mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate for-mation[J].Biochem Biophs Res Commun,2001,289:150-154.
Development of Loop-Mediated Isothermal Amplifi cation(LAMP)Assay for Detection of Aleutian Disease Virus(ADV)
Tian Guoning,Zhang Jinling,Li Kai,Tian Guohua,Ding Kuiying
(Weifang Entry-Exit Inspection and Quarantine Bureau,Weifang,Shandong,261041)
The aim of the study was to develop a simple,rapid and specific assay for ADV detection. Based on the genomic sequence data of ADV in GenBank,five primers were designed and synthesized with VP2 as target gene. By comparing specificity and sensitivity of the primers,a LAMP assay was developed,which was proved to be 10 times more sensitive than normal PCR method and had no reaction with other mink viruses. The developed LAMP assay was used to test 30 suspected mink samples resulting in a positive rate of 6.7%. The assay was simple,rapid,reproducible and may be considered as a routine method used in grass-roots labs.
mink;ADV;LAMP;detection;VP2 gene
S855.3
A
1005-944X(2015)06-0079-04

