实时荧光定量PCR检测克氏原螯虾体内白斑症病毒(WSSV)的动态变化
张 玲,唐小千,绳秀珍,战文斌
(中国海洋大学海水养殖教育部重点实验室,山东青岛 266003)
实时荧光定量PCR检测克氏原螯虾体内白斑症病毒(WSSV)的动态变化
张 玲,唐小千,绳秀珍,战文斌
(中国海洋大学海水养殖教育部重点实验室,山东青岛 266003)
本文建立了白斑症病毒(WSSV)实时荧光定量PCR标准曲线,结果显示其线性关系良好,利用建立的WSSV实时荧光定量PCR技术检测感染了WSSV后克氏原螯虾(Procambarus clarkii)组织内病毒数量的时序动态变化。注射WSSV粗提液感染克氏原螯虾,在感染后0h、3h、6h、12h、24h、36h、48h、60h和72h分别取螯虾鳃、血淋巴、心脏、附肢、造血组织和肌肉,提取组织DNA,实时荧光定量PCR测定WSSV浓度,发现感染后3h在附肢、鳃、血淋巴和造血组织中检测到病毒,12h时在各组织中皆检测到病毒,但浓度较低;24~48h内WSSV浓度呈指数增长,此时螯虾出现少量死亡;60~72h内WSSV数量缓慢增长达到平台期,螯虾累计死亡率快速升高。不同组织中的WSSV浓度有较大差异,附肢中浓度最高,血淋巴、鳃、心脏和造血组织稍低,肌肉中WSSV浓度最低;附肢中WSSV动态变化代表了WSSV增殖变化规律,是很好的病毒检测与病程进展评估材料。本文结果可为WSSV的早期诊断提供技术支持,为阐明WSSV感染增殖规律提供资料。
克氏原螯虾(Procambarus clarkii);白斑症病毒(WSSV);实时荧光定量PCR;病毒增殖
在养殖虾类的病毒性病原中,白斑症病毒(WSSV)是给虾类养殖业带来损失最大的一种病毒[1-2]。自白斑症病毒病在20世纪90年代初期首次大规模暴发以来,全世界有超过30个国家的对虾养殖业受其影响,造成巨大经济损失。WSSV的宿主范围非常广泛,可以感染对虾、龙虾、螯虾、蟹类、桡足类等40余种甲壳类动物和水生浮游动物[3-4],其感染的靶器官主要包括上皮组织、造血组织、结缔组织、鳃、胃、血淋巴、附肢、触角腺、前后肠上皮、横纹肌、心脏等部位。目前,WSSV感染和致病机理尚不明晰,且缺乏有效的治疗措施。尽早发现病毒并采取相应措施阻止病毒传播,综合调控以预防疾病发生是相对有效的防病策略是防控该病的有效策略[4]。
有学者将WSSV在虾体内的感染分为轻、中、重度感染阶段,发现在WSSV轻度感染阶段可以通过调整饲养和环境条件使虾存活下来,达到中或重度感染阶段后,则可能会在几天时间内出现大量死亡[5]。所以,有效的管理要求我们在WSSV轻度感染阶段向中、重度感染阶段过渡之前检测到病毒,从而为养殖企业提供时间,改善养殖条件避免疾病暴发或及时收获,以降低经济损失。因此,建立灵敏、准确的WSSV检测技术,分析虾组织中WSSV的感染增殖动态变化,可以为评估WSSV感染进程,预防WSSV病的发生提供资料。
实时荧光定量PCR检测方法具有灵敏性和特异性高等优点,已广泛应用于多种病原的诊断[6-7]。本文选择WSSV的易感宿主克氏原螯虾(Procambarus clarkii)作为模式动物,利用建立的WSSV实时荧光定量PCR技术检测感染WSSV后不同时间点螯虾组织中的病毒数量动态变化,以期为WSSV的早期诊断提供技术支持,为阐明WSSV感染增殖规律提供基础资料。
1 材料与方法
1.1 实验动物和病毒
克氏原螯虾购自山东省某养殖场,利用PCR技术检测虾鳃确认没有感染WSSV[8]。将螯虾暂养于实验室,每天换水一次,一周后用于感染实验。取患白斑病的中国对虾鳃,每1g鳃中加入5mL磷酸缓冲液(PBS),冰浴充分研磨3~5min,将研磨液过滤到50mL离心管内,4℃下经3000 r/min离心20min,取上清液作为WSSV粗提液,使用实时荧光定量PCR技术测定WSSV粗提液病毒浓度并使用PBS将其浓度调节为8拷贝/μL用作接种液。
1.2 感染实验
将健康克氏原螯虾分为2个实验组和2个对照组,每组300只螯虾,暂养一周后将水温逐渐升至25℃。2个实验组每只螯虾肌肉注射约100μL 浓度为8拷贝/μL WSSV接种液[9],2个对照组每只螯虾肌肉注射100μL PBS溶液。实验组1和对照组1分别于感染后0、3、6、12、24、36、48、60、72h随机取5只活虾,同时对濒临死亡或刚刚死亡的螯虾进行取样,采集鳃、血淋巴、心脏、肌肉、附肢和造血组织,其中血淋巴按1∶1(V/V)加入抗凝剂,立即置-80℃保存。另外,统计各个时间点实验组2和对照组2螯虾的累积死亡数,计算累计死亡率。
1.3 实时荧光定量PCR标准曲线的建立
将WSSV囊膜蛋白VP28编码DNA使用引物VP28F/VP28R(表1)进行PCR扩增,目的片段进行回收纯化,然后将目的片段插入pMD19-T质粒,将重组质粒转化至大肠杆菌DH5α进行大量扩增,使用PCR技术检测阳性菌落,将阳性菌送上海生工生物工程技术服务有限公司进行测序。
将含质粒的大肠杆菌菌株DH5α按1μL/mL的比例接种于含抗生素LB液体培养基中,37℃振荡培养过夜,以质粒小量试剂盒抽提质粒,使用仪器NanoDrop8000测定质粒核酸浓度并换算为质粒拷贝数。将获得的质粒10倍系列梯度稀释,共8个梯度,作为模板进行实时荧光定量PCR,绘制WSSV实时荧光定量PCR标准曲线,并查看扩
增曲线和溶解曲线,反应体系包括引物QVP28F/ QVP28R(表1)各1μL,蒸馏水5μL,模板3μL,SYBR Green 10μL。反应条件为95℃预变性5min;95℃变性10s,51℃退火10s,72℃延伸20s,共45个循环。熔解曲线分析(使用Roche480默认程序):95℃ 5s,65℃ 1min,温度由65℃上升到97℃,此过程不断收集荧光信号,形成熔解曲线。
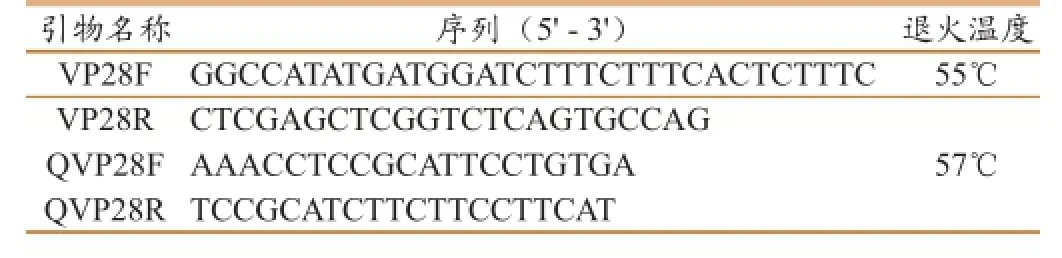
表1 实验所用引物
1.4 螯虾组织中WSSV数量检测
利用Tiangen海洋动物组织基因组DNA提取试剂盒,提取不同时间点螯虾各组织DNA,使用仪器NanoDrop8000测定提取各组织DNA的核酸浓度,使用实时荧光定量PCR技术,检测鳃、血淋巴、心脏、肌肉、附肢、造血组织中WSSV拷贝数,反应体系包括引物QVP28F/ QVP28R(表1)各1μL,蒸馏水5μL,模板3μL,SYBR Green 10μL。反应条件为95℃预变性5min;95℃变性10s,51℃退火10s,72℃延伸20 s,共45个循环。熔解曲线分析(Roche480默认程序):95℃ 5s,65 ℃ 1min,温度由65 ℃上升到97 ℃,此过程不断收集荧光信号,形成熔解曲线。
2 结果
2.1 实时荧光定量PCR标准曲线
将WSSV囊膜蛋白VP28基因目的片段进行琼脂糖凝胶电泳鉴定,大小约为627bp左右,与预期大小一致,浓度较高(图1A)。通过链接至pMD-19-T载体,然后转化至大肠杆菌感受态细胞DH5α,PCR阳性菌落检测电泳,获得了与目标片段大小一致的条带,浓度较高,表明重组质粒成功转化入大肠杆菌体内,在大肠杆菌体内大量复制。PCR鉴定为阳性的菌落经测序,登陆NCBI,将测序结果用BLAST软件进行比对,吻合率为100%,表明该载体为成功构建的标准品质粒;试剂盒提取质粒电泳结果显示,大小约为3319bp左右,说明质粒提取完整(图1B)。不同梯度稀释标准品质粒进行定量荧光PCR,对其扩增产物作熔解曲线,只有一个特异性吸收峰,没有非特异性杂峰,熔解温度为83℃(图2),表明使用的实时荧光定量PCR引物特异性较好。
根据NanoDrop8000测定核酸浓度换算所得质粒浓度为3.7×109拷贝/μL,10倍系列梯度稀释,共8个梯度,分别为3.7×108~3.7×101拷贝/μL,进行荧光定量PCR,各梯度的扩增曲线均呈现典型的“S”型,3次重复实验的扩增曲线近乎重叠,随着质粒浓度的降低,其对应的Ct值相应增加,两者之间呈现良好的相关性(图3a)。计算质粒拷贝数与Ct值的相关性,得到标准曲线方程为Ct = -3.2658x+34.083(x为质粒拷贝数的对数),相关系数R²=0.9967(图3b),表明标准曲线线性关系良好,即在标准质粒稀释浓度范围内具有良好的线性关系。
2.2 累计死亡率统计结果
统计结果显示,在感染WSSV后24h内没有出现死亡现象;感染后24~48h内,出现少量死亡;在48~72h内,出现大量死亡;然后死亡速度下降,96h时累积死亡率为100%(图4)。对照组螯虾没有出现死亡。
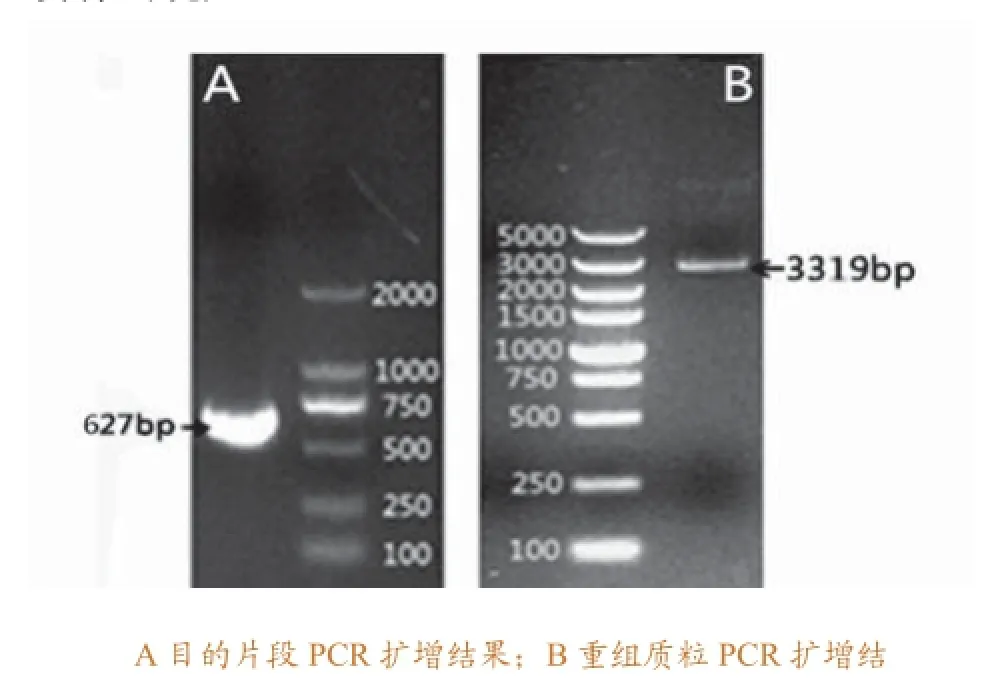
图1 WSSV VP28基因片段的扩增及鉴定
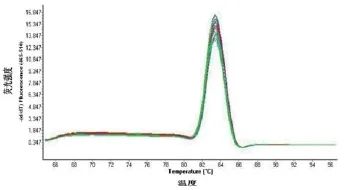
图2 实时荧光定量PCR熔解曲线

图3 WSSV VP28基因荧光定量PCR反应的扩增曲线(a)与标准曲线(b)
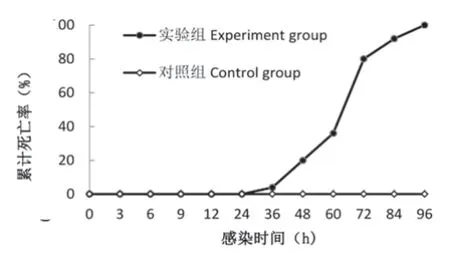
图4 感染WSSV后不同时间点螯虾的累计死亡率曲线
2.3 螯虾组织中WSSV数量动态变化
以感染WSSV后不同时间点螯虾各组织DNA为模板进行实时荧光定量PCR检测,结果显示(图5),注射感染WSSV后3h时,在螯虾血淋巴、鳃、附肢和造血组织中检测到WSSV;感染后12h时,在肌肉和心脏组织中检测到WSSV。不同组织中的WSSV浓度有较大差异。在感染WSSV后3~12h内,血淋巴中的WSSV浓度较低且增长缓慢;24~48h内WSSV浓度呈指数增加;48~72h内WSSV浓度维持在较高水平但增长速度变慢,且明显低于濒临死亡的螯虾血淋巴中WSSV数量(7.94×105拷贝/ngDNA)。鳃组织内的WSSV浓度在感染后6h内增长缓慢;12~24h时WSSV浓度迅速显著增加;在36~72h时WSSV浓度增加缓慢,但维持在一个较高的水平;濒临死亡的螯虾鳃中WSSV浓度为3.95×105拷贝/ngDNA。肌肉在感染后12h时检测到少量WSSV,从24h开始至48h内WSSV浓度呈指数增加;48h~72h时WSSV浓度增加变慢;濒临死亡的螯虾肌肉中WSSV浓度为4.35×103拷贝/ngDNA。附肢中WSSV浓度在感染后12h内增长缓慢,24~48h内WSSV浓度呈指数增长,然后病毒浓度增长变慢且维持在一个较高的水平;濒
临死亡螯虾附肢中WSSV浓度为1.03×106拷贝/ ngDNA。心脏中WSSV浓度在感染后12h内增长缓慢且浓度较低;24~60h时,WSSV浓度显著增加;60~72h时,WSSV浓度增加速度变慢;濒临死亡螯虾心脏组织中WSSV浓度为3.95×105拷贝/ngDNA。造血组织中WSSV浓度在感染后12h内较低,增长速度缓慢,在24~36h时WSSV浓度显著增加;48~72h时,WSSV浓度增长速度变慢;濒临死亡螯虾造血组织中WSSV浓度为1.19×105拷贝/ngDNA。
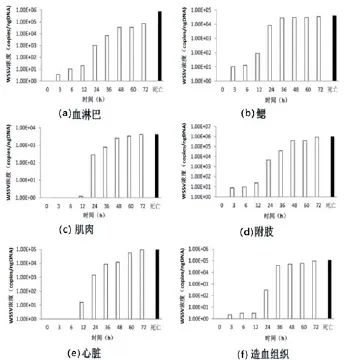
图5 感染WSSV后不同时间点取样组织及濒临死亡螯虾组织中WSSV数量测定
3 讨论
荧光定量PCR技术通过检测病毒基因组的拷贝数在一定范围内定量检测病毒[10],已证实病毒的个数与病毒基因组的拷贝数有非常密切的正相关关系[11]。VP28作为WSSV主要的囊膜蛋白,是WSSV主要致病蛋白之一,在囊膜完整的WSSV中含量很高[12]。本文利用WSSV囊膜蛋白VP28基因设计特异性引物,成功构建其重组质粒,建立了WSSV实时荧光定量PCR标准曲线,结果表明在标准质粒稀释浓度范围内线性关系良好,可以用于WSSV定量检测。
本文利用实时荧光定量PCR技术跟踪检测了WSSV感染后鳌虾组织中病毒数量的时序变化,发现在从注射感染WSSV到螯虾出现大量死亡的过程中,螯虾各组织中的WSSV浓度大致呈S型增长,感染后12h内在各组织中皆检测到病毒,但浓度较低,此时没有出现死亡;多数组织中WSSV浓度的指数增长发生在感染后24~48h内,此时螯虾出现少量死亡;感染后60~72h内各组织中WSSV数量达到缓慢增长的平台期,此时WSSV浓度较高,螯虾累计死亡率快速增长,显示出螯虾体内WSSV浓度与螯虾死亡率呈密切的正相关关系,与Tang等所得的南美白对虾体内WSSV浓度与虾患病严重程度呈密切正相关关系的结果一致[13]。本文分析发现鳌虾附肢中WSSV动态变化趋势代表了多数样品组织中的WSSV增殖规律,感染后各时间点附肢中WSSV浓度比大部分组织要高,濒临死亡鳌虾附肢中的WSSV浓度也高于其他各组织,与文献报道的附肢具有较高的WSSV检出率相一致[14],因此,附肢是很好的WSSV检测材料,根据附肢中的WSSV浓度来判断感染进程具有重要参考价值,并且切除附肢比切除其他组织例如鳃、肌肉等对虾体带来的伤害小,目前在实验室及养殖场检测中常用附肢作为首选的WSSV检测材料[15]。Sun等综合虾的死亡情况与附肢中WSSV浓度,将中国对虾感染WSSV后的发展阶段划分为轻、中、重度感染阶段[9],与本文中WSSV感染鳌虾后病程发展12h内没有死亡、24~48h少量死亡及60~72h内大量死亡的结果相一致。另外,血淋巴和鳃中WSSV浓度具有与附肢相似的变化趋势,只是病毒浓度稍低,也是较好的WSSV检测样品材料。本文结果说明WSSV感染后48h内是病毒增殖的关键期,而病毒增殖达到平台期以后是最有可能发生规模性死亡的时期,因此,检测到病毒后,要尽早采取措施干扰病毒复制或切断病毒传播,改善水环境条件,增强虾体免疫力,减慢病毒增殖速度,以减少规模性死亡发生的可能性。当然,在实际养殖过程中,WSSV初始感染浓度可能较低,病毒增殖达到致死浓度所需要的时间会延长,可能有更多时间采取相应预防措施。
在WSSV感染后不同鳌虾组织中病毒检出时间、增殖速度与数量有较大差异。肌肉注射感染WSSV后3h时,在螯虾鳃、血淋巴、附肢和造血组织中检测到WSSV,预示着WSSV可能是通过血淋巴传播到其他组织中;感染后12h时,在肌肉和心脏组织中检测到WSSV,并且在整个感染过程中WSSV浓度偏低,尤其肌肉中的WSSV浓度是所有样品组织中最低的,说明肌肉和心脏组织不是WSSV主要的靶器官。比较各组织中WSSV浓度,发现在感染后24h内,鳃组织中WSSV浓度最高,附肢和血淋巴次之但高于其他组织,肌肉中WSSV浓度最低。Tang等报道在感染早期凡纳滨对虾血
淋巴中WSSV浓度也较高[13]。在感染后36~72h时,附肢中WSSV浓度最高,血淋巴、鳃、心脏与造血组织次之,肌肉中WSSV浓度最低。通过检测濒临死亡或刚刚死亡螯虾组织中WSSV浓度,发现附肢中WSSV浓度中最高,血淋巴、鳃、心脏和造血组织稍低,肌肉中WSSV浓度最低,这些数据可以为WSSV检测及感染进程判断提供参考。
从本文结果可以看出,血淋巴可能在WSSV体内组织间传播中起了重要作用,WSSV随着血淋巴循环到达其它组织,造成对其它组织的感染。因附肢、鳃、血淋巴易于取样,且病毒在这些组织中增殖变化趋势较一致,代表了WSSV增殖规律,是很好的病毒检测与病程进展评估材料。
[1] van Hulten M C W,Witteveldt J,Peters S,et al. The white spot syndrome virus DNA genome sequence [J]. Virology,2001,286(1):7-22.
[2] Flegel T W. Detection of major penaeid shrimp viruses in Asia,a historical perspective with emphasis on Thailand [J]. Aquaculture,2006,258(1):1-33.
[3] Esobedo-Bonilla C M,Alday-Sans V,Ville M,et al. A review on the morphology,molecular characterization,morphogenesis and pathogenesis of white spot syndrome virus [J]. Journal of Fish Diseases,2008,31(1):1-18.
[4] Sanchez-Paz A. White spot syndrome virus:an overview on an emergent concern [J]. Veterinary Research,2010,41(6):43.
[5] Lo C,Chang Y,Cheng C,et al. PCR monitoring of cultured shrimp for white spot syndrome virus(WSSV)infection in grow out ponds[M].// Flegel T W. Advances in Shrimp Biotechnology. National Center for Genetic Engineering and Biotechnology. Bangkok,1998:281-286.
[6] Jang I K,Kim J S,Kim B R,et al. Comparison of white spot syndrome virus quantification of fleshy shrimp Fenneropenaeus chinensis in outdoor ponds between different growing seasons by TaqMan real-time polymerase chain reaction [J]. Aquaculture Research,2011,42:1869–1877.
[7] Meng X H,Jang I K,Seo H C,et al. A TaqMan real-time PCR assay for survey of white spot syndrome virus(WSSV)infections in Litopenaeus vannamei postlarvae and shrimp of farms in different grow-out seasons [J]. Aquaculture,2010,310:32–37.
[8] 战文斌,邢婧,王远红,等. 聚合酶链反应(PCR)检测养殖对虾的白斑症病毒(WSSV)感染[J]. 中国水产科学,2000,7(1):51-54.
[9] Sun Y,Li F,Xiang J. Analysis on the dynamic changes of the amount of WSSV in Chinese shrimp Fenneropenaeus chinensis during infection [J]. Aquaculture,2013,367-369:124-132.
[10] Dhar A K,Roux M M,Klimpel K R. Detection and quantification of infectious hypodermal and hematopoietic necrosis virus and white spot virus in shrimp using real-time quantitative PCR and SYBR Green chemistry [J]. Journal of Clinical Microbiology,2001,39:2835–2845.
[11] Bumstead N,Sillibourne J,Rennie M,et al. Quantification of Marek's disease virus in chicken lymphocytes using the polymerase chain reaction with fluorescence detection [J]. Journal of Virological Methods,1997,65:75–81.
[12] van Hulten M C W,Witteveldt J,Snippe M,et al. White spot syndrome virus envelop protein VP28 is involved in the systemic infection of shrimp [J]. Virology,2001,285(2):228-233.
[13] Tang K F J,Lightner D V. Quantification of white spot syndrome virus DNA through a competitive polymerase chain reaction [J]. Aquaculture,2000,189(1):11–21.
[14] Lo C F,Ho C H,Chen C H,et al. Detection and tissue tropism of white spot syndrome baculovirus(WSBV)in captured brooders of Penaeus monodon with a special emphasis on reproductive organs [J]. Diseases of Aquatic Organisms,1997,30:53–72.
[15] Powell J W B,Burge E J,Browdy C L,et al. Efficiency and sensitivity determination of Shrimple®,an immunochromatographic assay for white spot syndrome virus(WSSV),using quantitative real-time PCR [J]. Aquaculture,2006,257:167–172.
Analysis on Dynamic Changes of WSSV Amount in Procambarus clarkii through Quantitative Real-time PCR
Zhang Ling,Tang Xiaoqian,Sheng Xiuzhen,Zhan Wenbin
(Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao,Shadong 266003)
A real-time quantitative PCR was developed and the absolute copy number of WSSV VP28 gene was quantified based on a standard curve in Procambarus clarkii infected with WSSV. Following intramuscular injection with WSSV,the gill,hemolymph,heart,muscle,pleopods and hemopoietic tissue of Procambarus clarkii were sampled at 0,3,6,12,24,36,48,60 and 72 h post infection(hpi),DNA was extracted from the samples and the viral load was analyzed. It was found that WSSV was detected in pleopod,gill hemolymph and hemopoietic tissue at 3 hpi,and in all sampled tissues at 12hpi with low absolute copy number of WSSV;then the WSSV copies increased logarithmically from 24 to 48hpi and a low mortality rate was observed. Thereafter,the WSSV propagation went into the plateau phase and massive mortality appeared from 60 to 72hpi,showing a positive correlation between the viral load and cumulative mortality of Procambarus clarkii. Obvious difference in WSSV copy numbers were found in tested tissues,and WSSV copies in pleopod were the highest,followed by hemolymph,gill,heart and hemopoietic tissue,and the lowest in muscle. The dynamic changes of the amount of WSSV in pleopods could well represent all sampled tissues of Procambarus clarkii,so pleopods could be a reliable tissue for WSSV detection. This study might provide technical support for early diagnosis of WSSV infection and important basic data for better understanding of WSSV proliferation rules in shrimp.
Procambarus clarkii;white spot syndrome virus;quantitative real-time PCR;virus proliferation
S941.41+9;S945.4
A
1005-944X(2015)06-0069-06
国家科技支撑计划课题(2012BAD17B01)、公益性行业(农业)科研专项经费项目(201103034)和山东省科技发展计划项目(2014GNC111015)资助。
绳秀珍

