吉安西杂母牛DGAT1基因K232A遗传多态性及其对乳成分影响的分析
娄佑武,吴志勇,王荣民,陈国良,宁 财,雷初朝,黄永震*
(1.江西省畜牧技术推广站,江西 南昌330046;2.西北农林科技大学动物科技学院,陕西省农业分子生物学重点实验室,陕西 杨凌712100)
牛奶和乳制品是人类一个宝贵的营养来源,乳成分可以通过奶牛的营养和育种选择进行改善和提高。二脂酰甘油酰基转移酶1(acyl CoA:diacylgyeerol acyltransferase,DGAT1)是哺乳动物体内的一种非常重要的酶,DGAT1是催化甘油三脂(triacylgycer0l,TAG)合成的最后一步反应的关键酶,也是甘油三脂合成过程中唯一的关键酶,其主要机制是使二酰甘油加上脂肪酸酰基形成三酰甘油。DGATI在大多数的组织中具有较高的表达水平,特别是在乳腺、小肠、睾丸、脂肪组织和皮肤中的表达量最高,该基因在泌乳、脂肪吸收、脂蛋白组装和脂肪形成中发挥着重要的功能[1,12]。
DGAT1在很多物种中是一种含有500个氨基酸的蛋白,具有较强的疏水性[2],并具有二聚体和同源四聚体的结构[3]。该酶参与肠道中脂肪吸收、血浆中甘油三脂浓度的调节、脂蛋白的组装、脂肪细胞中脂肪的储存、肌肉中能量代谢以及体脂的合成、禽蛋以及卵母细胞的形成[4,5]。
DGAT1是泌乳性状候选基因,小鼠缺乏DGAT1会失去分泌乳的功能[6]。DGAT1基因K232A多态性对牛产乳性状(牛奶产量、蛋白质含量、脂肪含量和脂肪酸组成)有重要影响[7]。DGAT1基因位于牛的14号染色体上,研究发现,与牛奶产量性状相关的一个潜在数量性状位点(QTL)也定位在牛14号染色体上[8,9]。
在成熟的蛋白质中,DGAT1基因外显子8的232位氨基酸的改变,即赖氨酸突变为丙氨酸的氨基酸序列(p.Lys232Ala,或表示为K232A)能够影响牛奶乳脂组成和脂肪含量[10]。奶牛DGAT1基因K232A突变产生的不同基因型之间在305d产奶量,乳脂量和乳蛋白量等差异显著,该基因多态及其与产奶性状密切相关,其效应在不同国家的奶牛群体中得到了验证[7-11,13-16]。
江西吉安西杂牛是乳肉兼用型西门塔尔牛与吉安黄牛杂交产生的后代,适应性好,具有比吉安黄牛产奶量、乳脂率高的特点,可开发高乳脂率的牛奶和生产黄油。关于江西吉安西杂母牛DGAT1基因K232A突变多态性及其与乳成分性状的关系研究尚未见报道。因此,本研究采用PCR、DNA测序技术,酶切和琼脂糖凝胶电泳等方法检测了吉安西杂母牛98头个体DGAT1基因的遗传变异,分析了其遗传结构和遗传多样性,并对98头个体在该基因K232A突变位点的多态性与其4个乳成分指标进行了相关分析。
1 材料与方法
1.1 样品来源与数据收集
本研究所用98份成年吉安西杂母牛(Xiza cattle,XZ)母牛的血样,采自江西牛牛乳业有限公司西杂母牛群,测定的主要性状包括:脂肪(Fat)、非脂(Non-fat)、蛋白质(Protein)和乳糖(Milk sugar)的百分含量;测定时间为2012年1月~2014年12月。
1.2 引物的设计和PCR扩增
根据GenBank上公布的奶牛DGAT1基因的DNA序列(登录号:AJ318490),围绕K232A突变位点,利用引物设计软件Primer5.0设计引物(Fp:5'-CACCATCCTCTTCCTCAAGC-3';Rp:5'-CCTCACCATCTCCAGGAGTC-3');引物由上海生工生物工程公司合成。
PCR反应体系为25μL,包括:10×Buffer(Mg2+free)2.5μL、Mg+2+1.5μL、dNTPs 0.5 μL、FP 0.5μL、RP 0.5μL、DNA 模板(50ng/μL)2μL,加双蒸水至25μL。
PCR反应条件为95℃预变性5min;95℃变性45s,61℃退火45s,72℃延伸45s,35个循环;72℃延伸10min,4℃保存。
1.3 DNA池的建立、测序分析和琼脂糖凝胶电泳检测
随机从提取的所有DNA样品中选出1/3的样品,各取5μL,放入同一离心管中,混匀,调整终浓度为50~60ng/μL,快速建立吉安西杂母牛混合DNA池。
以DNA池样品为模板进行扩增,抽取5μL PCR产物在1%的琼脂糖凝胶中电泳检测,将目的条带清晰、明亮的产物,利用PCR扩增产物回收纯化试剂盒进行回收及纯化(北京天根生物公司),回收产物直接在ABI 3730自动测序仪上进行双向测序(上海生物工程有限公司)。将测序结果提交http://www.ncbi.nlm.nih.gov/BLAST 网站比较,以检测SNPs位点。
PCR产物的琼脂糖凝胶电泳检测:抽取10μL PCR产物经限制性酶EaeI消化处理,选用2%(w/v)的琼脂糖凝胶,电泳50~60min,采用EB染色,分析、拍照。
1.4 统计分析
采用PopGene软件进行群体遗传分析,对观测到的基因型进行计数,分别统计基因频率和基因型频率、纯合度(Ho)、杂合度(He)、有效等位基因数(Ne)和多态信息含量(PIC)。以及对多态位点的基因型频率分布进行Hardy-Weinberg平衡检验。
采用SPSS软件(Version 16.0)的 GLM(General Linear Models)程序对 DGAT1基因型与乳成分性状进行关联分析,所用动物模型为:Yijk=μ+Ai+ Gj+ Eijk,其中,Y-ijk:个体乳成分记录;μ:总体均数;Ai:年龄效应;Gj:基因型效应;Eijk:随即误差。
2 结果
2.1 DGAT1基因突变区扩增产物的多态性分析
经DNA池PCR扩增产物测序发现,吉安西杂母牛DGAT1扩增区存在一个K232A的突变位点,这个位点也正是限制性内切酶EaeI的酶切位点。所以,利用DGAT1基因扩增片段中存在限制性内切酶EaeI的特异性酶切位点特性,使用EaeI酶切结合凝胶电泳的RFLP法对吉安西杂母牛进行分型,酶切后KK型片段大小为441bp,AA型片段大小为(239bp+202bp),KA型片段大小为(401bp+239bp+202bp),判型结果如图1所示。在所研究群体中,该位点存在多态性,发现3种基因型AA、KA和KK。

图1 吉安西杂母牛DGAT1基因突变区2%琼脂糖凝胶电泳
2.2 基因型和等位基因频率及在吉安西杂母牛群体中的遗传特性
从表1可知,在3种基因型AA、KA和KK中,AA基因型为优势基因型。等位基因A和K在西杂母牛群体中的分布频率分别为0.56和0.44;等位基因A的分布频率高于K基因。PIC在西杂母牛群体中为0.371(0.25<PIC<0.5),属于中度多态。平衡检验的结果显示,吉安西杂母牛群体处于哈德-温伯平衡状态(P>0.05)。
对DGAT1基因突变位点的基因频率和基因型频率统计分析,该突变位点在吉安西杂母牛群体中基因型频率和基因频率及Ho、He、Ne和PIC结果见表1。

表1 吉安西杂母牛DGAT1基因K232A遗传多态性指标
2.3 吉安西杂母牛群体DGAT1基因突变位点与乳成分的相关分析
在表2中列出了吉安西杂母牛DGAT1基因突变位点不同基因型个体的乳脂率、乳非脂率、乳蛋白率和乳糖率的统计值,经显著性检验和多重比较,结果表明:KA杂合型个体的在乳脂率、非脂率、乳蛋白率和乳糖率指标上都大于KK型AA型的趋势,但差异不显著(P>0.05)。
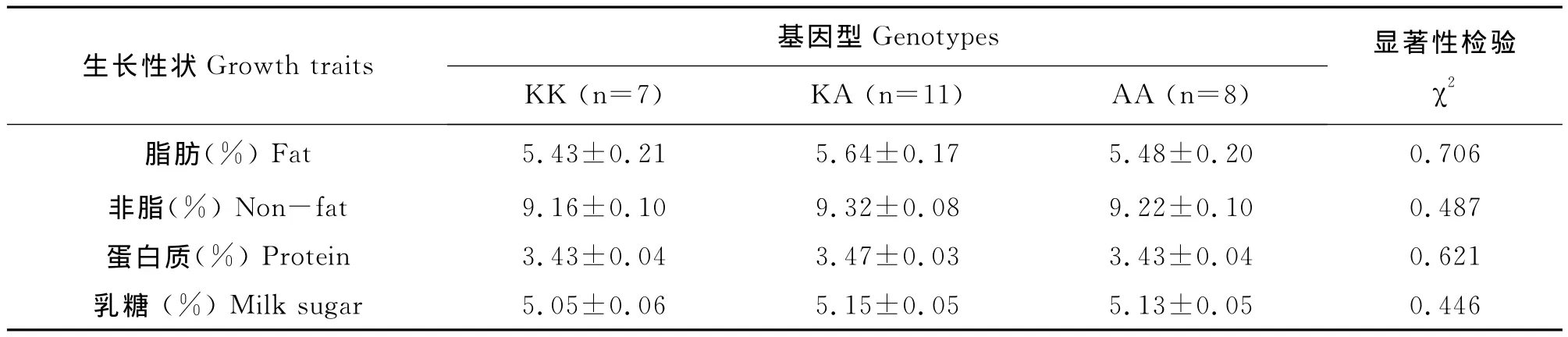
表2 吉安西杂母牛DGAT1基因K232A多态性与生乳检测指标的关联分析
3 讨论
3.1 DGAT1基因突变多态性研究
本研究以牛DGAT1基因作为影响奶牛乳成分的候选基因,对吉安西杂母牛群DGAT1基因外显子8区域K232A突变的遗传多态性进行了检测。结果显示,A等位基因是群体中的优势等位基因,AA基因型是优势基因型。野生纯合子KK基因型少于突变纯合子AA基因型,这种现象显示在人工选择,迁移,遗传漂变过程中,动物种群中K等位基因的频率呈现减少的趋势。
3.2 DGAT1基因突变对乳成分的影响
由于该缺失突变存在于牛DGAT1基因外显子8区域,该突变可能对DGAT1基因自身的翻译效率产生影响,我们推测该缺失突变对奶牛的脂肪合成性状起了间接的作用。为了证实外显子8区域K232A突变对牛泌乳性状的影响机理,仍需要对牛DGAT1基因在转录翻译水平做进一步的研究。
在本研究中,我们对3种基因型与乳成分进行了关联分析。结果显示:KA杂合型个体的脂肪、非脂、蛋白质和乳糖的百分含量大于AA和KK型。推测等位基因K和A可能产生互作影响西杂母牛的乳成分。因此,奶牛遗传育种工作者在西杂母牛选育过程中,应当尽可能的选择KA基因型个体,进行扩群饲养,不断提高KA基因型个体在群体中的频率,最终育成西杂牛新品系。
3.3 DGAT1基因与泌乳性能的关系
泌乳性状是受多基因座位控制的,影响泌乳性状主基因的确定对我国地方黄牛品种向乳用方向培育有重要意义。候选基因法是寻找畜禽QTL一种非常有效的方法,它可以直接研究具有特定功能基因的多态性与经济性状之间的关系。已有研究证明,DGAT1基因在动物的脂代谢和泌乳过程中起着重要的作用,该基因的突变对奶牛的乳成分有重要影响。因此,可以被其作为候选基因与数量性状位点(QTL)作连锁分析,用于数量性状的辅助标记选择。在吉安西杂母牛群体中,已反映出KA基因型个体比AA、KK基因型个体在乳成分性状上有一定的优势,但还必须扩大样品做进一步验证。
[1] Cases S,Smith SJ,Zheng YW,et al.Identification of a geneencoding an acyl CoA:diacylglycerol acyltransferase,a key enzyme in triacylglycerol synthesis[J].Proc Natl Acad Sci USA,1998,95(22):13018-13023.
[2] Buhman KK,Chen HC,Farese RV.The enzymes of neutral lipid synthesis[J].Biol Chem,2001,276(44):40369-40372.
[3] Cheng D,Meegalla RL,He B,et al.Human acyl-CoA:diacylglycerol acyhransferase is a tetrameric protein [J].Biochemistry,2001,359(Pt3):707-714.
[4] Cases S,Stone SJ,Zhou P,et al.Cloning of DGAT2,a second mammalian diacylglycerol acyhrasferase,and related family members[J].Biol Chem,2001,276(42):38870-38876.
[5] Buhman KK,Smith SJ,Stone SJ,et al.DGATI is not essential for intestinal triacylglycerol absorption or chylomicron synthesis[J].Biol Chem,2002,277(28):25474-25479.
[6] Winter A,Krmer W,Werner FA,et al.Association of a lysine-232/alanine polymorphism in a bovine gene encoding acyl-CoA:diacylglycerol acyltransferase(DGAT1)with variation at aquantitative trait locus for milk fat content[J].Proc Natl Acad Sci USA,2002,99(14):9300-9305.
[7] Lu J,Boeren S,van Hooijdonk T,et al.Effect of the DGAT1 K232Agenotype of dairy cows on the milk metabolome and proteome[J].J Dairy Sci,2015,98(5):3460-3469.
[8] Tǎbǎran A1,Balteanu VA,Gal E,et al.Influence of DGAT1 K232Apolymorphism on milk fat percentage and fatty acid profiles in Romanian holstein cattle [J].Anim Biotechnol,2015,26(2):105-111.
[9] Bennewitz J,Reinsch N,Paul S,et al.The DGAT1K232A mutation is not solely responsible for the milk production quantitative trait locus on the bovine chromosome 14 [J].J Dairy Sci,2004,87(2):431-442.
[10] Schennink A,Stoop WM,Visker MH,et al.DGAT1underlies large genetic variation in milk-fat composition of dairy cows[J].Anim Genet,2007,38(5):467-473.
[11] Duchemin S,Bovenhuis H,Stoop WM,et al.Genetic correlation between composition of bovine milk fat in winter and summer,and DGAT1and SCD1by season interactions[J].J Dairy Sci,2013,96(1):592-604.
[12] 肖海霞,托乎提·阿及德,田可川,等.哺乳动物DGAT1基因的研究进展 [J].草食家畜,2009,144(3):7-11.
[13] 徐秀容,高雪,许尚忠,等.牛DGAT1基因的K232A取代等位基因分布频率及对部分胴体性状的影响 [J].中国农业大学学报,2006,11(4):11-15.
[14] 贾晋,马妍,孙东晓,等.中国荷斯坦牛DGAT1基因与产奶性状关联分析[J].畜牧兽医学报,2008,39(12):1661-1664.
[15] 樊月圆,王强,张永云,等.德宏奶水牛DGAT1基因多态性及其与产奶性状的相关性分析[J].家畜生态学报,2011,32(6):27-32.
[16] 卢振峰,刘莉莉,赵国丽,等.三河牛DGAT1基因K232A位点与产奶性状的关联分析[J].中国奶牛,2014,32(3):13-16.

