中国荷斯坦奶牛催乳素基因多态性与泌乳性能关联性分析
郑新宝,唐 倩,徐世永,毋状元
(1.新疆畜牧科学院畜牧科学研究所,新疆 乌鲁木齐830000;2.金陵科技学院,江苏 南京210014)
催乳素(prolactin,PRL)又名促乳素,是脊椎动物腺垂体分泌的单链多肽类激素,属于生长激素/催乳素家族[1]。催乳素通过与靶细胞膜表面的催乳素受体结合,启动JAK2/STAT5信号传导途径,最终激活反式作用因子,使其作用于乳蛋白基因启动子区的靶序列,启动或增强以乳蛋白基因启动子为作用元件的靶基因的表达[2]。
大量的试验研究都证明催乳素在促进哺乳动物个体的乳腺发育、乳汁生成、发动和维持泌乳方面发挥重要作用[3]。因此催乳素基因可被视为对奶牛泌乳性能具有重要作用的候选基因[4]。目前,国内外不少学者已对催乳素基因多态性进行群体遗传及其与生产性能关联研究,但还需进一步分析,以确定该基因确切的遗传效果。本试验运用PCR-RFLP技术对新疆地区中国荷斯坦牛催乳素基因调控区多态性进行检测和分析,为探寻催乳索基因调控区与产奶量、乳蛋白、乳脂率等经济性状的相关程度,筛选出对产奶性状有显著影响的基因型,为催乳素基因作为分子遗传标记应用于奶牛早期选种提供理论和技术参考。
1 材料及方法
1.1 材料
试验样品 本试验以新疆天山畜牧生物股份有限公司种公牛站中国荷斯坦种公牛和奶牛繁育场高产中国荷斯坦奶牛为研究对象,共采集荷斯坦奶牛血样357头份。样品用EDTA抗凝采血管,采用颈静脉方法采集。样品采集混匀后低温带回实验室,-20℃保存备用。
性状的表型记录 试验个体均有完整系谱档案资料和生产性能测定(DHI)记录,包括:305d产奶量、乳蛋白率、乳脂率和体细胞等项目。
1.2 主要仪器设备
高速冷冻离心机、PCR扩增仪、电热恒温培养箱、水浴锅,凝胶成像系统、琼脂糖水平电泳槽、稳压电泳仪、电子天平、磁力搅拌器、移液器、振荡器、微型离心器、微波炉、冰箱等。
1.3 主要试剂及配制
Bio-spin全血基因组DNA提取试剂盒、琼脂糖(Agarose)、显色剂 Goldview、去离子水和蒸馏水、DNA Maker(DL 2000和1kb)、溴酚蓝、配制 TBE液的药品:二羟甲基氨基甲烷(Tris)、硼酸、乙二胺四乙酸(EDTA)、2×PCR Mix酶、PRL正反引物PRLR和PRLFRFLP用限制性内切酶:Rsa I酶和Buffer 4。
2 试验方法
2.1 奶牛DNA的提取
将200μL样品,10μL PK solution ,200μL Lysis B Buffer加入离心管,震荡混匀5~10s,在水浴锅中56°C温育10min后,加入200μL无水乙醇,震荡混匀5~10s,再将上述液体转移至有收集管的spin column,6 000~8 000×g离心1min,弃去套管内液体,加入500μL WB1Buffer,10 000×g离心30~60s,弃去套管内液体,加入700μL Wash Buffer,10 000×g离心30~60s,弃去套管内液体,再13 000×g离心2min,并将液体移到离心管。最后,加入100~200μL Elution Buffer,静置1min,并13 000×g离心1min,丢弃spin column,离心管内液体含有基因组DNA,低温保存。
2.2 DNA的琼脂糖凝胶电泳检测
在100mL的1×TBE中加入1.5g的琼脂糖,制成的1.5%琼脂糖溶液。将5μL的DNA样品和2μL的溴酚蓝混合均匀后,加入点样孔,同时点一个DNA Marker(1kb),100V电泳30~45min左右,再用紫外分析仪观察结果,并用凝胶成像系统拍照。
2.3 PCR扩增
2.3.1 PCR引物设计 引物相关信息见表1。

表1 PCR引物信息(20μL)
2.3.2 PCR反应体系和条件 PCR反应体系采用2×PCR Mix酶。
反应条件最主要的是退火温度和循环次数。即在确定每对引物的PCR退火温度时,先根据引物序列中的G+C含量初步确定其退火温度的大致范围,然后在此范围内,每隔2°C为一个间隔,利用PCR仪,跑梯度做分析,以检测扩增效率。

表2 PCR扩增反应体系的组成(20μL)

表3 PCR反应程序
2.4 PCR产物的酶切
PCR扩增完后,用限制性内切酶RsaI消化扩增产物12h。PCR反应组成为 Buffer 2:3μL;HindⅢ:0.5μL;PCR 产物:10μL;去离子水:6.5μL。
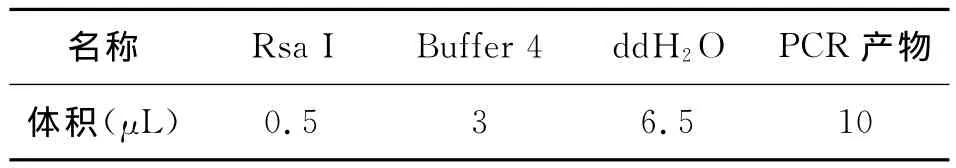
表4 PCR产物的酶切体系(20μL)
2.5 酶切片段的电泳分离与鉴定
用1.5%的琼脂糖凝胶对消化完的酶切产物的片段进行电泳分离,比较反应完毕后的限制性酶切片段的多态性。其中未被Rsa I酶切开的片段为AA型,被RsaI酶切开一部分的片段为AB型,被RsaI酶完全切开的片段为BB型。
2.6 群体遗传学分析
对多态位点的基因型与产奶量、乳蛋白率、乳脂率进行关联分析,统计模型为:Yijk=μ+αi+βj+eijk,其中Yijk为性状观察值,μ为群体均值,αi为基因型效应值,βj为群组效应值,eijk为随机残差效应。用SAS8.2软件包的GLM 程序进行方差分析,估计不同基因型的最小二乘均值,计算基因的加性效应、显性效应并进行显著性检验;用R软件中的Genetics包计算多态位点的基因频率、基因型频率、杂合度、有效等位基因含量和多态信息含量。
3 结果与分析
3.1 DNA提取及PCR产物扩增结果
从电泳检测图1可以看出,每条泳道都有一条清晰,明亮的带,且几乎没有拖尾的现象,说明提取的基因组DNA质量较好。
通过特异性引物的PCR扩增得到的产物是bPRL的外显子Ⅲ的序列,结果见图2。从图2可以看出,PCR扩增产物明亮、整齐、无杂带。扩增产物浓度较高,达到进行酶切的要求。

图1 DNA提取结果电泳图谱

图2 PCR产物电泳图谱
3.3 PCR产物酶切
用Rsa I酶对扩增产物进行酶切,部分样本酶切结果见图3。从图3可见,群体中存在3种基因型。其中AA基因型,片段大小为156bp;AB基因型,片段大小为156bp、82bp、74bp;BB基因型,片段大小为82bp、74bp。
因为琼脂糖凝胶本身的分辨率的原因,相差20 bp以内的条带,不能完全分辨出来,切出的两条带会重叠在一起,不易看出。
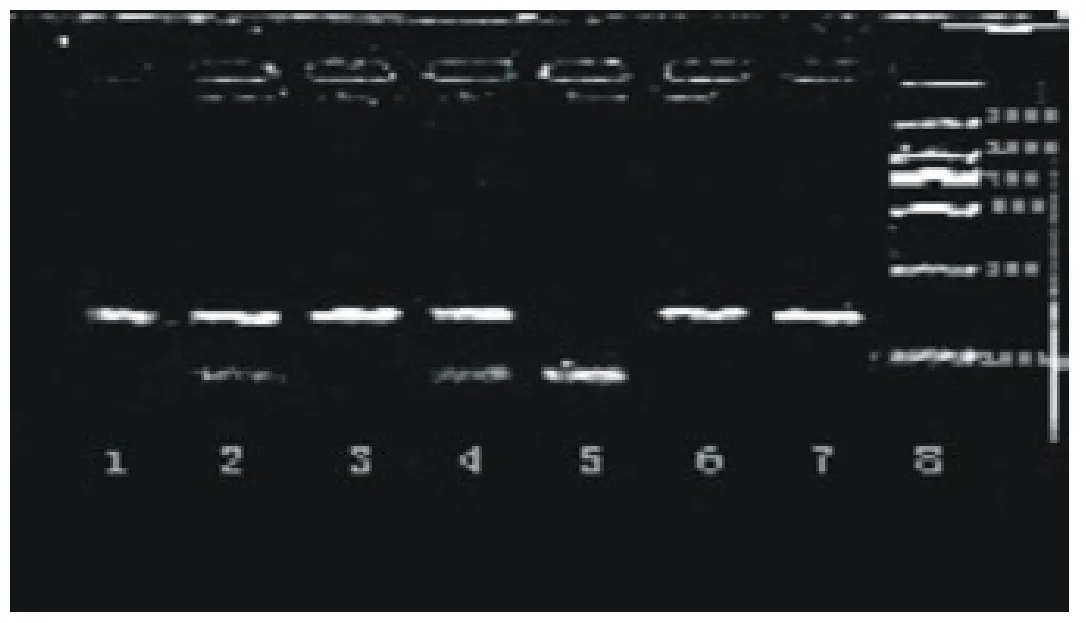
图3 PCR产物酶切反应结果
第1、3、6、7泳道为 AA 基因型;第2、4泳道为AB基因型;第5泳道为BB基因型。
3.4 群体遗传特征统计分析
从表4中可以看出,AA型为优势基因型,A等位基因为优势等位基因。从表5中可以看出,试验牛群处于低度多态(PIC<0.25)。通过卡方适合性检验得出P<0.05,差异显著,说明该位点在研究群体中处于Hardy-Weinberg不平衡状态。
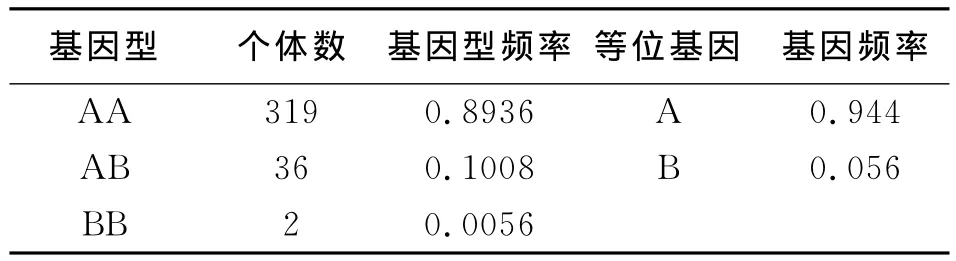
表4 PRL的基因型和等位基因频率

表5 PRL的多态信息含量、杂合度及有效等位基因数
3.5 PRL基因多态性与荷斯坦牛泌乳性状的关联分析
表6显示了PRL基因不同基因型对中国荷斯坦奶牛产奶性状的影响。可以看出,就乳蛋白率而言,BB基因型个体的乳蛋白率显著大于AA基因型个体(P<0.01),BB基因型个体的乳蛋白率大于AB基因型个体(P<0.05),但AA基因型个体与AB基因型个体间差异不显著(P>0.05)。表明A基因对中国荷斯坦奶牛乳脂率有显著影响。
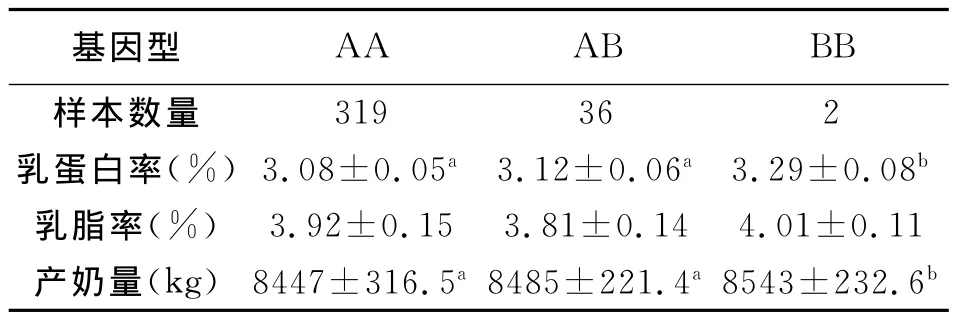
表6 三种基因型不同形状表型值的统计
4 讨论
PRL基因与产奶量和乳脂产量等密切关联,是奶牛产奶性状主要候选基因。在本研究中,试验群体的多态性较低,遗传变异不大,选育工作强度不大。本试验的奶牛群体处于Hardy-Weinberg不平衡状态。导致出现不平衡状态的原因可能是:①该奶牛群体的父母代(包括种公牛和成母牛)是90年代末期从美国引进的,有可能会对有利基因进行过高强度的选择;② 在奶牛育种工作中随着人工授精技术的广泛开展,使得群体间进行非随机交配。
国内外学者已对PRL基因多态性进行了分析。众多研究结果不尽一致。1990年,Cowan等利用RFLP技术对位于23号染色体上的催乳素基因组进行分析,发现AA型与BB型的产奶量、干酪率和蛋白率分别相差 282.9kg、48.58%、53.67%[5]。周国利等通过PCR-RFIP法分析了bPRlexon3在543头北京荷斯坦母牛中的多态性。结果表明:在泌乳l期AA和AB基因型奶牛的奶、乳脂和乳蛋白产量高于BB基因型(P<0.01)。在泌乳Ⅱ期,AB基因型奶牛的奶、乳脂和乳蛋白产量高于AA基因型(P<0.01);在泌乳Ⅱ、Ⅲ期,AA基因型奶牛的乳蛋白率高于 AB基因型[6]。xiucai Hu等通过PCR-SSCP的方法分析了PRL基因与中国荷斯坦奶牛产乳性状的相关性.研究表明PRL基因与产奶量和乳脂产量等有密切的联系[7]。李吉涛等(2004)采用PCR-RFLP技术,在99头荷斯坦牛中检测到催乳素基因AA、AB、BB3种基因型,同时结合产奶性状进行最小二乘分析,结果表明:3种基因型的奶牛平均产奶量差异显著(P<0.05),BB型高于AB型,AB型高于AA型;乳蛋白率差异极显著(P<0.01),BB型最高,AA 型最低;乳脂率差异不显著(P>0.05)。表明PRL基因对奶牛产奶性状具有重要影响[8]。在本试验新疆地区奶牛群体内,RFLP位点上具有BB基因型的个体在乳蛋白率、乳脂率、产奶量等性状上明显优于AA和AB型个体,基因型对乳蛋白率的影响达到极显著水平(P<0.01)。但BB基因型个体数太少,因此,等位基因B的作用有必要进一步扩大样本含量以验证。基因型BB有可能作为影响产奶性状的一个候选基因型进行分子遗传标记,应用到中国荷斯坦奶牛分子育种中。
[1] 郭彦斌,杨海玲,王慧等.奶牛催乳素(PRL)及其受体(PRLR)基因研究进展[J].山东农业大学学报(自然科学版),2009,40(3):469-472.DOI:10.3969/j.issn.1000-2324.2009.03.033.
[2] 陈丹霞,袁静.DNA多态性与奶牛泌乳性状相关基因的研究进展[J].河南畜牧兽医(综合版),2010,31(1):13-16.
[3] 张秀红,甘海云.催乳素基因与奶牛产奶性能的关系[J].乳业科学与技术,2007,30(1):47-48.DOI:10.3969/j.issn.1671-5187.2007.01.015.
[4] 李吉涛,杜立新.中国荷斯坦牛催乳素基因型与产奶性状的相关分析[J].山东农业大学学报(自然科学版),2004,35(4):553-555,559.
[5] Cowan CM,Bentine MR,Ax RL,et al.Structural variation around prolactin gene linked to quantitative traits in all elite Holstein sire family[J].Theory Apply Genet,1990,79:577-582.
[6] 周国利,朱奇,吴玉厚等.奶牛催乳素基因多态性与产奶性状的关系[J].吉林农业大学学报,2006,28(1):80-83.DOI:10.3969/j.issn.1000-5684.2006.01.023.
[7] Xiucai Hu,Hong Chen,et al.Single nucleotide poly-morphisms in bovine PRL gene and their associations with milk production traits in Chinese Holsteins[J].Mol Biol Rep,2009,(11):9762-9765.
[8] 李吉涛,杜立新.中国荷斯坦牛催乳素基因型与产奶性状的相关分析[J].山东农业大学学报(自然科学版),2004,35(4):553-555,559.

