猪源性blaNDM-1阴性雷氏普罗威登斯菌的分离鉴定
王建昌,姜彦芬,王金凤,陈志敏,李 静
(河北出入境检验检疫局检验检疫技术中心,河北石家庄 050051)
猪源性blaNDM-1阴性雷氏普罗威登斯菌的分离鉴定
王建昌,姜彦芬,王金凤,陈志敏,李 静
(河北出入境检验检疫局检验检疫技术中心,河北石家庄 050051)
为了解美国进口种猪人畜共患性致病菌的携带情况,本研究采集种猪新鲜粪便样品,进行常见致病菌的分离。结果在120份样品中分离到1株普罗威登斯菌,命名为HBA13。通过不同选择性培养基、常规生化鉴定及16S rRNA基因序列同源性比对分析,鉴定HBA13为雷氏普罗威登斯菌(Providencia rettgeri)。鉴于雷氏普罗威登斯菌在细菌耐药性方面的重要意义,进行了NDM-1表型检测,并利用PCR方法进行blaNDM-1耐药基因的检测,结果表明所分离雷氏普罗威登斯菌blaNDM-1耐药基因为阴性。猪源性blaNDM-1阴性雷氏普罗威登斯菌的分离,为今后相关研究奠定了基础。
猪;雷氏普罗威登斯菌;分离;鉴定;blaNDM-1基因
雷氏普罗威登斯菌(Providencia rettgeri)属于肠杆菌科,普罗威登斯菌属,流行病学研究表明,雷氏普罗威登斯菌主要与旅行者的腹泻有关,感染雷氏普罗威登斯菌后可引发腹泻、脑部、肺部、尿道等多种疾病[1],2006 年卫生部将该菌列入人间传染的病原微生物名录[2]。该菌属于人畜共患病病原,食物伴侣菌,可以污染食物造成中毒,同时该菌极易产生耐药性,特别是blaNDM-1导致的耐药性。目前大部分常用抗生素都含有β-内酰胺环结构,因此携带blaNDM-1的细菌可以使几乎所有临床常用抗生素失效[3]。
目前雷氏普罗威登斯菌引起人或动物感染情况在国内外均有报道。1997年,战文斌等[4]从患有败血病的中国对虾体内分离到三株Providencia rettgeri,并证实为引起对虾白血病的病原。2005年,章根华[5]报道了一起由Providencia rettgeri污染食物引起的食物中毒事件。2010年,昆山口岸从来自台湾的集装箱中截获两只京都亚洲蠊,并从中分离到Providencia rettgeri[6]。2012年,王建
峰等[7]从外来船舶压舱水中,蒋莹等[8]在新疆地区183例以急性腹泻为首发症状的病例中,Ayaka Shima等[1]在日本345份腹泻儿童粪便样品中,均分离到Providencia rettgeri。2013年,Marti T K等[9]首次报道了雷氏普罗威登斯菌在印度引起病人的医院获得性或社区获得性脑膜炎和硬脑膜下积脓;Kycko A等[10]从鳄鱼巨蜥的肺组织中分离到Providencia rettgeri。近年来,国内外对广泛耐药及blaNDM-1基因阳性的Providencia rettgeri的分离报道屡见不鲜。2013年,Nachiket P. Marathe等[11]从抗生素生产企业的污水处理厂中分离到93株广谱耐药菌,其中一株Providencia rettgeri对12大类的35种抗生素耐药;Barrios H等[12]在墨西哥,Carvalho-Assef AP等[13]在巴西,Shiraz Gefen-Halevi等[14]在以色列,夏淑等[15]在我国广州均分离到blaNDM-1基因阳性的Providencia rettgeri。
本文首次报道了从进口美国种猪新鲜粪便样品中分离到一株blaNDM-1基因阴性的雷氏普罗威登斯菌。
1 材料与方法
1.1 试剂与材料
本研究使用的培养基购自北京陆桥有限公司;API 20E、VITEK GNI 阴性菌鉴定卡,购自法国梅里埃公司;细菌基因组DNA提取试剂盒,购自北京天根;pMD® 19-T Simple Vector(CK1101CA),购自宝生物生物工程公司;药敏纸片、NDM-1(Ⅰ型新德里金属β-内酰胺酶)检测盒(C073),购自杭州滨河微生物试剂有限公司;2×Taq PCR MasterMix、Wizard® SV Gel and PCR Clean-Up System,购自美国Promega公司。本研究所用新鲜粪便样品共计120份,采自进口美国杜洛克、长白和大约克种猪。
1.2 主要设备
MIR-254-PC恒温培养箱(日本松下);VITEK2 Compact(法国梅里埃);OLYMPUS CX31显微镜(日本 OLYMPUS);普通PCR仪(德国Biometra)。
1.3 引物设计与合成
根据文献[16,17]设计扩增细菌16sRNA基因、细菌耐药性基因blaNDM-1的引物,由上海生工合成。
1.4 细菌分离纯化
将采集的新鲜粪便样品于PBS缓冲液中4 ℃保存,分离前用涡旋振荡器震荡1 min,用接种环划线分离培养于XLD琼脂平板,36 ℃,培养18 h,挑取平板上的优势菌落分离纯化。同时挑取单个菌落进行革兰氏染色观察细菌形态。将获得的纯菌种分别接种于血琼脂平板、EMB琼脂和SS琼脂平板,36 ℃培养18 h,分别观察生长情况及菌落特征。
1.5 细菌生化鉴定
1.5.1 初步生化鉴定。将分离纯化菌落进行氧化酶试验、触酶试验、硝酸盐还原试验、穿刺接种于三糖铁琼脂斜面,苯丙氨酸琼脂斜面。
1.5.2 API 20E生化鉴定。根据革兰氏染色及初步生化反应结果选用API 20E进行生化鉴定。将接种血平板纯培养24 h的菌,在塑料管中加入3 mL 0.85% NaCl盐水,挑取少量纯菌,用比浊仪测定浊度,调节菌悬液浓度在0.50麦氏单位,将菌悬液滴入鉴定卡,36 ℃培养24 h,观察结果。
1.5.3 VITEK 2 Compact细菌全自动微生物鉴定系统。根据革兰氏染色结果选用VITEK GNI阴性菌鉴定卡,将接种血平板纯培养24 h的菌,在塑料管中加入3mL 0.45% NaCl盐水,挑取少量纯菌,用比浊仪测定浊度,调节菌悬液浓度在0.50~0.63麦氏单位,插入鉴定卡,VITEK2 Compact细菌全自动鉴定系统进行鉴定。
1.6 细菌16sRNA基因序列分析
根据文献[16]介绍的反应体系和反应条件进行16sRNA基因的PCR扩增检测,回收目的片段,连接PMD19-T载体,将菌液送上海生工测序,最后在NCBI进行Blast比对。同时在NCBI下载多个已公布的16srRNA基因序列进行相似性比较,用MEGA5.2软件采用邻接法(neighbor-joining,NJ)构建系统进化树。
1.7 细菌NDM-1表型及耐药基因blaNDM-1检测
根据细菌NDM-1表型检测试剂盒说明书进行所分离细菌的NDM-1表型检测,同时根据文献[17]
介绍的反应体系和反应条件进行分离菌株blaNDM-1基因检测。
2 结果
2.1 细菌形态及培养特征
该菌在显微镜下观察,为革兰阴性杆菌,两端钝圆,无芽孢,无荚膜。在EMB和SS琼脂平板上均形成湿润、凸起、半透明中心暗色的光滑菌落(图1A、B) ;在血琼脂平板上形成中等大小、湿润凸起、无蔓延生长的灰白色菌落(图1C);在XLD上形成湿润、凸起、半透明无暗色中心的光滑菌落(图1D)。
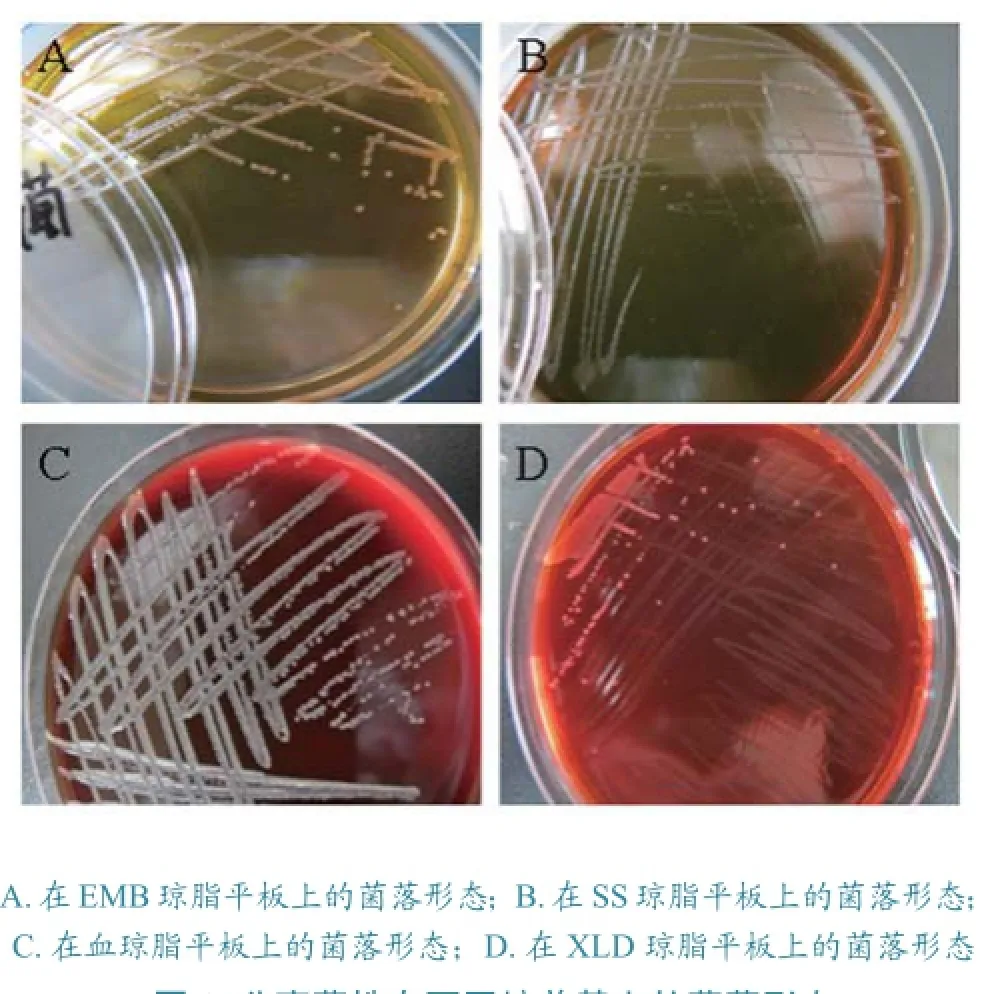
图1 分离菌株在不同培养基上的菌落形态
2.2 细菌生化鉴定结果
初步生化鉴定该菌为革兰阴性杆菌,在三糖铁斜面产碱,底层产酸,无产气,无动力,氧化酶阴性,触酶阳性,还原硝酸盐为亚硝酸盐,苯丙氨酸脱羧酶试验阳性。根据API 20E生化分析结果和VITEK2 Compact阴性菌鉴定卡结果,所分离细菌鉴定为雷氏普罗威登斯菌。
2.3 16srRNA基因序列分析
以菌株HBA13的基因组DNA为模板,16sr-RNA通用引物进行PCR扩增,最终得到长度约为1.5kb的扩增产物。16srRNA基因系统进化树显示(图2),菌株HBA13与Providencia rettgeri 序列相似性最高,同源性为99%。

图2 邻接法构建的普罗威登斯菌系统进化树
综合该菌的生化鉴定结果和16srRNA基因序列分析结果,将所分离菌株HBA13确定为雷氏普罗威登斯菌。
2.4 细菌NDM-1表型及耐药基因blaNDM-1检测
药敏试验结果表明,美罗培南和亚胺培南对该菌的抑菌圈直径分别为27mm和29mm,均大于22mm,说明细菌NDM-1表型初筛为阴性;含有EDTA的复合纸片同不含EDTA的单独纸片抑菌圈直径均为27mm,无明显区别,确认细菌为NDM-1表型阴性;以分离菌株基因组DNA为模板进行PCR扩增,未检测到blaNDM-1286bp特异性片段。结果表明菌株HBA13未携带blaNDM-1耐药基因,所分离到的雷氏普罗威登斯菌为NDM-1表型阴性菌株。
3 讨论
3.1 目前条件性致病菌的污染及其在环境、食品中的存在状况越来越受到重视。雷氏普罗威登斯菌作为条件致病菌,在国内外有关报道中对其来源和感染途径的研究也在逐年增加。本文通过API 20E生化鉴定、VITEK 2 Compact细菌全自动微生物鉴定、药敏试验、16S rRNA 基因序列分析,从美国进口种猪粪拭子中成功分离到一株雷氏普罗威登斯菌。实验结果表明雷氏普罗威登斯菌对营养要求不高,在SS琼脂和麦康凯琼脂上均生长良好,且具有不发酵乳糖或迟缓发酵乳糖的特性,在其平板上
形成的湿润、凸起、半透明中心暗色光滑菌落。这明显区分于发酵乳糖的大肠埃希氏菌属。该菌与其它常见肠杆菌科的区别是,变形杆菌属产硫化氢而该菌属不产生硫化氢,摩根菌属不产生鸟氨酸脱羧酶而该菌属鸟氨酸脱羧酶阳性。该菌属间的鉴别要点是雷氏普罗威登斯菌脲酶和阿拉伯醇阳性;斯氏普罗威登斯菌海藻糖阳性;产碱普罗威登斯菌半乳糖阴性;拉氏普罗威登斯菌枸橼酸盐阴性。
3.2 目前的流行病学调查表明,源自印度、巴基斯坦的blaNDM-1超级细菌,在短短数月内,随着人口流动就已经蔓延至欧洲、美洲、大洋洲。目前发现携带blaNDM-1耐药基因的雷氏普罗威登斯菌在墨西哥、巴西、以色列、中国等国家均有报道[12-15]。qnrD是一种发现于上世纪90年代的编码喹诺酮类抗性基因。Thomas Guillard等[18]分离到两株雷氏普罗威登斯菌,均携带能够编码qnrD基因的大小为2863bp的质粒。这些数据都表明,雷氏普罗威登斯菌在细菌耐药性,特别是多重耐药性以及在细菌间耐药性传播方面具有重要意义。
目前国内外对雷氏普罗威登斯菌的研究主要集中在人类及动物临床样本、污水处理厂、船舶压仓水等方面,对该菌在食物中存在情况的研究较少,也没有在食品原材料及加工环节污染该菌的报道,同时尚未发现相对明确的动物宿主和食源性载体。鉴于雷氏普罗威登斯菌在引起人类及动物致病,以及其易产生多重耐药性的特点,开展该菌在食品领域的存在情况调研具有十分重要的公共卫生学意义。
[1] Shima A,Hinenoya A,Asakura M,et al. Prevalence of Providencia Strains among Children with Diarrhea in Japan [J]. Jpn J Infect Dis,2012,65(6):545-547.
[2]中华人民共和国卫生部.人间传染的病原微生物名录[Z].北京:中华人民共和国卫生部. 2006-01-11.
[3] Yong D,Toleman M A,Giske C G,et al. Characterization of a new metallo-beta-lactamase gene,bla ( NDM-1 ),and a novel erythromycin esterase gene carried on a unique genetic structure in Klebsiella pneumoniae sequence type 14 from India [J]. Antimicrob Agents Chemothe,2009,53(12):5046-5054.
[4]占文斌,周丽,陈章群,等.一种新的对虾病原菌-雷氏普罗威登斯菌[J].中国水产科学,1997,4(1):39-44.
[5]章根华.一起雷氏普罗威登斯菌引起的食物中毒调查[J].上海预防医学杂志,2005,17 (3):128-128.
[6]汪鹏.昆山口岸首次检出雷氏普罗威登斯菌[N].昆山日报. 2010-08-26.
[7]王建峰,劳华均,孙萍,等.外来船舶压舱水中雷氏普罗威登菌的分离鉴定[J].畜牧与兽医,2012,44(10):110-111.
[8]蒋莹.感染性腹泻临床与病原学分布特点及耐药分析[J]北京医学,2012,34(9):824-827.
[9]Martinez TK,Fajardo A,Garmendia L,et al. A global view of antibiotic resistance[J]. FEMS Microbiol Rev,2009,33(1):44-65.
[10]Kycko A. Effect of triclosan on the formation of crystalline biofilms by mixed communities of urinary tract pathogens on urinary catheters [J]. J Med Microbiol,2008,57(9):1135-1140.
[11] Marathe N P,Regina V R,Walujkar S A,et al. A Treatment Plant Receiving Waste Water from Multiple Bulk Drug Manufacturers Is a Reservoir for Highly Multi-Drug Resistant Integron-Bearing Bacteria[J]. PLoS One,2013,8(10)e77310.
[12]Barrios H. Detection of a NDM-1-producing Klebsiella pneumoniae (ST22) Clinical Isolate at a Pediatric Hospital in Mexico [J]. Pediatr Infect Dis,2014,33(3):335-339.
[13]Carvalho-Assef A P,Pereira P S,Albano R M,et al. Isolation of NDM-producing Providencia rettgeri in Brazil[J]. J Antimicrob Chemother,68(12):2956-2957.
[14] Gefen-Halevi S,Hindiyeh M Y,Ben-David D,et al. Isolation of Genetically Unrelated blaNDM-1Positive Providencia rettgeri Strains in Israel [J]. J Clin Microbiol,2013,51(5):1642-1643.
[15]夏淑,肖书念,张琴,等. 碳青霉烯类耐药雷氏普罗威登斯菌的出现及其耐药机制研究[J]. 第三军医大学学报,2013,35(23):2508-2512.
[16] William G W,Susan M B,Dale A P. 16S Ribosomal DNA Amplification for Phylogenetic Study[J]. J Bacteriol. 1991,173(2):697-703.
[17] Yan C,Zhihui Z,Yan J,et al. Emergence of NDM-1-producing Acinetobacter baumannii in China [J]. J Antimicrob Chemother,2011,66(6):1255 -1259.
[18] Guillard T,Cambau E,Neuwirth C,et al. Description of a 2,683-Base-Pair Plasmid Containing qnrD in Two Providencia rettgeri Isolates[J]. Antimicrob Agents and Chemother,2012,56(1):565-568.
Isolation and Identif cation of blaNDM-1-Negative Providencia rettgeri from Pigs
Wang Jianchang,Jiang Yanfen,Wang Jinfeng,Chen Zhimin,Li Jing
(Inspection and Quarantine Center,Hebei Entry-Exit Inspection and Quarantine Bureau,Shijiazhuang,Hebei 050051)
To investigate the zoonotic pathogen-carrying situation of pigs imported from the United States,120 fresh
Providencia rettgeri;isolation;identification;blaNDM-1gene
S851.34
B
1005-944X(2015)04-0022-04
质检公益性行业科研专项项目(201210128);河北局自主科研项目(HE2013K030)
feces samples were taken from pigs imported from the United States for common bacterial pathogen isolation. One Providencia strain was isolated,named as HBA13. By means of different selective media culture,biochemical tests and homology analysis based on bacteria 16sRNA,HBA13 was identified to be Providencia rettgeri. Considering the importance of Providencia rettgeri in the drug resistance,the NDM-1 phenotype assay was made and the blaNDM-1gene was detected by PCR,resulting in blaNDM-1gene negative. The successful isolation of blaNDM-1negative Providencia rettgeri provided the basis for future research.

