“余量思维法”思考化学问题更全面
张洪

所谓“余量思维法”是指:根据已知的因果关系,某几种原因能引起某种结果M,但实际观察中发现这几种原因却引起了更复杂的结果(M+N),在结果M+N中,逐步排除各个原因引起的各个结果,最后剩下结果N,然后再从剩余的结果N中去寻找产生这部分结果的原因N′,这种寻求因果关系的逻辑方法叫剩余法。它是“求同、求异”因果推理的补充,在科学的发现中有过重要的作用。
同样在中学化学问题的解决中有其独到的作用,现举例说明如下。
例1已知:硫氰[(SCN)2]为拟卤素,性质与卤素单质相似,其阴离子(SCN-)的性质与卤素离子相似。现将氯化铁与硫氰化钾混合生成血红色的溶液一分为三,并分别作如下操作:
(1)通入二氧化硫气体;
(2)加入酸性高锰酸钾溶液;
(3)加入氟化钾固体。
结果溶液颜色都褪去。试解释褪色的原因。
分析我们知道溶液呈血红色是因为铁离子与硫氰根离子结合生成了红色的硫氰化铁的缘故,且该反应是可逆反应。若反应朝着硫氰化铁解离的方向进行,则溶液颜色会变浅;当铁离子或硫氰根离子不存在或很少时溶液会变成无色或呈铁离子的棕黄色。同时我们也了解到铁离子具有氧化性,硫氰根离子具有还原性(拟卤素其离子与卤素离子性质相似)。
因此,通入二氧化硫气体和加入酸性高锰酸钾溶液使血红色褪色的原因,可作如下解释:二氧化硫具有还原性能还原铁离子转化为亚铁离子,使化学平衡向硫氰化铁解离的方向进行,导致红色褪去;高锰酸钾具有强氧化性氧化硫氰根离子,同样也使化学平衡向硫氰化铁解离的方向进行,导致红色褪去。
那么,氟化钾既没有氧化性也没有还原性,它不可能通过氧化还原的方法使红色褪去,这说明加入氟化钾固体使其褪色有新的原因。我们运用剩余思维方法分析,其原因只能从氯化铁与硫氰化钾反应的实质去推理。硫氰化铁是铁离子与硫氰根离子通过配位键形成的复杂离子,而氟离子与硫氰根离子性质相似,故氟离子也能与铁离子以配位键的形式形成复杂离子,从而使红色褪去。
图1
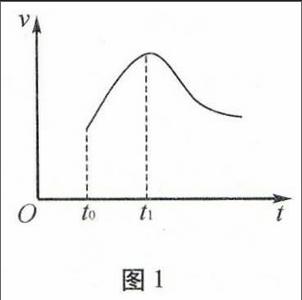
例2将某草酸稀溶液与酸性高锰酸钾溶液混合,反应结果有无色体气从溶液中逸出,同时测得溶液的温度在反应过程中变化不大。根据气体逸出的速率与时间的关系记录(图1)。
(1)请解释 速率与时间的关系,引起的主要原因。
(2)设计实验证明你的解释。
分析影响反应速率的外界因素有浓度、温度、压强和催化剂等,引起化学反应速率加快的主要原因有:
①提高反应物的浓度;
②升高反应体系的温度;
③增大有气体物质参加的反应体系的压强;
④使用催化剂;
⑤改变固体颗粒的大小等。
对于敞开容器而言可忽略压强对反应速率的影响;反应中溶液的温度变化不大,说明温度不是引起反应速率加快的原因;而反应开始时反应物浓度最大,故反应开始时反应速率相对于整个反应过程而言应该最大。事实上反应在t0~t1时间内反应速率由慢变快,按剩余思维方法分析,说明在反应过程中产生了引起速率变化的新原因。
从影响化学反应速率的因素出发,我们已经排除了压强、温度对反应的影响,剩下的可能原因只有催化剂了,即设想可能是反应中某一生成物催化了反应,是不是这样呢?我们可以设计如下对比实验加以检验。
实验:取两个大小相等的试管,各加入约10 mL的原草酸稀溶液与酸性高锰酸钾溶液的混合物,其中一个试管中再加入1 mL的蒸馏水,另一个试管中加入1 mL的上述反应后的溶液,观察两试管中产生气体的快慢或溶液褪色的快慢。
若后一试管中产生气体快或褪色快,则说明上述设想的结果正确,反之则另有原因。
例3 次磷酸H3PO2是一种强还原剂,将它加入CuSO4水溶液,加热到40℃~50℃,析出一种红棕色的难溶物A。经鉴定:反应后的溶液是磷酸和硫酸的混合物;X射线衍射证实A是一种六方晶体,结构类同于纤维锌矿(ZnS),组成稳定;A的主要化学性质如下:
①温度超过60℃,分解成金属铜和一种气体;
②在氯气中着火;
③与盐酸反应放出气体。
回答如下问题:
1. 写出A的化学式。
2. 写出A的生成反应方程式。
3. 写出A与氯气反应的化学方程式。
4. 写出A与盐酸反应的化学方程式。
分析整个试题围绕着A是什么物质展开设问。
将题中A物质的有关信息融合如下:
AH3PO2+CuSO4(+H2O)→
A+H2SO4+H3PO4
是红棕色难溶物
具有ZnS型的组成,即1∶1型化合物
加热分解得到Cu和一种气体,可见
A中有Cu
与氯气反应,是一种氧化还原反应
与盐酸反应放出气体,这种气体一定是
A中另一组成元素产生的
据此,首先可以把A写成CuX。X是什么?这是本题的难点。根据质量守恒推理X只可能是S,P,O,H元素。
依据物质的性质及化合价规律,运用剩余推理的方法显然唯有CuH才能与其他信息对应。
所以A是CuH。至此其余的问题可迎刃而解。
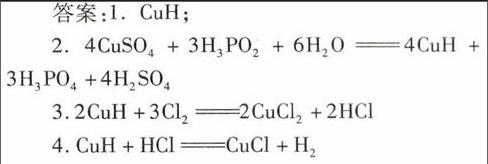
答案:1. CuH;
2. 4CuSO4+3H3PO2+6H2O4CuH+3H3PO4+4H2SO4
3.2CuH+3Cl22CuCl2+2HCl
4.CuH+HClCuCl+H2
以上三个例题让我们可领略了“余量思维法”在解决化学问题中的作用,它使我们思考化学问题更全面到位。因此,解决化学问题要打开思维面,具体得法,“余量思维法”为我们解决化学问题提供了新的金钥匙。
(收稿日期:2015-07-12)

