催化剂改变组分的化学组成----三谈催化剂改变化学平衡
贺传正
(沈阳大学,辽宁沈阳 110044)
催化剂改变组分的化学组成----三谈催化剂改变化学平衡
贺传正
(沈阳大学,辽宁沈阳110044)
摘要:催化剂改变组分的化学组成,因而改变化学平衡.反应完成后,催化剂不能完全回复到原来的化学组成.表观活化能不能判断体系的状态.
关键词:催化剂; 化学平衡; 组分; 表观活化能; 化学组成
文献[1-3]认为:催化剂参与化学反应,可以降低反应活化能,加快反应速率,不改变平衡常数,不改变化学平衡;反应完成后,催化剂完全回复到原来的化学组成.
本文认为:催化剂参与化学反应,可以改变反应机理,降低反应活化能,加快反应速率,改变组分的化学组成,改变化学平衡,不改变平衡常数;反应完成后,催化剂不能完全回复到原来的化学组成.
1 催化剂改变化学组成
1.1催化反应是连串反应
物质A和物质B的基元反应
中,平衡常数为
与催化剂D的连串反应
中,平衡常数为
AD再与B反应:
平衡常数为
因此,催化剂改变了反应机理,把一个简单反应变成连串反应.连串反应的每一步反应的活化能都低于基元反应的活化能,使连串反应速率大于基元反应速率.连串反应和基元反应是平行反应,总反应速率是二者的反应速率之和.因为基元反应速率很小,通常说的催化反应速率是指连串反应速率,而不是基元反应速率.降低反应活化能,是指连串反应的表观活化能低于基元反应的活化能,基元反应的活化能在催化反应中并未改变.所以,催化反应降低了基元反应速率,而不是提高了基元反应速率.
例如,在没有催化剂参与时,合成氨反应[4]
的活化能很高,其值在温度为298K时是254kJ·mol-1.采用铁催化剂时,合成氨反应分为如下几步进行:
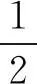
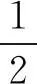


其中,步骤(1)的活化能最高,其值为146kJ·mo1-1;步骤(2)~步骤(4)的活化能较小.可见,催化剂铁改变了合成氨反应的机理,每一步反应的活化能都比合成氨基元反应的活化能低.在温度为298K时,催化反应表观速率常数 k2与基元反应速率常数 k1的比值为 8×1018,并且可近似认为,在该温度时,催化反应速率是基元反应速率的 8×1018倍,即基元反应速率小得可忽略不计.
1.2催化剂改变化学组成
A物质和B物质的基元反应,以及它们与催化剂D的连串反应,都是可逆反应,否则就无所谓化学平衡了.因为如果反应完成后,催化剂D完全回复到原来的化学组成,那么AD和B的反应是不可逆反应,完全反应后,AD和B全部转化成AB和D,它们之间就不存在化学平衡了.同理,A与D的反应也只能是不可逆反应, 反应完全后,A和D都转化为产物AD,这一步反应也无化学平衡可言.于是,连串反应的最终结果是,A和B完全反应,生成AB,它们之间的化学平衡也消失了. 若果真如此, 反应完成后,虽然催化剂完全回复到原来的化学组成,但是化学平衡却也不复存在了.这与催化剂不改变化学平衡也不改变平衡常数的观点自相矛盾.所以,在催化反应体系中,含有催化剂D的组分,除了物质D外,还有物质AD,即反应完成后,催化剂没有完全回复到原来的化学组成D.
例如,NO和Cl2的气相反应[5]
在有Br2作为催化剂时,其反应为:


反应完成后,化学组成中含有溴元素的物质除了Br2外,还有 NOBr,即溴元素没有完全回复到原来的化学组成Br2的状态.文献[6]中所谈到的KI催化Ce(SO4)2氧化H3AsO3的实验,在化学计量点时,碘的分析浓度为1×10-3mol·L-1, I2的浓度为1×10-5.50mol·L-1, 即有0.6%的碘没有回复到催化剂 I-的状态.
如果反应完成后,催化剂完全回复到原来的化学组成,即在反应过程中催化剂的始态和终态相同,催化剂的自由能没有改变,从始态到终态催化剂的自由能变化全微分的封闭积分为 0,即∮dG=0,这又和催化反应的过程是自发的相矛盾,即有悖于热力学第二定律.
综上所述,催化剂参与化学反应,改变了化学性质,反应完成后,没有完全回复到原来的化学组成.
2 催化剂改变化学平衡
2.1催化剂改变组分的化学组成
在仅有A物质和B物质的基元反应体系中,有A组分的化学组成是A和AB.在催化反应体系中,有A组分的化学组成除了A和AB外,还有AD.所以,催化反应改变了A组分的化学组成.
例如,在没有催化剂 Br2参与的NO和Cl2反应的体系中,组成中含有氮元素的物质是NO和NOCl;在有Br2参与的反应体系中,组成中含有氮元素的物质除了NO和NOCl 外,还有NO与Br2反应生成的NOBr,催化剂Br2改变了NO的化学组成.
2.2催化剂改变化学平衡
若以[A′]表示A物质和AD物质的平衡浓度之和,即
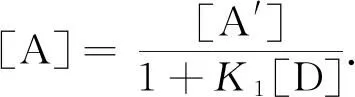
A和B反应的平衡常数为
若以K′表示条件平衡常数,即
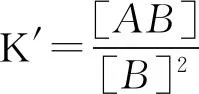
所以,由于催化剂改变了A组分的化学组成,从而改变了A与B反应的平衡状态.当催化剂的浓度很小时,1+K1[D]≈1,K′≈K,可认为催化剂不改变化学平衡.通常,催化剂的加入量很小,体系平衡状态的变化不会明显.当1+K1[D]≈K1[D]时,由文献[7]可知
催化剂对平衡状态的影响就明显了.还以文献[6]所提到的实验为例. 因为I-与Ce4+反应的平衡常数很大,KCe·I=1027.46,说明I-对Ce4+和H3AsO3反应的平衡状态改变显著, 以至在化学计量点时, 把Ce4+的浓度从非催化体系的10-12.72mol·L-1下降到催化体系的10-16.48mol·L-1. 这是催化剂I-改变了Ce4+的化学组成的结果.
由此还可知,改变化学平衡的途径,除了采取改变反应的温度、组分的浓度和体系的压强等物理方法外,还可以采取改变组分化学组成的化学方法.而且,后者是最常采用的方法.
改变组分化学组成的方法有生成沉淀、生成挥发性气体和生成配合物,以及改变组分的价态和利用酸效应等.
总而言之,催化反应改变了组分的化学组成,是催化剂改变化学平衡的根本原因.
3 表观活化能不能判断平衡状态
3.1催化剂不改变基元反应平衡常数
根据多重平衡原理,催化连串反应的分步反应平衡常数之积,等于基元反应平衡常数,即
当然,温度不变,平衡常数是不会改变的.但是,平衡常数不改变,平衡状态还是可以改变的.
3.2表观活化能不能判断平衡状态
催化连串反应的表观活化能低于A和B的基元反应的活化能,其实是相当于把A和B的正反应活化能和逆反应活化能都降低了相同的值,也就是相当于把A和B的正反应速率常数和逆反应速率常数都扩大了相同的倍数, 并且二者的比值仍等于A与B的基元反应的平衡常数K,也等于连串反应的正反应表观速率常数与逆反应表观速率常数之比.但是,速率常数的比值不变,不能说明基元反应速率的比值也不变.因为反应速率除了与速率常数有关外,还与反应组分的浓度有关,而反应组分的浓度又随着组分的化学组成的改变而改变.所以,活化能的降低,并不相当于把基元反应的正反应速率和逆反应速率都以相同的倍数增加,并从中得出催化剂不改变基元反应的化学平衡的结论.
文献[8]普遍地把物质A与物质B的基元反应
在有催化剂K参与时的催化反应表示成
催化反应的正反应速率为
催化反应的逆反应速率为
式中,k1、k2、k3为速率常数,k+、k-为表观速率常数.在平衡状态时
因此,可以认为催化反应不改变基元反应的平衡常数.其实,催化反应中反应物A的浓度与它在仅有基元反应中的浓度是不相同的.因为在仅有基元反应中,含有A组分的物质是物质A和物质AB;而在催化反应中,含有A组分的物质除此之外,还有催化剂K与物质A生成的物质AK. 如果以[A′]表示物质A与物质AK的平衡浓度之和,即
那么
显然,此处的r+与前者不是同一数值.在平衡状态时
式中,K′为条件平衡常数.可见,催化反应的正反应速率和逆反应速率并不是把基元反应的正反应速率和逆反应速率以相同倍数扩大的结果,并且不能认为催化反应不改变基元反应的平衡常数就不改变基元反应的平衡状态,也不能根据多重平衡原理,把催化反应平衡式加和的结果误认为反应完成后催化剂完全回复到原来的化学组成,更不能因此把催化反应的步骤看成体系变化过程的途径,从而认为催化反应体系的始态和终态与非催化反应体系的相同.
所以,活化能的降低只能说明催化剂参与了反应,改变了反应机理,加快了反应速率,但不能用活化能的改变来判断体系平衡状态的变化.
4 结 论
催化剂改变组分的化学组成,从而改变化学平衡.反应完成后,催化剂不能完全回复到原来的化学组成.
参考文献:
[1]程兰征,章燕豪,林青松. 物理化学[M]. 2版. 上海:上海科学技术出版社, 1998:259-262.
(ChengLanzheng,ZhangYanhao,LinQingsong.PhysicalChemistry[M]. 2nded.Shanghai:ShanghaiScienceandTechnologyPress, 1998:259-262.)
[2]穆尔. 基础物理化学[M]. 黄丽鹏,林基兴,译. 台北:晓园出版社;北京:世界图书出版公司北京公司, 1983:349-350.
(MooreWJ.BasicPhysicalChemistry[M].HuangLipeng,LinJixing,Translation.Taipei:HsiaoYuanPublicationCo.,Ltd.;Beijing:TheWorldBookPublishingCompany, 1983:349-350.)
[3]袁翰青,应礼文. 化学重要史实[M]. 北京:人民教育出版社, 1989:308-312.
(YuanHanqing,YingLiwen.ImportantHistoricalFactsofChemistry[M].Beijing:People’sEducationPress, 1989:308-312.)
[4]浙江大学普通化学教研组. 普通化学[M]. 北京:高等教育出版社, 1990:99-100.
(GeneralChemistryEducationalResearchGroupofZhejiangUniversity.GeneralChemistry[M].Beijing:HigherEducationPress, 1990:99-100.)
[5]南京大学物理化学教研组. 物理化学[M]. 北京:人民教育出版社, 1961:633-634.
(PhysicalChemistryEducationalResearchGroupofNanjingUniversity.PhysicalChemistry[M].Beijing:People’sEducationPress, 1961:633-634.)
[6]贺传正. 再谈催化剂改变化学平衡[J]. 沈阳大学学报:自然科学版, 2014,26(2):109-112.
(HeChuanzheng.OnChangeofChemicalEquilibriumCausedbyCatalyst[J].JournalofShenyangUniversity:NaturalScience, 2014,26(2):109-112.)
[7]贺传正. 共存组分参与的反应的平衡处理[J]. 沈阳大学学报, 2000,12(4):28-31.
(HeChuanzheng.BalanceTreatmentoftheReactionwithCoexistingComponent[J].JournalofShenyangUniversity, 2000,12(4):28-31.)
[8]沈文霞. 物理化学[M]. 北京:科学出版社, 2004:238-241.
【责任编辑:李艳】

(ShenWenxia.PhysicalChemistry[M].Beijing:SciencePress, 2004:238-241.)
OnChangeofChemicalEquilibriumCausedbyCatalyst(Ⅲ):ChangingofComponent’sChemicalCompositionCausedbyCatalyst
He Chuanzheng
(ShenyangUniversity,Shenyang110044,China)
Abstract:The chemical composition of component could be changed by catalyst, thus the chemical balanceis changed. After completion of the reaction, the catalyst cannot fully return to its original chemical composition. The apparent activation energy cannot determine the state of the system.
Key words:catalyst; chemical equilibrium; component; apparent activation energy; chemical composition
作者简介:贺传正(1940-),男,山东牟平人,沈阳大学副教授.
收稿日期:2014-11-30
文章编号:2095-5456(2015)03-0193-04
中图分类号:O643.3
文献标志码:A

