脾多肽注射液联合化疗对晚期胃癌免疫功能和临床疗效的影响
张艳芳,牛春莲
河南省安阳市肿瘤医院肿瘤内科,河南安阳 455000
近年来,胃癌发病率逐年上升,并且已跃居消化道肿瘤死因的首位[1]。大多数患者就诊时已属晚期,化疗成为主要治疗方法,但化疗造成的免疫功能下降及骨髓抑制往往限制临床的治疗。脾多肽注射液是由健康小牛脾脏提取物制成的多肽,临床观察其可以提高机体免疫力,减少化疗带来的不良反应,提高患者的抵抗力。该研究旨在考察脾多肽注射液对于晚期胃癌化疗后免疫细胞及各类细胞因子、化疗毒副作用的改善情况,探讨脾多肽在化疗辅助中的作用,现报道如下。
1 资料与方法
1.1 一般资料
随机选取该院2014年8月—2014年10月收治的60例胃癌住院患者临床资料,均经病理学检测或穿刺细胞学证实,按UICC 胃癌分期标准进行分期,Karnofsky 评分>60 分,入选时经检测至少一个可测肿块,且>2 cm,预计生存期> 3 个月。无主要器官功能障碍,血常规及肝肾功能、心功能基本正常。所有患者随机分为脾多肽组30例和对照组30例。脾多肽组30例,其中男18例,女12例;年龄38~76 岁,中位年龄53 岁;肝转移14例,肺转移6例,腹膜转移4例,卵巢转移1例,骨转移3例,淋巴结转移2例;KPS 评分60~80 分者9例,80~ 100 分者21例。对照组30例,其中男14例,女16例,年龄34~70 岁,中位年龄51岁,肝转移11例,肺转移7例,腹膜转移5例,骨转移3例,淋巴结转移4例;KPS 评分60~80 分者12例,80~100 分者18例。两组在性别、年龄、病情、KPS 评分差异无统计学意义(P>0.05),具有可比性。
1.2 治疗方法
两组患者给予PFC(紫杉醇+顺铂+5-FU)方案化疗:紫杉醇135 mg/m2第1 天,顺铂25 mg/m2,第1~3 天;5-FU 750 mg/d,第1~5 d,每3 周重复,实验组在化疗同时,静脉滴注脾多肽注射液(吉林丰生制药有限公司生产),10 mL/次,加500 mL 生理盐水或葡萄糖液,1 次/d,连用7 d,化疗2 周期,两组患者常规给予止吐治疗,治疗结束后1 个月复查评价疗效。
1.3 疗效评定
1.3.1 近期疗效 依据RESIST 标准评定治疗效果,分完全缓解CR、部分缓解PR、疾病稳定SD、疾病进展PD,有效率= (CR+PR)/总例数×100%。
1.3.2 免疫功能判定 两组均于第1 周期化疗前1 d 及化疗结束后1 个月采集空腹静脉血5 mL: 一份用流式细胞仪定量检测CD3+、CD4+、CD8+和NK 细胞的变化; 一份静置离心取血清,以ELISA法检测IFN-γ 、IL-2、IL-6 水平。
1.3.3 不良反应判定 比较II 度以上白细胞、血小板减少及恶心、呕吐、发热、腹泻等毒副反应。
1.4 统计方法
采用SPSS 19.0 软件进行统计学分析,计量资料符合正态分布,组间比较采用t 检验,两组率的比较采用χ2检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 近期疗效
两组患者近期有效率分别为46.67% vs 36.67%,差异无统计学意义(χ2=0.617 P>0.05),见表1。
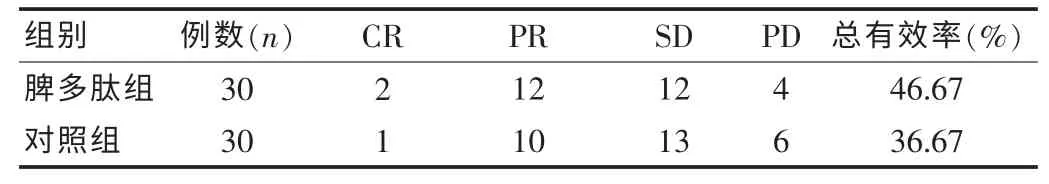
表1 两组患者近期有效率的比较
2.2 免疫功能指标
两组化疗前免疫指标无统计学差异(P>0.05);脾多肽组化疗后各项免疫细胞较化疗前有所升高,CD3、CD4 及NK 细胞差异有统计学意义(P<0.05),CD8 化疗后水平比较化疗前升高,但差异无统计学意义(P>0.05)。对照组化疗后免疫细胞水平较化疗前减少,差异有统计学意义,见表2。
脾多肽组化疗后IL-2、IFN-γ 较化疗前表达水平升高,IL-6表达水平下降(P<0.05);对照组化疗后IL-2、IFN-γ、IL-6 较化疗前表达水平下降,变化比较差异有统计学意义(P<0.05);两组化疗后水平比较有统计学意义(P<0.05),见表3。
表2 两组患者化疗前后免疫功能指标比较(±s)
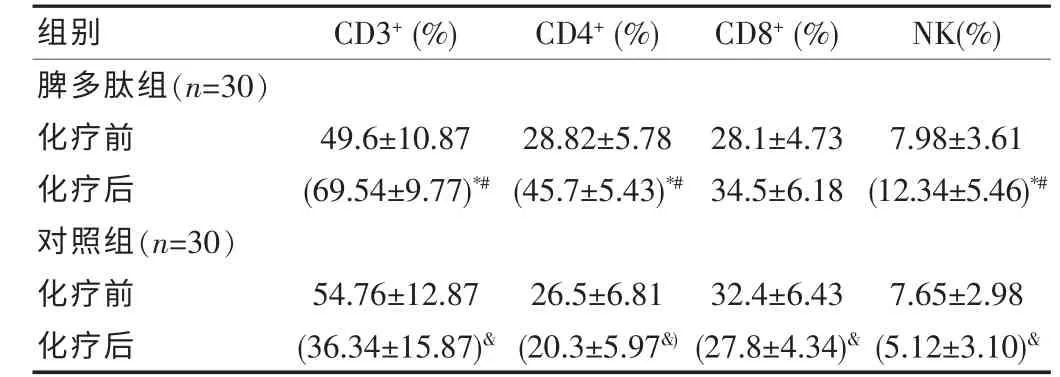
表2 两组患者化疗前后免疫功能指标比较(±s)
注:&*P<0.05 同组内化疗前后比较,#P<0.05 与对照组化疗后比较。
脾多肽组(n=30)化疗前化疗后对照组(n=30)化疗前化疗后组别49.6±10.87(69.54±9.77)*#54.76±12.87(36.34±15.87)&CD3+(%)28.82±5.78(45.7±5.43)*#26.5±6.81(20.3±5.97&)CD4+(%)28.1±4.73 34.5±6.18 32.4±6.43(27.8±4.34)&7.98±3.61(12.34±5.46)*#7.65±2.98(5.12±3.10)&CD8+(%) NK(%)
表3 不同组别患者血清中细胞因子水平的比较(ng/L,±s)
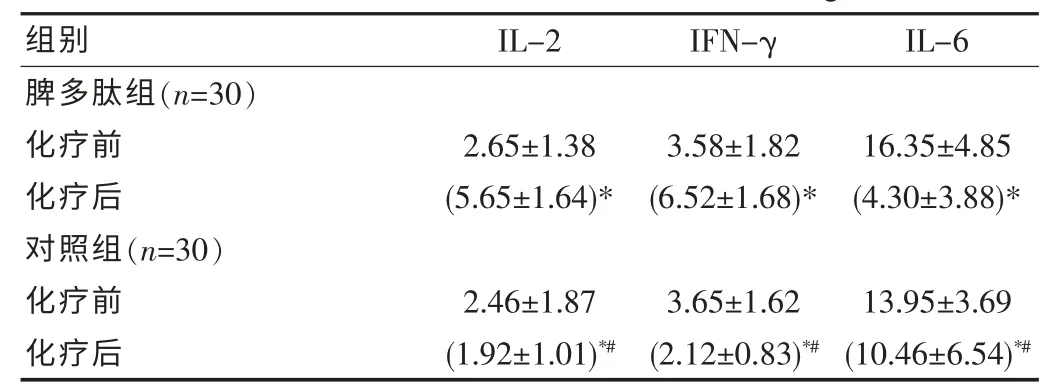
表3 不同组别患者血清中细胞因子水平的比较(ng/L,±s)
注:*P<0.05 与同组内化疗前比较,#P<0.05 与脾多肽组化疗后比较。
脾多肽组(n=30)化疗前化疗后对照组(n=30)化疗前化疗后组别2.65±1.38(5.65±1.64)*2.46±1.87(1.92±1.01)*#IL-2 3.58±1.82(6.52±1.68)*3.65±1.62(2.12±0.83)*#16.35±4.85(4.30±3.88)*13.95±3.69(10.46±6.54)*#IFN-γ IL-6
2.2 毒副反应
脾多肽组发生II 度以上骨髓抑制者4例,给予粒细胞集落刺激因子后 (200 ug/d)3 d 恢复,对照组II 度以上骨髓抑制者11例,给予粒细胞集落刺激因子后(200 ug/d)5~6 d 恢复,两组差异有统计学意义(χ2=4.356,P=0.037);恶心、呕吐、腹泻等消化道反应两组发生率无明显差异。
3 讨论
晚期胃癌大多数采用紫杉类为基础的两药或三药联合化疗,化疗药物在杀伤癌细胞同时,淋巴细胞也会不同程度下降,削弱了免疫反应,在一定程度上促进了肿瘤的进展;同时由于化疗药物导致的骨髓抑制,耐受力差,依从性差。因此,临床上采用化疗联合免疫调节剂的减毒增效方法越来越受到关注。脾多肽分子量小,稳定性好,可以直接作用于细胞水平和分子水平,双向多靶点免疫调节,整体提高机体免疫力,临床应用广泛[2-3]。该研究结果显示,对照组化疗后T 细胞亚群CD3、CD4 及NK、CD8均较化疗前降低,差异有统计学意义,说明了机体在化疗后处于一种免疫低下状态,与其它报道一致[4]。联合治疗组中化疗后CD3、CD4 及NK、CD8 细胞较化疗前有升高,差异有统计学意义,进一步验证了脾多肽能改善机体免疫功能,与张铁报道一致。联合治疗组化疗后骨髓抑制发生率低于对照组(4/30 vs 11/30,P<0.05),提示脾多肽可以减轻化疗副反应,进一步提高耐受性。
研究表明,脾多肽可增强巨噬细胞吞噬功能及NK 细胞的细胞毒活性,促进细胞因子分泌,促进T 淋巴细胞增殖和活性。因此,我们试图从细胞因子进一步验证脾多肽的功能。研究发现,恶性肿瘤患者体内IL-2 水平低下,限制了免疫细胞的增殖和活化,造成免疫逃逸。IL-2 不仅能够激活CTL 细胞及NK 细胞,同时能诱导其他细胞产生IFN-γ、TNF 等细胞因子,同NK 细胞等协同发挥抗肿瘤效应。目前在肾癌[5]、黑色素瘤[6]、膀胱癌[7]等多种肿瘤治疗中取得较好疗效。本实验中,对照组化疗后IL-2、IFN-γ水平降低,联合脾多肽治疗后,患者IL-2、IFN-γ 较化疗前水平升高,利于机体发挥抗瘤作用。IL-6 是连接慢性炎症和肿瘤的关键因子,也被称为促癌因子。近年来研究结果表明,胃癌患者血清、癌组织中IL-6 水平较健康人群高,且与胃癌的进展、转移密切相关,可作为判断预后的指标之一[8],机制可能是通过其受体偶联蛋白gp130 激活下游STAT3 信号通路,使得Cyclin-D、CDC25A、Pim1、BCL-2、survivin、MMP、VEGF、CCL 等 表 达 升 高,促进肿瘤的发生、发展及转移[9]。两组患者给予化疗药物后IL-6水平下降,但脾多肽组下降更明显,提示脾多肽可通过降低机体IL-6 水平,进一步抑制肿瘤生长,改善患者预后。两组患者近期有效率虽有差异(46.67%vs 36.67%),但无统计学意义,原因可能在于观察时间短所致,远期疗效有待进一步随访。
综上所述,化疗联合脾多肽能治疗胃癌,能增强机体的免疫功能,降低骨髓抑制的发生,并可辅助杀伤癌细胞,具有减毒增效作用。
[1]Jem al A, Bray F, Center M M ,et al.Global cancer statistics [J].CACancer JC lin, 2011, 61( 2) : 69-90.
[2]张铁. 脾多肽联合卡培他滨/多西紫杉醇治疗蒽环类失败复发的转移性乳腺癌疗效观察[J].中国基层医药,2011,18(5):624-626.
[3]伍国胜,宿永康,马兵,等.脾多肽对油船烧伤患者免疫调节作用的临床观察[J].中华航海医学与高气压医学杂志,2013,20(5) :312-320.
[4]徐红,毛一香,张学光,等.晚期消化道肿瘤患者化疗前后T 细胞亚群的变化[J].癌症,2008,27(4):418-424
[5]Akaza H,Tsukamoto T,Fujioka T,et al.Combined immunotherapy with low-dose IL-2 plus IFN-alpha for metastatic renal cell carcinoma: survival benefit for selected patients with lung metastasis and serum sodium level[J].Clin Oncol, 2011, 41(8):1023-1030.
[6]Quan WD Jr,Quan FM,Perez M,et al.Outpatient intravenous interleukin-2 with famotidine has activity in metastatic melanoma[J].Cancer Biother Radiopharm, 2012, 27(7):442-445.
[7]Zhang X, Shi X,Li J,et al.Novel immunotherapy for metastatic bladder cancer using vaccine of human interleukin-2 surfacemodified MB 49 cells[J].Urology, 2011, 78(3):722.
[8]Wang Z, Si X, Xu A, et al.Activation of STAT3 in human gastric cancer cells via interleukin (IL)-6-type cytokine signaling correlates with clinical implications[J].PLoS One, 2013,8(10):e75788.
[9]Teng J, Wang X, Xu Z, et al.HBx-dependent activation of Twist mediates STAT3 control of epithelium-mesenchymal transition of liver cells.J Cell Biochem, 2013, 114(5): 1097-1104

