硒化纹党参多糖和其抗A549细胞的活性
陈文霞, 张 培, 高 霞, 白瑞斌, 胡芳弟
(兰州大学药学院,甘肃兰州730000)
硒化纹党参多糖和其抗A549细胞的活性
陈文霞, 张 培, 高 霞, 白瑞斌, 胡芳弟*
(兰州大学药学院,甘肃兰州730000)
目的 合成硒化纹党参多糖并探讨其抗人肺腺癌细胞A549的活性。方法 以HNO3-Na2SeO3方法硒化纹党参多糖,在单因素试验的基础上,以反应时间、反应温度、纹党参多糖与亚硒酸钠投料比为三因素进行L9(34)正交试验设计,选择硒化纹党参多糖含硒量、产率以及对A549细胞生长的抑制率作为考察指标,优选最佳硒化工艺。结果纹党参多糖的最佳硒化条件为反应时间5 h,反应温度60℃,投料比1:1。在此条件下,硒化纹党参多糖中含硒量可达1.07mg/g(RSD为3.7%),产率可达50.3%(RSD为2.5%),对A549细胞的抑制率可达到49.36%(RSD为2.8%)。结论 硒化纹党参多糖可以作为抗肿瘤候选药物。
纹党参多糖;硒化;正交试验设计;人肺腺癌细胞A549
硒作为人体必需的微量元素之一,有多种免疫与生物学功能,尤其是它具有预防心血管病、抗肿瘤、抗病毒性疾病以及抗衰老等作用[1]。因此,含硒药物和添加剂等材料成为当今许多科研人员的研究热点。有机硒化合物具有吸收率高、生物活性强、毒性低、环境污染小等特点,已成为硒研究的一个方向[2]。目前,国内外在人工合成有机硒化合物方面进行了探索,合成得到了硒化亚油酸、硒化亚麻酸、硒化卡拉胶、硒化蛋氨酸、肌醇硒酸酯、硒化葡聚糖、硒化茶多酚等有机硒化合物,并对其抑制肿瘤的作用进行了初步的研究[3]。因此,利用有潜力的生物活性成分和无机硒制备具有抑制
肿瘤等作用的有机硒化合物具有很大的研究意义。
党参为桔梗科植物党参Godonopsis pilosula(Franch.)Nannf.,素花党参G.pilosula Nannf. var.modesta(Nannf.)L.T.Shen或川党参G.tangshen Oliv.的干燥根,为我国传统的补益药[4]。纹党参主产于甘肃文县,是党参中的上品,其主要品种为素花党参[5-6]。纹党参中糖类的含有量普遍较高[7-8],且可使正常小鼠脾质量增加,胸腺质量减轻,并能逆转地塞米松所致免疫受抑小鼠的脾质量减轻[9-10]。
以硒多糖作为补硒剂不仅具有合适的稳定性和溶出性能,而且释放出硒后配体多糖不会对身体产生毒副作用,还能促进金属离子的吸收和利用[11]。研究证实,硒多糖的药理活性普遍高于多糖或硒[12]且更容易被机体利用[13-15]。但是除了富硒地区植物中提取的硒多糖量较高外,天然多糖中含硒量极少,远不能达到补硒要求。因此,采用人工合成的方法对多糖进行硒化修饰为解决以上问题的途径之一。
本实验以纹党参为原料,提取纹党参多糖(polysaccharides from G.pilosula,PCP),并通过正交设计方法,对党参多糖硒化合成工艺进行优化。将具有抗癌作用的微量元素硒与活性党参多糖有机地结合起来,形成硒化纹党参多糖(polysaccharides from G.pilosula selenide,PCPs),以期获得既具有强抗肿瘤作用且具有补硒作用的药物。
1 实验部分
1.1 材料与试剂 纹党参采自甘肃文县,经过兰州大学药学院周印所教授鉴定,为素花党参G.pilosula Nannf.var.modesta(Nannf.)L.T.Shen的干燥根。按文献方法提取[16],党参药材粉碎至约60目,加95%乙醇脱脂2 h,残渣加9倍量体积的水煎煮3次,每次2 h,合并滤液,加入乙醇使得醇体积分数达到75%,放置过夜,离心取沉淀,将沉淀部分冷冻干燥得纹党参粗多糖(CPP)。
硒粉、亚硒酸钠 (天津市化学仪器研究所)、硝酸 (优级纯)、盐酸 (优级纯)、过氧化氢(30%、优级纯)。MTT(Amresco Co,美国)、胰酶(Trypsin 0.25%Solution)、DMEM、新生胎牛血清 (上海创赛)。
人肺腺癌细胞A549、人胃腺癌细胞BGC-823,人宫颈癌细胞HeLa以及人肝癌细胞HepG2由兰州大学基础医学院提供。细胞培养在含有10%胎牛血清,1%双抗的完全培养基中,环境温度37℃,湿度95%,含5%CO2。
1.2 仪器与设备 DF-101集热式恒温加热磁力搅拌器(郑州长城科工有限公司)、Bio-Rad酶标仪(美国Bio-Rad公司)、GI54TR高压灭菌锅(厦门致微仪器有限公司)、SW-CJ-1D型超净工作台(苏州苏泰净化设备工程有限公司)、Memmert型二氧化碳培养箱 (北京五洲东方科技发展有限公司)、AFS-9800原子荧光光度计 (北京科创海光仪器有限公司)、WX-8000型微波消解系统 (上海屹尧仪器科技发展有限公司)、UV-1700紫外分光光度计 (日本岛津公司)、旋转蒸发仪 (Eyela,日本东京理化)、恒温水浴箱 (上海一恒仪器有限公司)、冷冻干燥机 (美国Labconco公司)、电子自动分析天平(德国Sartorius公司)、恒温电热板(北京科伟永兴仪器有限公司)。
1.3 方法
1.3.1 单因素试验 影响硒化多糖的含硒量及产率的因素很多,包括反应温度、加Na2SeO3的量、反应时间、BaCl2添加量和HNO3的百分含有量等。硒化反应过程如下:称取100 mg纹党参多糖于三口烧瓶中,缓慢滴加稀HNO320 mL,边加边搅拌,使之完全溶解,加入一定量BaCl2,加Na2SeO30.08 g于70℃下搅拌反应7 h,反应液冷却后过滤,无水Na2CO3调pH为5~6,加入适量Na2SO3除Ba2+,离心,上清液浓缩后,流水透析2 d,蒸馏水透析1 d,透析液冷冻干燥,得硒化纹党参多糖(PCPs)。
1.3.1.1 BaCl2添加量对多糖硒化过程影响 硝酸百分含量固定为0.8%,考察加入不同量BaCl2(0、0.1、0.125、0.15、0.175 g)对反应所得的硒化多糖的得率及含硒量的影响。
1.3.1.2 HNO3的百分含量对多糖硒化过程的影响 BaCl2的加入量固定为0.1 g,考察加入20 mL不同百分含量的HNO3(0%、0.5%、0.8%、1.0%、1.5%,0%的硝酸以双蒸水代替)对反应所得硒化多糖的得率及含硒量的影响。
1.3.2 正交试验 因在硒化反应中温度,反应时间以及Na2SeO3的加入量对硒化多糖的产率和含硒量影响较大[17],在单因素试验的基础上将反应时间 (A),反应温度 (B),投料质量比例 (C)为三因素进行L9(34)正交试验设计优化条件,因素水平见表1。按“1.3.1”项方法反应得到9个硒化纹党参多糖,命名为“PCPs1~PCPs9”,试验结果以含硒量、硒化多糖产率以及硒化多糖对A549细胞的抑制率作为评价指标。

表1 正交设计试验因素水平Tab.1 Factor IeveIs of orthogonaIdesign test
1.3.3 硒化纹党参多糖中含硒量的测定 称取2 mg硒化纹党参多糖于聚四氟乙烯管中,加入5 mL浓HNO3和1 mL 30%的H2O2,微波消解,消解程序如下:120℃下1 min,150℃下3 min,200℃下5 min,消化结束后,冷却至室温。转移溶液至锥形瓶中,并用电热板加热至干,及时加入5 mL浓HCl,当溶液变清澈并伴有白烟时,转移至25 mL量瓶,并用含5%HCl的蒸馏水定容到25 mL进原子荧光光度计测定。
1.4 硒化纹党参多糖的抗肿瘤试验 取处于对数生长期的肺腺癌细胞A549,用胰酶消化,吹打均匀,调细胞密度为5×104个/mL,接种于96孔培养板。每孔100μL,培养至贴壁后加入100μL用无血清培养基配制的CPP和CPPs,使其终质量浓度为25、50、100、200μg/m L,设4个平行孔。调零孔不加细胞悬液,不加药,只加培养液200μL,对照孔不加药,只加100μL细胞悬液和100μL培养液,置37℃、5%CO2条件下培养24 h后每孔加入5 mg/mL的MTT 20μL,同样条件下继续培养4 h,终止培养。每孔加入150μL DMSO,震荡10 min,酶标仪检测吸光值。选择测定波长570 nm,按下面公式计算细胞生长抑制率。

1.5 验证试验 按照上述实验中得到的最佳条件平行制备硒化纹党参3份,计算硒化纹党参的产量和含硒量。硒化纹党参的抗肿瘤活性通过其对肺癌A549细胞,胃癌BGC-823,宫颈癌HeLa细胞和肝癌HepG2细胞的生长抑制率来验证。细胞培养和抑制率测定方法同 “1.4”项,以相应质量浓度的纹党参多糖作为对照。
2 结果与讨论
2.1 单因素试验 如图1所示,当硝酸体积分数为0.8%固定不变,氯化钡为0.1 g时,硒化纹党参多糖的产率和含硒量都达到了峰值,氯化钡超过0.1 g后产率和含硒量开始下降。当BaCl2用量为0.1 g固定不变时,硒化纹党参多糖产率和含硒量在HNO3体积分数为1.0%时达到最大值。因此,当党参多糖量为100 mg时,选择BaCl2加入量和HNO3的体积分数分别为0.1 g、1.0%。
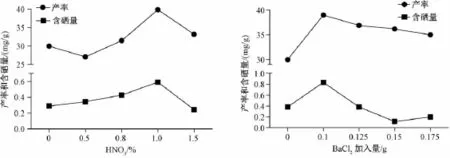
图1 硒化纹党参多糖的单因素试验Fig.1 SingIe factor test for PCPs
2.2 正交试验 表2为正交试验所得到的9个硒化纹党参多糖产率和含硒量,以及硒化纹党参多糖在200μg/m L时对A549细胞的抑制率。由结果可知,各因素对硒化多糖含硒量影响的主次顺序为B>A>C,即反应温度>反应时间>投料比,各因素的最佳水平为A3B1C3,最佳硒化条件为反应时间9.0 h,反应温度为60℃,投料比为2:2,此时最大含硒量为1.23 mg/g。各因素对硒化纹党参多糖产率影响的主次顺序为C>B>A,即投料比>反应温度>反应时间,各因素的最佳水平A2B1C3,即最佳硒化条件为反应时间7.0 h,反应温度为60℃,投料比为2:2。各因素引起的硒化多糖对A549肿瘤细胞的影响主次顺序为C>B>A,即投料比>反应温度>反应时间,各因素的最佳水平A1B1C3,即最佳硒化条件反应时间5.0 h,反应温度为60℃,投料比为2:2。正交试验结果
表明,反应温度60℃,投料比2:2为影响硒化纹 党参多糖含硒量、产率以及抑制率的最佳条件。

表2 正交设计试验结果Tab.2 Resu It of or thogonaIdesign test
2.3 方差分析 表3~表5为硒化纹党参多糖含硒量、产率以及硒化纹党参多糖在200μg/mL时对A549细胞抑制率的方差分析。由表3可知,反应温度对硒化纹党参多糖含硒量有显著影响,反应时间和投料比影响不显著。由表4可知,投料比对硒多糖产率有显著影响,反应时间和反应温度影响不显著。由表5可知,反应温度和投料比对硒化多糖的抗肿瘤活性影响极显著,反应时间影响显著。由于反应时间对含硒量和产率均无显著影响,而对肿瘤细胞抑制率具有显著性影响,选择反应时间适中的5 h。综合考虑含硒量和硒多糖产率以及硒化多糖的抗肿瘤活性三个指标的正交试验和方差分析结果,选择反应温度和投料比三者一致的60℃、2:2,确定最佳组合为反应时间5 h,反应温度60℃,投料比2:2。
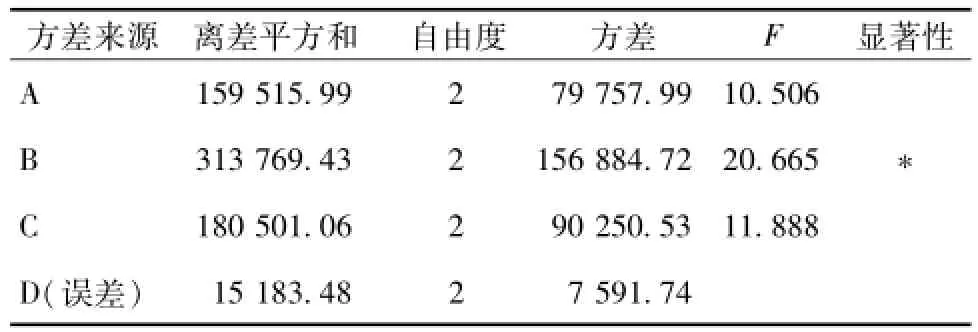
表3 含硒量的方差分析Tab.3 ANOVA of seIenium content

表4 产率的方差分析Tab.4 ANOVA of yieId

表5 对A549细胞抑制率的方差分析Tab.5 ANOVA of A549 ceIIs inhibition
2.4 纹党参多糖及硒化纹党参多糖的抗肿瘤活性比较 如图2所示,纹党参多糖经硒化反应后,对A549细胞的抑制率较未硒化多糖均有不同程度的增加。正交试验所得到的 9个硒化多糖在200 μg/mL剂量时,对A549细胞的抑制率与未硒化多糖相比,除了PCPs2和PCPs9之外均有显著性差异,硒化后可提高纹党参多糖对A549细胞的抑制活性。

图2 正交设计硒化多糖对A549细胞生长的影响Fig.2 Effects of PCPs on A549 ceIIs grow th
2.5 验证试验 取100 mg纹党参多糖,在正交试验所得优化条件下进行硒化反应,3次平行实验,求得在此条件下硒化纹党参多糖的含硒量为1.07 mg/g(RSD为3.7%),产率为50.3% (RSD为2.5%)。
为了验证硒化纹党参多糖对肿瘤细胞生长的影响,将200μg/mL的硒化纹党参多糖作用于不同的癌细胞 (人肺腺癌细胞A549、人宫颈癌细胞HeLa、人胃腺癌细胞BGC-823和人肝癌细胞HepG2细胞)24 h后发现,相同剂量下硒化纹党参多糖比纹党参多糖抗肿瘤作用更强,结果见图3。硒化纹党参多糖和纹党参多糖对A549细胞的抑制率分别为49.36%和15.36%,对BGC-823细胞的抑制率分别为33.2%和24.34%,对HeLa细胞的抑制率分别为40.32%和20.21%,对HepG2细胞的抑制率分别为35.09%和19.3%,硒化纹党参多糖和纹党参多糖的抗肿瘤活性的差异可能是由于它们的含硒量差异造成的。此发现表明,纹党参多糖经硒化修饰后可提高多糖的抗肿瘤活性。
3 结论
硒多糖比单独的无机硒及多糖具有更显著的生物活性,在医药研制和疾病治疗等方面都有广泛的应用前景[17]。多糖硒化方法较多,如氧化吡啶法、硝酸-亚硒酸钠(HNO3-Na2SeO3)和乙酸-亚硒酸钠方法,HNO3-Na2SeO3因反应条件简单、硒化效率高而成为多糖硒化常用方法[18]。
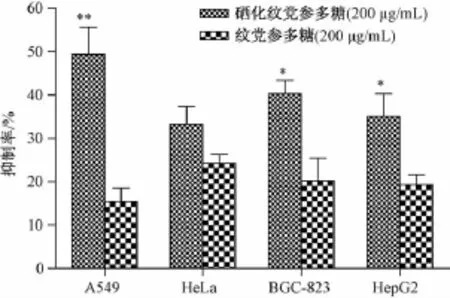
图3 硒化纹党参多糖和纹党参多糖对不同癌细胞的生长抑制率Fig.3 Inhibition rates of PCPs and PCP on different cancer ceIIs
纹党参作为党参中的佼佼者[5],多糖是其主要的活性成分,表现出一定的提高免疫及抗肿瘤活性[19]。本研究以合成具有较高抗肿瘤活性的党参硒多糖为主要目标,以甘肃产纹党参中提取出的多糖为原料,采用HNO3-Na2SeO3方法合成硒化纹党参多糖,以产率、硒多糖中含硒量及硒多糖抗肿瘤活性为指标,通过单因素试验和正交试验设计探讨纹党参多糖硒化的最佳条件,研究发现,影响硒化反应的关键因素是反应温度、多糖与Na2SeO3比率,反应时间影响较小。硒化纹党参多糖较未硒化纹党参多糖具有较高的肿瘤生长抑制率,提示硒化纹党参多糖可以作为抗肿瘤候选药物。该研究为纹党参的开发利用提供了思路。
硒多糖的抗肿瘤作用可能与促进癌细胞分化和抑制其分裂有关,一方面硒多糖能调控癌细胞增殖和分裂癌基因的表达,使癌细胞行为向正常转化,另一方面硒多糖可抑制与细胞癌变密切相关的蛋白激酶C的活性,从而有效抑制癌细胞内蛋白质合成,DNA复制及癌细胞的生长等多种途径抑制肿瘤细胞活性[20]。有关硒化纹党参多糖抗肿瘤活性机制有待进一步研究。
[1] Rayman M P.The importance of selenium to human health[J]. Lancet,2000,356(9225):233-241.
[2] Chen W X,Chen JY,Wu H M,et al.Optimization of selenylation conditions for a pectic polysaccharide and its structural characteristic[J].Int JBiol Macromol,2014,69:244-251.
[3] 王永伟,向纪明.有机硒化合物的合成研究进展[J].广州化工,2012,40(5):25-30.
[4] Wakana D,Kawahara N,Goda Y.Three new triterpenylesters,codonopilates A-C,isolated from Godonopsispilosula[J].JNat Med,2011,65(1):18-23.
[5] 邵际兴.党参佼佼者-纹党[J].植物杂志,1989,26(1):23.
[6] 昌 吉.文党小考[J].甘肃物产,1986,33(2):45.
[7] Heidrun N,Heidrun W.New constituents from Godonopsis pilosula[J].Planta Med,1994,60(5):494.
[8] Luo H,Lin S,Ren F,et al.Antioxidant and antimicrobial capacity of Chinese medicinal herb extracts in raw sheep meat[J].J Food Protect,2007,70(6):1440-1445.
[9] 张兆林,兰中芬,王凤连,等.党参多糖成分及其免疫药理作用研究[J].兰州医学院学报,1986,45(3):14-15.
[10] 张汝学,王凤连.甘肃产党参多糖成分对小鼠体液免疫及白细胞介素2产生的影响[J].兰州医学院学报,1993,19(1):14-16.
[11] 单金媛,王秀梅,丁 良,等.中草药中硒的生物功能及测定方法研究进展[J].中草药,2003,38(3):280-283.
[12] 黄 峙,郑文杰,郭宝江.含硒生物大分子化合物研究进展[J].海南大学学报:自然科学版,2001,19(2):169-175.
[13] Staaf M,Yang Z N,Huttunen E,et al.Structural elucidation of the viscous exopolysaccharide produced by Lactobacillus helveticus Lb161[J].Garbohydr Res,2000,326(2):113-119.
[14] Mierach J,Techimedbglshir M,Barlocher F,etal.Heavymetals and thiol compounds in mucor racenosus and Articulospora tetracladia[J].Mycol Res,2001,105(7):883-889.
[15] Xu C L,Wang Y Z,Jin M L,etal.Preparation,characterization and immunomodulatory activity of selenium-enriched exopolysaccharide produced by bacterium Enterobacter cloacae Z0206[J].Bioresourc Technol,2009,100(6):2095-2097.
[16] Yang CX,Gou Y Q,Chen JY,etal.Structural characterization and antitumor activity of a pectic polysaccharide from Godonopsis pilosula[J].Garbohydr Polym,2013,98(1):886-895.
[17] Qin T,Chen J,Wang D,et al.Optimization of selenylation conditions for Chinese angelica polysaccharide based on immune-enhancing activity[J].Garbohydr Polym,2013,92(1):645-650.
[18] 和朝军,李景原,秦广雍,等.灵芝硒多糖的研究进展[J].河南农业科学,2006(3):9-11.
[19] 王惠艳,韩美君,金四立,等.党参多糖对小鼠细胞免疫调节作用[J].中国药理学通报,1989,5(6):376-379.
[20] 崔 乔,尚德静,邹 霞.硒化合物的抗癌作用[J].中国生化药物杂志,2004,25(4):247-249.
SeIenyIation of poIysaccharides from Codonopsis pilosula and its inhibition against A549 ceIIs
CHENWen-xia, ZHANG Pei, GAO Xia, BAIRui-bin, HU Fang-di*
(School of Pharmacy,Lanzhou University,Lanzhou 730000,Ghina)
AIM To synthesize polysaccharides from Godonopsis pilosula selenide(PCPs)and to explore its anti-tumor activity againsthuman lung adenocarcinoma A549 cells.METHODS PCPswere synthesized by nitric acid-sodium selenide.Based on the single factor experiment,reactive parameters(reaction time,reaction temperature and the ratio of polysaccharide to Na2SeO3)were investigated and optimized by L9(34)orthogonal experimental design in terms of the selenite content,yield and the agent’s inhibitory rate on A549 cells.RESULTS 5 h of reaction time,60℃of reaction temperature and 1:1 ratio of polysaccharide to Na2SeO3were the optimal selenylation conditions.Under the optimal conditions,themean selenium content,yield and inhibitory rate on tumor cell of prepared PCPs reached 1.07 mg/g(RSD=3.7%),50.3%(RSD=2.5%)and 49.36%(RSD=2.8%),respectively.CONCLUSION PCPsmay be a promising antitumor agent.
polysaccharides from Godonopsis pilosula;selenylation;orthogonal experimental design;human lung adenocarcinoma A549 cells
R284.2
A
1001-1528(2015)11-2408-06
10.3969/j.issn.1001-1528.2015.11.015
2015-01-05
兰州市科技计划项目 (2013-4-75,2012-2-67)
陈文霞 (1987—),女,硕士生,主要从事植物多糖硒化工艺研究。E-mail:cwx198712@163.com
*通信作者:胡芳弟 (1971—),女,教授,硕士生导师,主要从事中药成分分离分析及中药新药研究。Tel:(0931)8915686,E-mail:hufd@lzu.edu.cn

