水生植物对沉积物微生物群落功能多样性的影响
赵良元,陶晶祥,刘 敏
(长江科学院a.流域水环境研究所;b.流域水资源与生态环境科学湖北省重点实验室,武汉 430010)
1 研究背景
根际环境是指植物根周围几微米到几毫米的微观界面,是植物根系-环境-根际微生物相互作用的场所[1-2]。植物根系可为微生物提供大量繁殖的附着环境,根际释放的氧气可提高微生物的新陈代谢[3-4],根系向外界环境(土壤、水体、沉积物)中分泌根系分泌物可为根际微生物提供丰富的营养及碳源,不同的根系分泌物又会产生不同的根际微生物群落结构[5]。因此,在植物根际环境中有着较为丰富的微生物数量,较强的微生物活力以及与非根际环境相比显著差异的微生物群落结构[2,4]。
以植物根际微生物降解为主要机制的植物修复技术以其绿色、原位、可持续的修复特点成为近年来环境修复领域的热点技术[6]。目前,大量研究报道了有机污染土壤或沉积物植物修复过程中根际微生物发挥的重要作用,如在多环芳烃、石油类污染物、多氯联苯等有机污染物的修复过程中,修复植物根际微生物数量及活力提高了数倍至数十倍,根际效应明显[7-9]。同时,植物可改变土壤或沉积物中的微生物群落结构,使得可以降解有机污染物的特定微生物类群大量繁殖。因此,研究植物根际微生物群落多样性对于揭示植物根际效应机制尤为重要。
目前,关于微生物群落多样性研究多集中在有机及无机污染物对土壤微生物群落结构的影响方面[10-11],而关于植物修复过程中微生物的研究主要集中在微生物数量及活力研究[6-9],对于有机及无机污染土壤/沉积物的植物修复过程中植物对土壤或沉积物微生物群落多样性的研究较少。本试验采用可用于分析整个微生物群落、表征微生物群落的功能潜力的方法——Biolog分析技术[12],以挺水植物菖蒲(Acorus calamus L.)为对象,研究了水生植物对沉积物微生物群落功能多样性的影响,为揭示水生植物对水环境沉积物的根际效应机制提供一定的科学依据。
2 材料与方法
2.1 试验材料
本试验所用沉积物采自本地湖泊,为砂质沉积物。水生植物为野外湖泊采回并驯化后的菖蒲(Acorus calamus L.),选取15~30 cm的幼株作为试供植物。试验所使用的仪器为美国Biolog公司生产的GEN III MicroStation自动快速微生物鉴定系统,微生物碳源测定板为Biolog Eco板(生态板)。
2.2 根际效应试验
沉积物经预风干、研磨、过筛后,选取0.3~0.5 mm的粒度沉积物作为试验用沉积物,定量称取15 kg试验用沉积物至水生植物培养箱内(0.5 m×0.4 m ×0.6 m),加入自来水后放置 3~4 d,待沉积物有一定的硬度后再将初始株高一致(约30 cm)的菖蒲移栽入试验的培养箱中,每个培养箱中种植10株。本试验设置2种处理:非根际沉积物不栽培菖蒲;根际沉积物栽培水生植物菖蒲,每种处理设置3个平行。水生植物栽培时间为90 d,从2014年7月开始至2014年10月结束,在水生植物栽培期间,维持培养箱中水层高于沉积物层3~5 cm[13]。菖蒲栽培过程中生长良好。栽培试验结束后取非根际及菖蒲根际沉积物,将各处理的3个平行样品混合后进行微生物群落多样性分析。
2.3 微生物碳源测定板碳源的分类
试验使用美国Biolog公司生产的Biolog-Eco测试板,Eco板上一共分布96个孔,测试板上除了不含任何碳源的对照(水)以外,共31种碳源,每一种碳源有3个平行[14]。Biolog-Eco除对照以外的碳源孔中含有1种碳源和四氮唑蓝,当微生物利用Eco板碳源进行生长呼吸可将四氮唑蓝从无色还原成紫色,颜色深浅代表微生物对这种碳源的利用程度高低[15]。通过测定各板孔的吸光值及其变化来反映微生物群落代谢功能的多样性[12]。
2.4 微生物群落对碳源代谢的测定
取水生植物根际及非根际新鲜沉积物约10 g,放入含90 mL灭菌生理盐水的三角瓶中,在于空气浴恒温振荡器振荡30 min(25℃,200 rpm),静置15 min,取上清液稀释到1/10浓度,稀释液经3 500 rpm离心去除残留的沉积物后(尽量减少沉积物原有碳源干扰),吸取150μL上清液接入Biolog-Eco板中25℃下恒温培养6 d,分别在24,48,72,96,120,144 h,用Biolog微生物鉴定系统在波长为750 nm 及 590 nm 下测定吸光值[16-17]。
2.5 沉积物微生物群落多样性计算
微生物群落功能多样性指数计算公式参照文献[18-20]:
(1)沉积物微生物群落总活性(AWCD)计算公式为AWCD=Σ(Ci-R)/n。
(2)丰富度指数S为每孔中(C-R)的值大于0.25的孔个数。
(3)Shannon-Wiener指数 H'=-Σ(Pi·log Pi)。
(4)Simpson指数D=1-ΣPi2。
(5)Pielou均匀度指数E=H'/ln S。
其中,Ci为31个碳源孔的吸光值;R为对照孔的吸光值;n为31;Pi为有培养基的孔和对照孔的光密度值差与整板总差的比值,即Pi=(Ci-R)/Σ(Ci-R);S为被利用的碳源总数。
2.6 数据统计分析
使用数据统计分析软件 SPSS v16.0及Graph-Pad Prism 5进行绘图及数据统计分析。用单因素方差分析(One-way ANOVA,Tukey’s Multiple Comparison Test)比较各大类碳源之间的差异,t检验比较各处理组与对照之间的差异,p<0.05为差异显著,p<0.01为差异极显著[13],文中所有数据用 3 个平行的平均值表示。
3 结果与分析
3.1 沉积物微生物总活性
沉积物微生物总活性可用AWCD(Average Well Color Development),即Biolog-Eco测试板孔中溶液吸光值平均变化率表征,是沉积物微生物群落利用单一碳源能力的一个重要指标[21-22]。从图1可以看出,在168 h的培养时间内,根际及非根际微生物活性的总体变化趋势为在前120 h内AWCD逐渐增大,120 h后AWCD缓慢降低。对于非根际来讲,其AWCD在开始的24 h变化不大(p>0.05),而在第24~72 h内快速升高,在随后的96~120 h内快速升高,然后缓慢降低(120~144 h)。根际AWCD表现出了0~48 h内快速升高,48~120 h内变化速度明显减慢,随后缓慢降低直到试验结束。以120 h的AWCD值作为衡量微生物活性在根际及非根际环境下的变化情况,根际AWCD较非根际AWCD的变化速度(斜率)和最终AWCD均有较大程度的提高,而根际微生物群落的酶联反应速度和最终能达到的程度,与群落能利用单一碳底物的微生物的数目和种类有关[23]。上述结果说明水生植物的种植可显著提高沉积物中微生物的活力及功能多样性。

图1 168 h内培养过程中的AWCD变化Fig.1 Variation of AWCD in 168 h
3.2 沉积物微生物碳源利用特征
Biolog-Eco板含有31种不同种类的碳源,本文将这些碳源分为糖类、氨基酸类、酸类、醇类、胺类及酯类共6大类,每一大类的碳源数量及种类见表1所示。

表1 Biolog-Eco测试板31种碳源分类Table 1 Classification of 31 carbon sources in Biolog-Eco test plate
图2为非根际及菖蒲根际沉积物微生物对Biolog-Eco板上6大类碳源的利用特征。非根际沉积物微生物对酯类碳源的利用程度最高(54.25%),其次是胺类(15.27%),对氨基酸类及羧酸类的利用程度较低(9.67%及9.93%),对糖类及醇类利用程度最低(6.28% 及4.59%),这说明非根际沉积物中优势微生物是一些以酯类及胺类为主要碳源的微生物。
水生植物菖蒲的种植大大促进了沉积物中微生物的生长,其对6大类碳源的利用程度除了酯类以外,其他5类具有较大幅度的提高,比非根际沉积物微生物对糖类、氨基酸类、羧酸类、醇类及胺类提高了110%~698%。根际沉积物微生物对酯类及糖类的利用程度最高,分别达到22.03% 及20.22%,其次是氨基酸类(16.02%)及 醇 类 (15.96%),对 胺 类(12.93%)及羧酸类(12.82%)的利用程度最低。
以上结果说明,水生植物菖蒲可通过根系向沉积物分泌如碳水化合物、有机酸、氨基酸类等物质,促进能利用这些碳源的微生物大量繁殖,从而使得根际沉积物微生物对这几类碳源的利用程度大大提高,整体提高了根际沉积物微生物的总活性。
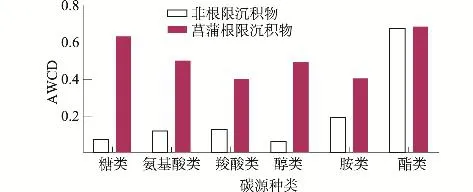
图2 非根际沉积物及菖蒲根际沉积物微生物对6大类碳源的利用程度Fig.2 Relative use efficiency of 6 carbon sources by microbial community in non-rhizosphere sediment and rhizosphere sediment of Acorus calamus L.
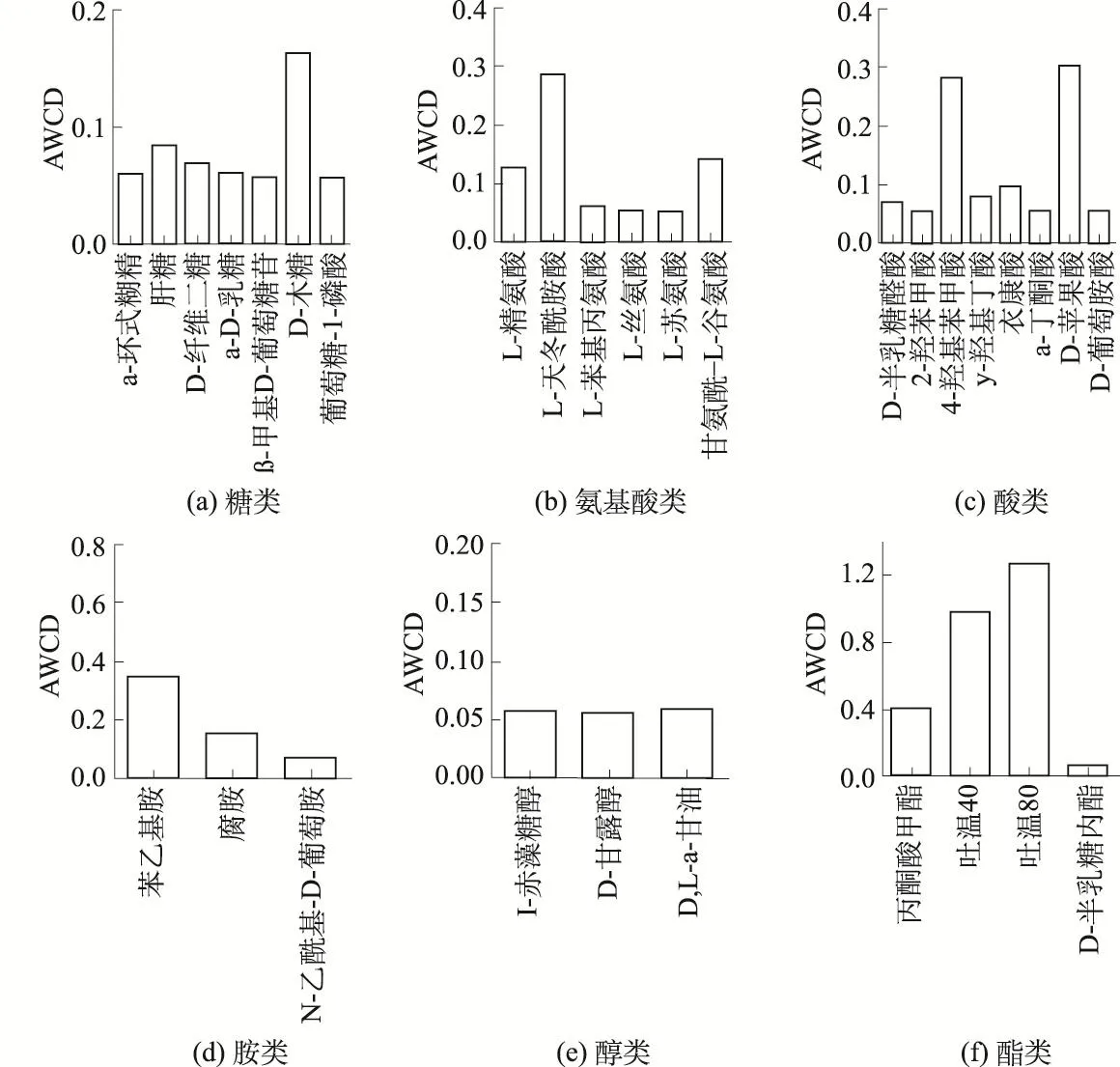
图3 非根际沉积物中微生物对31种碳源的利用情况Fig.3 Relative use efficiency of 31 carbon sources by microbial community in non-rhizosphere sediment
3.3 沉积物微生物对31种碳源的利用情况
从图3及图4可以看出,对于糖类碳源来讲,菖蒲根际沉积物微生物主要利用 D-纤维二糖、a-D-乳糖、β-甲基 D-葡萄糖苷及葡萄糖-1-磷酸,而非根际沉积物对于这些糖类基本不利用,只对a-D-乳糖有较少程度的利用,这说明菖蒲根际可能产生了新的微生物种类[24],这些新的微生物可利用D-纤维二糖、a-D-乳糖、β-甲基D-葡萄糖苷、葡萄糖-1-磷酸作为碳源。
对于氨基酸类碳源来讲,L-天冬酰胺酸、L-精氨酸及甘氨酰-L-谷氨酸对非根际沉积物的贡献最大,但是利用程度不高;菖蒲根际氨基酸类总效应显著提高主要是由L-天冬酰胺酸、L-丝氨酸及甘氨酰-L-谷氨酸这3类碳源引起,这几类碳源利用效率比非根际沉积物提高了4~13倍。
对于酸类碳源来讲,非根际对衣康酸、a-丁酮酸有较少程度的利用,而菖蒲根际则完全没有利用,说明根际对利用衣康酸、a-丁酮酸的微生物产生了抑制。根际的酸类碳源利用主要由D-半乳糖醛酸及D-葡萄胺酸贡献,而这2类碳源在非根际基本没有利用,说明根际有促进该2类羧酸为碳源的微生物生长的作用。
非根际沉积物对苯乙基胺的利用程度最高,而可利用苯乙基胺的微生物在菖蒲根际受到了抑制。根际及非根际对腐胺的利用程度相当,利用程度较低;根际沉积物的胺类利用程度明显高于非根际主要是由 N-乙酰基-D-葡萄胺引起的,其在根际的AWCD达到1.0,而在非根际却没有利用。胺类碳源利用结果说明苯乙基胺及N-乙酰基-D-葡萄胺是造成非根际及根际沉积物利用胺类差异的主要原因。
非根际与根际沉积物微生物对于酯类碳源的利用程度及规律相似,即吐温80>吐温40>丙酮酸甲酯,二者对D-半乳糖内酯基本不利用,这说明可利用D-半乳糖内酯的微生物在根际及非根际均受到抑制。
非根际沉积物对醇类碳源基本不利用,而菖蒲根际对I-赤藻糖醇不利用,对D-甘露醇及D,L-a-甘油的利用程度明显增强,说明菖蒲根际中能利用D-甘露醇及D,L-a-甘油的微生物增加或者是活性明显增强,醇类总效应中根际与非根际的差异主要由D-甘露醇及D,L-a-甘油的利用引起。

图4 菖蒲根际沉积物微生物对31种碳源的利用情况Fig.4 Relative use efficiency of 31 carbon sources by microbial community in rhizosphere sediment of Acorus calamus L.
3.4 沉积物微生物多样性指数比较分析
沉积物微生物群落利用碳源类型的多少可用多样性指数表示[25],不同的微生物多样性指数反映了沉积物微生物群落功能多样性的不同侧面。Shannon指数用于评价群落的丰富度,从表2可以看出,菖蒲的根际环境中存在较为丰富的微生物群落种类,该指标与丰富度指数是相一致的。丰富度指数S则可直观地体现微生物群落种类的多少,根际沉积物中的微生物种类显著高于非根际;Simpson指数反映群落中某些常见种的优势度,根际及非根际沉积物的微生物优势度指数差异不大,这可能和二者中都存在以酯类为主要碳源的微生物类群有关系。Pielou指数是群落物种均一性的度量,菖蒲的根际改变了沉积物中微生物的群落结构从而使得均一性较好。从总体上看,根际沉积物微生物功能多样性处于较高水平,这些指数的大小总体上与2种不同沉积物AWCD是相一致的。
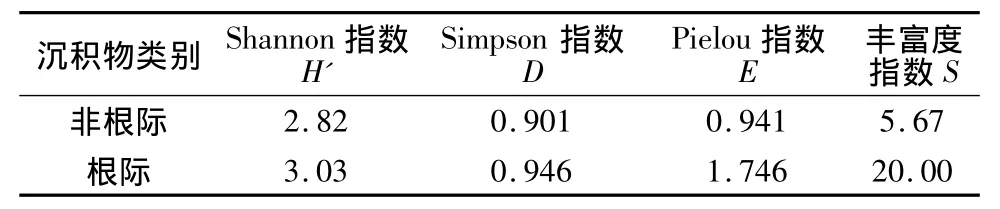
表2 根际及非根际沉积物微生物功能多样性指数Table 2 Functional diversity indices of microbial communities in non-rhizosphere sediment and rhizosphere sediment
4 结论
(1)水生植物菖蒲的种植可显著提高沉积物中微生物的总活性,相比于未种植植物的沉积物,120 h内AWCD的变化速度和最终AWCD值均有较大程度的提高。
(2)糖类、氨基酸类、酸类、醇类、胺类及酯类这6大类碳源中,非根际沉积物微生物对酯类碳源的利用程度最高,其次是胺类,对氨基酸类及羧酸类的利用程度较低,对糖类及醇类利用程度最低;菖蒲根际沉积物微生物对酯类及糖类的利用程度最高,其次是氨基酸类及醇类,对胺类及羧酸类的利用程度最低。
(3)根际及非根际微生物利用的氨基酸类、酸类、醇类、胺类及酯类碳源的总效应由不同的碳源造成,菖蒲根际改变了沉积物原有的微生物群落结构。
(4)菖蒲的种植可显著增加沉积物微生物多样性,表征微生物多样性的Shannon-Wiener指数、丰富度指数及Pielou均匀度指数均要显著高于非根际沉积物。
[1]SMALLA K,SESSITSCH A,HARTMANN A.The Rhizosphere:Soil Compartment Influenced by the Root[J].FEMSMicrobiology Ecology,2006,56(2):165.
[2]WALTER W W.Rhizosphere Processes and Management in Plant-assisted Bioremediation(phytoremediation)of Soils[J].Plant and Soil,2009,321(1/2):385-408.
[3]ABDUL G K.Role of Soil Microbes in the Rhizospheres of Plants Growing on Trace Metal Contaminated Soils in Phytoremediation[J].Journal of Trace Elements in Medicine and Biology,2005,18(4):355-364.
[4]SICILIANOSD,GERMIDA JJ.Mechanisms of Phytoremediation:Biochemical and Ecological Interactions Between Plants and Bacteria[J].Environmental Reviews,1998,6(1):65-79.
[5]罗永清,赵学勇,李美霞.植物根系分泌物生态效应及其影响因素研究综述[J].应用生态学报,2012,23(12):3496-3504.(LUO Yong-qing,ZHAO Xueyong,LI Mei-xia.Ecological Effect of Plant Root Exudates and Related Affecting Factors:A Review[J].Journal of Applied Ecology,2012,23(12):3496- 3504.(in Chinese))
[6]ALKORTA I,GARBISU C.Phytoremediation of Organic Contaminants in Soils[J].Bioresource Technology,2001,79(3):273-276.
[7]PILON-SMITS E.Phytoremediation[J].Annual Review of Plant Biology,2005,56:15-39.
[8]JOHNSON D L,ANDERSON D R,MCGRATH SP.Soil Microbial Response During the Phytoremediation of a PAH Contaminated Soil[J].Soil Biology and Biochemistry,2005,37(12):2334-2336.
[9]KAREN E G,HUANG X D,BERNAERD R G,et al.Phytoremediation and Rhizoremediation of Organic Soil Contaminants:Potential and Challenges[J].Plant Science,2009,176(1):20-30.
[10]YAOH Y ,XU JM,HUANG CY.Substrate Utilization Pattern,Biomass and Activity of Microbial Communities in a Sequence of Heavy Metal-polluted Paddy Soils[J].Geoderma,2003,115(1):139-148.
[11]XIE H J,SHI Y J,ZHANG J,et al.Degradation of Phthalate Esters(PAEs)in Soil and the Effects of PAEs on Soil Microcosm Activity[J].Journal of Chemical Technology and Biotechnology,2010,85(8):1108-1116.
[12]KELA P W,MATTHIAS G,RAYMOND L L.Assessment of Changes in the Microbial Community of Constructed Wetland Mesocosms in Response to Acid Mine Drainage Exposure[J].Water Research,2008,42(1):180-188.
[13]ZHAO L Y,ZHU C,GAO CX,et al.Phytoremediation of Pentachlorophenol-contaminated Sediments by Aquatic Macrophytes[J].Environmental Earth Sciences,2011,64(2):581-588.
[14]KEUN H C,FRED CD.Comparison of Two Kinds of Biolog Microplates(GN and ECO)in Their Ability to Distinguish Among Aquatic Microbial Communities[J].Journal of Microbiological Methods,1999,36(3):203-213.
[15]郝晓晖,胡荣桂,吴金水,等.长期施肥对稻田土壤有机氮,微生物生物量及功能多样性的影响[J].应用生态学报,2010,21(6):1477-1484.(HAO Xiaohui,HU Rong-gui,WU Jin-shui,et al.Effects of Longterm Fertilization on Paddy Soils Organic Nitrogen,Microbial Biomass,and Microbial Functional Diversity[J].Journal of Applied Ecology,2010,21(6):1477-1484.(in Chinese))
[16]彭芳芳,罗学刚,王丽超,等.铀尾矿周边污染土壤微生物群落结构与功能研究[J].农业环境科学学报,2013,32(11):2192-2198.(PENG Fang-fang,LUO Xue-gang,WANG Li-chao,et al.Microbial Community Structure and Function in Soils Around Uranium Tailings[J].Journal of Agro-environment Science,2013,32(11):2192-2198.(in Chinese))
[17]XIE Wen-jun,ZHOU Jian-min,WANG Huo-yan,et al.Short-term Effects of Copper,Cadmium and Cypermethrin on Dehydrogenase Activity and Microbial Functional Diversity in Soils after Long-term Mineral or Organic Fertilization[J].Agriculture,Ecosystems & Environment,2009,129(4):450-456.
[18]WU Xiao-qin,YUAN Wei-min,TIAN Xiao-jing,et al.Specific and Functional Diversity of Endophytic Bacteria from Pine Wood Nematode Bursaphelenchus xylophilus with Different Virulence[J].International Journal of Biological Sciences,2013,9(1):34-44.
[19]HUA F,HAN Y L,YIN Y M,et al.Microbial Response to Repeated Treatments of Manure Containing Sulfadiazine and Chlortetracycline in Soil[J].Journal of Environmental Science and Health,Part B,2014,49(8):609-615.
[20]白爱芹,傅伯杰,曲来叶,等.重度火烧迹地微地形对土壤微生物特性的影响--以坡度和坡向为例[J].生态学报,2013,33(17):5201-5209.(BAI Ai-qin,FU Bo-jie,QU Lai-ye,et al.The Study of Characteristics of Soil Microbial Communities at High Severity Burned Forest Sites for the Great Xingan Mountains:An Example of Slope and Aspect[J].Acta Ecologica Sinica,2013,33(17):5201-5209.(in Chinese))
[21]WANG Xiang,WANG Qun-hui,WANG Shi-jie,et al.Effect of Biostimulation on Community Level Physiological Profiles of Microorganisms in Field-scale Biopiles Composed of Aged Oil Sludge[J].Bioresource Technology,2012,111:308-315.
[22]罗 倩,黄宝灵,唐治喜,等.新疆盐渍土3种植被类型土壤微生物碳源利用[J].应用与环境生物学报,2013,19(1):96- 104.(LUO Qian,HUANG Baoling,TANG Zhi-xi,et al.Carbon Source Utilization of Microbes in Saline Soil of Three Vegetation Types in Xinjiang,China[J].Chinese Journal of Applied& Environmental Biology,2013,19(1):96-104.(in Chinese))
[23]JAY L G,AARON L M.Classification and Characterization of Heterotrophic Microbial Communities on the Basis of Patterns of Community-level Sole-carbon-source Utilization[J]. Applied and Environmental Microbiology,1991,57(8):2351-2359.
[24]倪才英,曾 珩,黄玉源,等.紫云英根际微生物碳源利用多样性研究[J].广西植物,2009,29(5):614-620.(NI Cai-ying,ZENG Heng,HUANG Yu-yuan,et al.Functional Diversity of Microbial Community in Bulk and Rhizosphere Soil of Astragalus sinicus[J].Guihaia,2009,29(5):614-620.(in Chinese))
[25]李志斐,谢 骏,郁二蒙,等.基于 Biolog-ECO技术分析杂交鳢和大口黑鲈高产池塘水体微生物碳代谢特征[J].农业环境科学学报,2014,33(1):185-192.(LI Zhi-pei,XIE Jun,YUN Er-meng,et al.Carbon Metabolic Diversity of Microbial Communities in Intensive Ponds for Hybrid Snakehead and Largemouth Bass Based on Biolog-ECO Plates[J].Journal of Agro-environment Science,2014,33(1):185-192.(in Chinese ))

