亚甲蓝光化学疗法病毒灭活新鲜冰冻血浆在广州增城地区的临床应用可行性
黄斯瑜 钟丽玲
广州血液中心增城市血站,广东增城 511300
亚甲蓝光化学疗法病毒灭活新鲜冰冻血浆在广州增城地区的临床应用可行性
黄斯瑜 钟丽玲
广州血液中心增城市血站,广东增城 511300
目的 通过检测新鲜冰冻血浆病毒灭活前后Ⅷ因子含量及病毒灭活效果的变化,探讨病毒灭活新鲜冰冻血浆在增城地区临床应用的可行性。 方法 将300袋未灭活新鲜冰冻血浆作为对照组,进行Ⅷ因子含量检测;将病毒灭活后上述300袋新鲜冰冻血浆作为实验组,进行Ⅷ因子含量检测,计算病毒灭活后Ⅷ因子含量。将5袋确诊HBV和5袋确诊HCV的新鲜冰冻血浆采用荧光定量PCR检测方法检测亚甲蓝光化学疗法病毒灭活前后,病毒灭活效果的变化。临床随机抽取 200例输注病毒灭活血浆的患者,观察病毒灭活血浆输注后是否出现输血不良反应。 结果 新鲜血浆病毒灭活前后血浆Ⅷ因子含量为(1.097±0.047)IU/mL、(0.824±0.027)IU/mL;凝血因子Ⅷ含量灭活前后差异有统计学意义(P<0.01);利用亚甲蓝光化学疗法血浆病毒灭活技术对凝血因子Ⅷ含量有一定的影响,但是均达到GB 18469-2012《全血及成分血质量要求》对病毒灭活新鲜冰冻血浆的质量要求。标本病毒灭活后血浆HBV-DNA及HCV-RNA载量均为<1000copies/mL。病毒灭活血浆输注人体后无不良反应发生。 结论 临床使用较安全,病毒灭活新鲜冰冻血浆能够有效降低经输血传播疾病的危险性,且不良反应较小。在广州增城地区的临床应用是可行的。
亚甲蓝光化学疗法;病毒灭活;新鲜冰冻血浆
新鲜冰冻血浆是从无偿献血者采集血液于6~8h内分离速冻而来,几乎含有所有的血液凝血因子,临床主要应用于单种凝血因子缺乏、多种获得性凝血因子缺乏、大量输血伴凝血功能障碍、血栓性血小板减少性紫癜、C1-脂酶抑制物缺乏症、溶血性尿毒综合征的血浆转换等,是临床常用血液制品之一。输血的安全性也越来越受到公众的关注。本血站作为广州增城地区的唯一供血单位,虽然对献血者都进行了筛选,但由于检测项目、检测技术等方面的局限,经血传播疾病还无法完全避免,血浆病毒灭活技术作为阻断经血传播的疾病,有着不可代替的作用。亚甲蓝(MB)光化学疗法作为现阶段最常用的血浆病毒灭活技术[1]其原理是,亚甲蓝(MB)作为一种光敏剂,与可见光协同作用产生单态氮,后者可作用于核酸链上的鸟嘌呤,引起脱嘌呤和核酸链的断裂和碱基位点丢失从而阻止其复制,由于亚甲蓝光敏染料易穿透脂包膜病毒外壳并与病毒核酸结合,而非脂包膜病毒的病毒核酸结构被衣壳紧密包裹,亚甲蓝不易与其结合,这就解释了为何大多数非脂包膜病毒不能被亚甲蓝灭活的道理[2]。HBV、HCV、HIV病毒都属于包膜病毒,通过应用亚甲蓝/光化学法对血浆中病毒进行有效地灭活的方法对无偿献血制备血浆进行病毒灭活处理,使用病毒灭活血浆可有效控制经血传播疾病的传播 ,保证临床输血的安全。
1 材料与方法
1.1 材料
一次性血浆病毒灭活过滤器(上海血液技术公司),百级净化间,SE250型高频热合机(深圳达科为医疗器械有限公司,大容量低温离心机(日立CR7);医用病毒灭活箱(上海通用机械集团);半自动血凝仪(法国Stago公司),Ⅷ因子测定试剂(法国思达高诊断公司)。ABI7500fast荧光PCR仪(广州血液中心临床研究所),HBV-DNA荧光定量PCR检测试剂(中山大学达因股份有限公司),HCVRNA荧光定量PCR检测试剂(中山大学达因股份有限公司)。
1.2 调查对象
随机抽取增城市血站2014年1~8月无偿献血300人份。本站采集的无偿献血者血液经PCR检测证实HBV为阳性5袋,HCV阳性5袋。
1.3 方法
1.3.1 新鲜冰冻血浆制备 采集无偿献血者400mL全血后,6h内4℃,4036g离心15min,将血浆转移入血浆袋,制成新鲜冰冻血浆。
1.3.2 亚甲蓝病毒灭活 把血浆与一次性病毒灭活输血过滤器相连接,让血浆在MB元件中停留1min,并将其进行均匀混合,使之充分反应,然后将血浆再流入光照袋,在32 000 ~ 38 000Lx光照强度的可见光在4℃温度下照射35min,然后再将光照后的血浆通过病毒灭活过滤器滤除MB和残留白细胞。全过程在6~8h内完成。
1.3.3 新鲜冰冻血浆亚甲蓝病毒灭活前后凝血因子Ⅷ活性含量变化检测 制备300人份新鲜冰冻血浆,并按1.3.2进行病毒灭活处理。用磁珠法分别检测病毒灭活前后凝血因子Ⅷ活性。
1.3.4 亚甲蓝病毒灭活前后HBV-DNA载量(copies/mL)和HCV-RNA载量(copies/mL)检测本站采集的无偿献血者血液经广州血液中心临床研究所ABI7500fast荧光PCR仪PCR检测证实HBV为阳性5袋,HCV阳性5袋,无菌留样2mL,剩余的血浆加入亚甲蓝光照35min后过滤无菌留样后按照达因基因试剂盒说明书操作。
1.4 病毒灭活后血浆的临床应用评价
1.4.1 研究对象 2014 年1~8月随机选择输注病毒灭活血浆增城各医院患者300 例,进行病毒灭活后血浆临床应用评价的回顾性研究。
1.4.2 不良反应监测 观察血浆输注后是否出现输血不良反应。 评价标准:患者输注血浆后出现恶心、呕吐、寒战、 发热为有输血不良反应。
1.5 统计学分析
2 结果
亚甲蓝灭活病毒前后凝血因子Ⅷ含量见表1,实验对比了300人份血浆灭活前后凝血因子Ⅷ含量。结果表明:凝血因子Ⅷ含量灭活前后差异有统计学意义(P<0.01)。标本病毒灭活前后血浆HBV-DNA载量(copies/mL)见表2,HCV-RNA载量(copies/mL)见表3。输注病毒灭活血浆的200例患者无恶心、 呕吐、 寒战、 发热等明显的输血不良反应。
表1 标本病毒灭活前后凝血因子Ⅷ含量变化情况
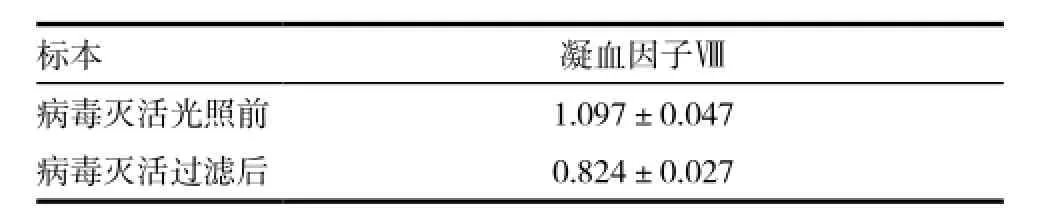
表1 标本病毒灭活前后凝血因子Ⅷ含量变化情况
注:t=8.15,P<0.01
?
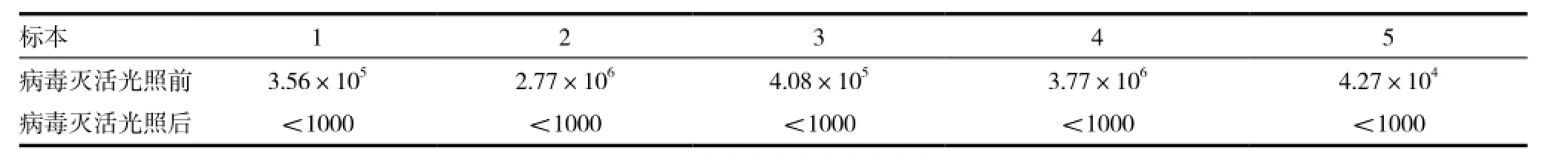
表2 标本病毒灭活前后血浆HBV-DNA载量(copies/mL)
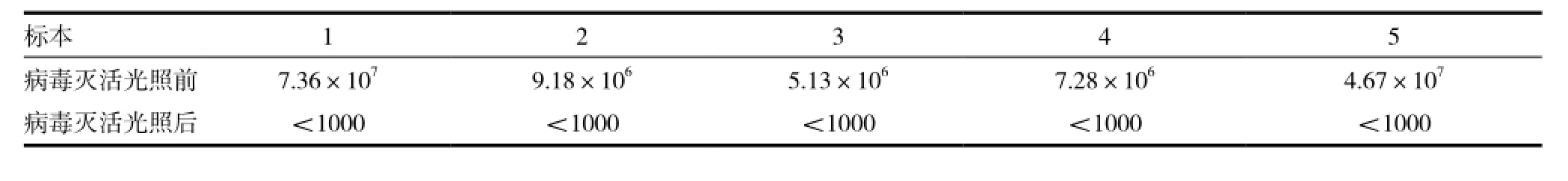
表3 标本病毒灭活前后血浆HCV-RNA载量(copies/mL)
3 讨论
新鲜冰冻血浆输注目的主要为补充多种获得性凝血因子缺乏、 补充蛋白质、 促进伤口愈合、 扩容等。其中合理输注目的为血栓性血小板减少性紫癜、 血浆置换、 补充多种获得性凝血因子缺乏。本站是广州市增城地区的唯一血站,增城地区临床对新鲜冰冻血浆使用十分广泛,也存在不合理使用新鲜冰冻血浆的现象,从2003年开站新鲜冰冻血浆的使用量逐年增长。新鲜冰冻血浆在临床上需求量大,受检测项目和检测手段的限制,处于“窗口期”的病毒携带者可出现漏检,因此对血浆进行病毒灭活处理,对于降低由此导致的病毒感染危险性是非常重要的。而血浆是传播疾病的重要血液制品之一。我国南方是乙肝病毒性肝炎的高发地区,增城位于广州的东部城市,也是乙肝病毒性肝炎的高发地区,按照无偿献血人数计算,即使已经做了乙肝初筛的情况下,本站开站至今已经验出乙肝1514例,占无偿献血总人数的1.59%,并且呈逐年增加的趋势。对于乙型和丙型肝炎及艾滋病的传播主要通过血液传播,输血是其中一个传播途径。本站根据GB 18469-2012《全血及成分血质量要求》[3](2012版)的要求采用了国家规定的2个不同生产厂家的ELISA试剂双人对血液标本进行检定。但是由于资金等原因,本站未能开展核酸检测。相较于核酸检测,HBsAg的第四代ELISA试剂,“窗口期”仍然延长了6~15d;而HCV ELISA检测“窗口期”延长41~60d;检测HIV抗体及血清p24抗原的进口ELISA试剂能在感染后16~22d查出,而进行核酸检测HIV-RNA可在感染后11d查出[4]。核酸技术检测比ELISA检测病毒的“窗口期”要短,在没有开展核酸检测的条件下,同时要降低感染病毒的风险,那么使用病毒灭活血浆就有极其重要的必要性了,亚甲蓝光化学疗法血浆病毒灭活技术操作简单方便,非常适合在增城地区进行临床推广应用。
本研究不仅检测了亚甲蓝/光照法病毒灭活血浆的质量指标,还观察了输注病毒灭活血浆后不良反应的发生率,未发现输注病毒灭活血浆后发生明显的不良反应同相关地区报道的一致[5-6]。其原因可能在于,亚甲蓝/光照法灭活病毒,不仅破坏了病毒复制及感染能力,抑制病毒经血传播,同时还滤除了血浆中残留的白细胞(血浆中的残留白细胞含量与非溶血性发热反应等疾病相关),使输注血浆后的不良反应有所减少[7]。
本研究根据病毒灭活新鲜冰冻血浆质量控制项目的条款对2014年1~8月的300人份的新鲜病毒血浆灭活前后的血液成分和功能的影响进行了比较。表1结果显示凝血因子Ⅷ含量灭活前后差异有统计学意义(P<0.01),结果与国内文献报道的血浆凝血因子Ⅷ含量均有不同程度的下降相一致[8-10];但是灭活后的凝血因子Ⅷ含量依然符合《全血及成分血质量要求》里面对病毒灭活新鲜冰冻血浆质量控制的要求。表2、表3结果显示病毒灭活后的HBV-DNA及HCV-RNA浓度下降,接近于0[11]。由此可见在增城地区比较落后的检验条件下,同时存在了不合理使用新鲜冰冻血浆的现象的条件下,为了尽可能减少由于输血感染病毒的风险,开展病毒灭活(亚甲蓝光化学疗法)新鲜冰冻血浆能有效地防止经输血传染疾病的发生,在临床应用方面是非常可行的。
[1] Mohr H,Knuver Hopf J,Gravemann U,et al.West Nile virus in plasma is highly sensitive to methylene blue light treatment[J].Transfusion,2004,44:886-890.
[2] McCullough J.A new paradigm for preventing transfusiontransmitted infections[J].Am J Clin Pathol,2007,128(6):945-955.
[3] 中华人民中华人民共和国国家质量监督检验检疫总局.全血及成分血质量要求[S].中国人民共和国国家标准GB-18469-2012,2012:1.[4] 2012全国卫生专业技术资格考试指导输血技术[M].北京:人民卫生出版社,2011:413-433.
[5] 李榕,陈火玲,钱献,等.亚甲蓝/ 光照法病毒灭活血浆的制备及应用评价[J].临床输血与检验, 2013, 15 (1):4-7.
[6] 张丹,刁荣华,王世春,等.输注病毒灭活血浆和新鲜冰冻血浆输血反应发生率的比较[J].中国输血杂志,2014(10):54-55.
[7] 王飞, 路志浩, 古醒辉, 等.亚甲蓝光化学法血浆病毒灭活前后血浆成分的变化[J] .临床输血与检验,2010, 12(2):97-98.
[8] 李建斌,单泓,王姣杰.病毒灭活就血浆成分的影响及临床观察[J].医学研究杂志,2009,38(7):80-82.
[9] 陈镇周,肖明星,陈湘屏,等.亚甲蓝光化学法病毒灭活对血浆质量的影响[J].中国输血杂志,2011(6):48-50.
[10] 王飞,路志浩,古醒辉,等.亚甲蓝光化学法血浆病毒灭活前后血浆成分的变化[J].临床输血与检验,2010(2):6-9.
[11] 马春黎,宋静.血浆病毒灭活的临床应用与安全输血[J].中国当代医药,2011,18(13):171.
Clinical application and effectiveness of virus inactivation by methylene blue photochemical method in freshly frozen blood plasma in the regions of Guangzhou Zengcheng
HUANG Siyu ZHONG Liling
Zengcheng Blood Station, Guangzhou Blood Center,Zengcheng 511300, China
Objective In order to investigate the safety and effectiveness of Virus inactivation by methylene blue photochemical method in Guangzhou Zengcheng area, the concentration difference of Factor Ⅷ before and after the virus inactivation process was measured. Methods The concentrations of Factor Ⅷ in three hundred bags of freshly frozen blood plasma without virus inactivation were measured and used as a control group. Then virus inactivation procedures were performed on the three hundred bags of freshly frozen blood plasma mentioned above and the concentration of Factor Ⅷ was measured again. The difference in the concentration of Factor Ⅷ before and after virus deactivation were calculated. Two groups of five bags of freshly frozen blood plasma, which were confirmed to contain Hepatitis B Virus(HBV) and Hepatitis C Virus (HCV) respectively, were analyzed with quantitative fluorescent Polymerase Chain Reaction (PCR) before and after methylene blue photochemical treatment to study the effectiveness in virus inactivation. Random testing was performed among 200 patients who received virus inactivated blood plasma transfusion. These patients were observed for abnormal response after the transfusion. Results The concentration of the factorⅧ before and after virus inactivation were (1.097±0.047)IU/mL and (0.824±0.027)IU/mL respectively. The use of methylene blue photochemical treatment of plasma virus inactivation technology has some influence on the plasma composition, but meets the GB 18469-2012 “Whole Blood and Blood Components Quality Requirements”for virus inactivation of freshly frozen plasma. After virus inactivation, HBV-DNA and HCV-RNA load in sample blood plasma were less than 1000 copies/mL. There is no abnormal response observed in patients who received virus inactivation blood plasma transfusion. Conclusion Experiments showed that the method is clinically safe and effective. Virus inactivation of freshly frozen blood plasma is proven to effectively reduce the potential safety hazard caused by clinical blood transfusion. It is feasible to implement this method in Guang Zhou Zeng Cheng region.
Methylene blue; Inactivation of virus; Frozen blood plasma
R457.1
B
2095-0616(2015)08-196-04
2015-01-08)
广东省广州市医药卫生科技项目
(20131A041029)。

