淫羊藿苷对兔椎间盘纤维环细胞生物学特性的影响
杜文喜,谢 健,夏臣杰,黄杰烽,陈俊杰,段淑芳
(1.浙江中医药大学附属第一医院,浙江杭州 310006; 2.浙江中医药大学,浙江杭州 310053;3.浙江中医药大学附属第二医院,浙江杭州 310005)
淫羊藿苷(Icariin,ICA)是淫羊藿属(Epimedium)植物淫羊藿茎叶中提取的总黄酮主要有效成分[1]。研究显示,淫羊藿苷持续用药对脊柱损伤(椎板摘除)的老鼠具有显著性治疗作用[2]。纤维环破裂、髓核膨出等引起的椎间盘退变是目前临床脊柱患者的主要病因,而ICA是否可以延缓椎间盘退变目前尚不明了。体外培养纤维环细胞至3~4代开始出现细胞形态改变、增殖减少、细胞外基质合成不足、细胞周期异常等退变现象[3-4],有学者认为此时的细胞可用于模拟体内椎间盘退变模型[5]。本研究通过对椎间盘纤维环细胞体外模型持续干预,旨在评价ICA对退变期细胞的作用效果,为ICA应用于临床防治椎间盘退变疾病提供理论依据。
1 实验材料
1.1 实验动物
新西兰雌性大白兔10只(清洁级,体质量2~3kg),浙江中医药大学动物实验中心提供。
1.2 试剂与仪器
0.25%胰蛋白酶-EDTA(Gbico)、Ⅱ型胶原酶、MTT、甲苯胺蓝染液(Solarbio)、DMEM、F12培养液、PBS(吉诺)、胎牛血清(FBS,四季青)、DMSO(Sigma)、淫羊藿苷(ICA,中国食品药品检定研究院,110737-200415)、细胞周期与细胞凋亡检测试剂盒(碧云天)、Trizol(Invitrogen);逆转录试剂盒(Promega)、培养箱(Thermo)、洁净工作台(Airtech)、倒置相差显微镜(Olympus)、台式离心机、电热恒温水浴锅(上海)、培养瓶、培养板(NEST)、酶标仪(Bio-tek)、流式细胞仪(Epics Altra)、RT-PCR 仪(Takara)等。
2 实验方法
2.1 纤维环细胞的分离培养
无菌条件下分离新西兰大白兔椎间盘纤维环组织,置于培养皿中。DMEM/F12(1∶1)混合液洗 2遍后剪成1mm3的小块,按0.1%胰蛋白酶-EDTA、0.1%Ⅱ型胶原酶37℃水浴顺序消化30min、4h。消化完毕后离心(1500rpm,5min),弃上清,加入含 15%FBS的DMEM/F12(1∶1)培养液制成细胞悬液。培养箱(37℃、5%CO2)培养,2~3d换液 1次。细胞铺满单层后胰酶消化法传第1代,细胞计数并将密度调整为105个/mL。
2.2 分组及传代培养
取一部分第1代细胞作为P0组铺板后待测;剩余细胞分为空白组(15%FBS培养液培养)与ICA组(含ICA的15%FBS培养液培养,ICA浓度10-5M),这部分细胞传至第3代铺板后待测。传代过程中细胞密度均调整至105个/mL。
2.3 指标检测
2.3.1 甲苯胺蓝染色 细胞接种48h后,贴壁细胞PBS洗2次,4%多聚甲醛4℃固定1h,蒸馏水清洗20min后2%甲苯胺蓝染液浸染2h,吸去多余染液后倒置相差显微镜下观察、拍照。
2.3.2 MTT法检测细胞增殖 将细胞接种于96孔板,12个复孔,每孔200μL细胞悬液。48h后向96孔板中加入20μL MTT溶液,细胞培养箱继续孵育4h。小心吸除上清后滴加DMSO溶液150μL,微量振荡器上震荡10min,使结晶物充分溶解。酶标仪490nm波长测定各孔吸光度值为m,吸净孔内溶液再测1次为n,实际吸光度(OD值)为(m-n)。
2.3.3 RT-PCR检测蛋白多糖(AGG)表达 细胞接种72h后,根据Invitrogen公司Trizol操作说明书提取椎间盘纤维环细胞总RNA。然后根据Promega公司M-MLV操作说明书将RNA逆转录获得cDNA,最后进行RT-PCR检测。扩增引物如表1,GAPDH为内参照基因。最后以相对CT值(目的基因CT值/内参基因CT值)表示结果。

表1 RT-PCR扩增引物序列
2.3.4 流式细胞仪检测细胞周期 细胞接种72h后按照细胞周期与细胞凋亡检测试剂盒处理,然后流式细胞仪488nm波长检测红色荧光并进行分析。
2.4 统计学方法
3 结果
3.1 甲苯胺蓝染色
原代椎间盘纤维环细胞22h后开始贴壁,4d后完全贴壁,细胞呈类圆形见细小突触或呈梭形,12d后细胞贴满瓶底。甲苯胺蓝染色呈易染性,细胞核呈紫色,细胞质呈淡蓝色或深蓝色。如图1所示,镜下可见细胞分布均匀,空白组细胞分布最稀疏,而ICA组细胞分布密集程度接近于P0组。
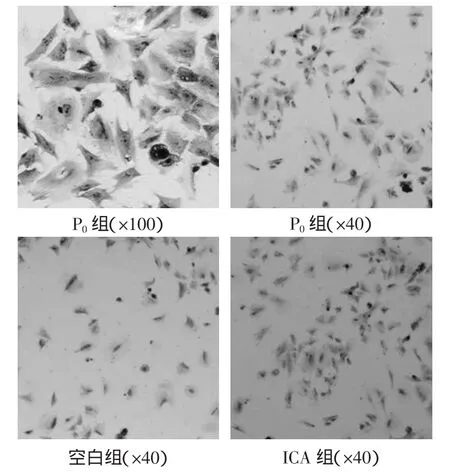
图1 椎间盘纤维环细胞甲苯胺蓝染色
3.2 细胞增殖情况
经 MTT 法检测,P0组吸光度值为(0.68±0.064),空白组吸光度值为(0.55±0.037),ICA组吸光度值为(0.64±0.028),P0组与空白组比较,差异有统计学意义(P<0.05);P0组与ICA组比较,差异无统计学意义(P>0.05)。说明随着细胞传代,细胞活力逐渐下降、增殖能力减弱,而ICA能够维持椎间盘纤维环细胞增殖能力,使其接近于原代细胞。
3.3 AGG表达差异
经RT-PCR检测椎间盘纤维环细胞AGG表达相对CT值P0组、空白组及ICA组分别为(1.238±0.018),(1.196±0.007),(1.220±0.006)。与空白组比较,其余两组相对CT值均显著升高(P<0.05);P0组与ICA组比较差异无统计学意义(P>0.05)。说明随着细胞传代,椎间盘纤维环细胞分泌AGG的能力逐渐减弱,而ICA持续用药可以使纤维环细胞的分泌能力基本与原代细胞一致。
3.4 细胞周期分布
细胞周期分布见图2。
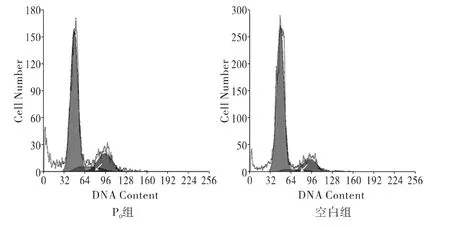
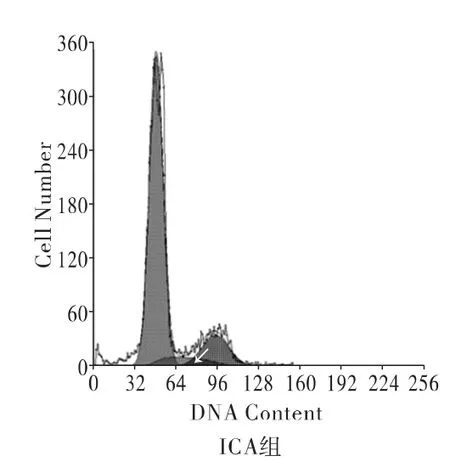
图2 椎间盘纤维环细胞流式细胞仪测试图
箭头区域代表S期细胞,可见空白组S期细胞所占比例最少。椎间盘纤维环细胞S期细胞分布百分比P0组、空白组及ICA组分别为(8.591±0.124)%,(4.566±0.173)%,(7.187±0.699)%。与空白组比较,P0组及ICA组S期细胞分布百分比均明显增加(P<0.05);P0组与ICA组比较,差异无统计学意义(P>0.05)。说明ICA能够使纤维环细胞保持接近于原代细胞的细胞分裂能力,使其不至于过早凋亡。
4 讨论
纤维环是椎间盘的重要组成,水含量占60%~70%,胶原蛋白占干重的60%,蛋白多糖占干重的20%[6]。其中胶原蛋白与蛋白多糖是纤维环最主要的细胞外基质,是衡量纤维环细胞生物活性的重要指标。椎间盘纤维环中蛋白多糖含量的下降或成分的改变,均影响其中的胶原纤维稳定和纤维板层间的滑动,引起纤维环退变[7]。纤维环细胞为一种软骨细胞[3],缺乏特异性标志物,目前仅局限于细胞表型、特异亲和力染料、多种抗原检测对该种细胞进行鉴定[8]。本实验纤维环细胞呈多角形或梭形,甲苯胺蓝染色具有易染性,与文献所述一致[9]。
通过微创手术损伤纤维环建立椎间盘退变模型[10],操作复杂,实验周期较长。周江涛等[11]采用该种方法需8w后才能造模成功而进入细胞实验阶段。本实验采用持续培养法造成椎间盘纤维环细胞自然退变,空白组与P0组比较可见细胞增殖减慢、S期细胞比例减少、AGG分泌不足,基本符合退变纤维环细胞的生物学特性。而且,持续培养法简便易行,是纤维环细胞退变造模的良好选择。
ICA具有调节骨代谢和双向免疫调节作用。有研究证实,ICA对体外培养的软骨细胞具有维持表型、促增殖作用,并且促进细胞外基质成分胶原与蛋白多糖基因的表达而抑制其降解[12-13]。本实验通过对第1代椎间盘纤维环细胞持续ICA给药至第3代,结果显示ICA具有延缓纤维环细胞退变的作用,使该细胞生长增殖及细胞外基质分泌的能力基本接近于第1代细胞。细胞增殖及细胞周期检测,ICA组较P0组有下降趋势,但差异无统计学意义(P>0.05),可见ICA并不能完全控制或逆转细胞退变。
药物治疗对于临床尚未出现手术适应征的椎间盘退变患者不能忽视,ICA可以是临床医生的一种选择。但是ICA通过何种途径延缓退变?对于患者,其最佳干预时间及浓度是多少?这些都是ICA临床应用前需要解决的关键问题。
[1]Makarova M N,Pozharitskaya O N,Shikov A N,et al.Effect of lipid-based suspension of Epimedium koreanum Nakai extract on sexual behavior in rats[J].J Ethnopharmacol,2007,114(3):412-416.
[2]Tohda C,Nagata A.Epimedium koreanum extract and its constituent Icariin improve motor dysfunction in spinal cord injury[J].Evid Based Complement Alternat Med,2012,doi:10.1155/2012/731208.
[3]周泉,王拥军,施杞.椎间盘纤维环细胞的培养[J].脊柱外科杂志,2003,1(4):226-229.
[4]席志鹏,周临东,谢林.椎间盘退变模型研究进展[J].山西中医学院学报,2010,11(2):69-71.
[5]张坤木,陈少清,宋红梅,等.大鼠椎间盘纤维环细胞的培养及鉴定[J].中国组织工程研究与临床康复,2011,15(11):1973-1976.
[6]Jones B F,Wall M E,Carroll R L,et al.Ligament cells stretch-adapted on a microgrooved substrate increase intercellular communication in response to a mechanical stimulus[J].J Biomech,2005,38(8):1653-1664.
[7]王诗衷,黄龙生,陈少清,等.桂枝加葛根汤对椎间盘纤维环细胞蛋白多糖表达的影响[J].中华中医药杂志,2011,26(11):2543-2547.
[8]潘勇,周跃,李长青,等.组织工程椎间盘纤维环种子细胞的培养和鉴定[J].四川医学,2009,30(4):450-452.
[9]Gan JC,Ducheyne P,Vresilovic E J,et al.Intervertebral disc tissue engineering I:characterization of the nucleus pulposus[J].Clin Orthop Relat Res,2003(411):305-314.
[10]林鸿宽,叶君健.纤维环损伤诱导兔椎间盘退变模型[J].解剖学杂志,2008,31(5):699-702.
[11]周江涛,王庆来,赵依娜,等.独活寄生汤对腰椎间盘纤维环细胞P38信号转导通路的影响[J].中医正骨,2012,24(6):9-12.
[12]Liu M H,Sun J S,Tsai S W,et al.Icariin protects murine chondrocytes from lipopolysaccharide-induced inflammatory responses and extracellular matrix degradation[J].Nutr Res,2010,30(1):57-65.
[13]张璇,肖玉梅,王茹,等.淫羊藿苷对胶原支架中软骨细胞生长及胞外基质分泌的影响[J].中药药理与临床,2010,26(6):25-27.

