低温高压一氧化碳(CO)干燥法对离体兔心的保护作用及机制
郭义龙 张 钟 周鹏宇 朱 平 黄 帅 郑少忆
(广东省心血管病研究所 广东省人民医院(广东省医学科学院)心血管外科,广州510080)
心脏移植作为终末期心力衰竭的有效治疗手段近 年来在全世界范围内得到迅速的推广和发展。但供心短缺及供心保存时间有限严重地制约着心脏移植的发展。故急需一种简单、有效的离体心脏保存方法。
日本的研究人员已经将低温干燥及高压一氧化碳(carbon monoxide,CO)这两种方法结合,并应用于小鼠离体心脏的保存,获得保存48 h后成功复苏的结果[1]。本实验创新性的将上述保存方法应用于大动物(新西兰兔)离体心脏的保存,通过对比研究传统组氨酸-色氨酸-酮戊二酸盐浓度(histidine-tryptophan ketoglutarate solution,HTK液)低温浸泡保存与该方法对离体兔心的保存效果,进一步探讨低温高压CO干燥法的保存效果及机制。
1 材料及方法
1.1 实验动物及分组
成年新西兰兔72只(体质量2.0~2.5 kg),雌雄不限(南方医科大学动物实验中心提供,实验动物许可证号:44002100002755)。采用数字表法随机分为5组:空白对照组8只、即刻移植组16只、普通干燥组16只、高压干燥CO保存组16只、低温HTK浸泡组16只。
1.2 实验方法
1.2.1 离体兔心的获取与保存
从后4组中每组任意取8只作为心脏供体,而剩下的8只作为心脏受体;供体兔分别用3%戊巴比妥钠由耳缘静脉注入麻醉(0.75 mL/kg),并由耳缘静脉注入稀释后的肝素钠溶液抗凝(25 u/mL、5 mL/kg);胸部正中开胸,用4℃的高钾停跳液[配方:0.9%(质量分数)氯化钠溶液500 mL、10%质量分数氯化钾溶液35 mL、25%质量分数硫酸镁溶液19.2 mL、2%质量分数利多卡因溶液10 mL;灌注压力为:55.15 mmHg;1 mmHg=0.133 kPa]由主动脉根部灌入使心脏停搏。当心脏停搏后心包腔内放冰水使心脏均匀降温。并迅速将心脏取下。
第1组:(空白对照组,GroupⅠ)心脏取出后立即收集血液标本及心肌组织标本进行检查;第2组:(即刻移植组,GroupⅡ)心脏取出后立即进行腹腔异位移植;第3组:(普通干燥组,GroupⅢ)由主动脉根部往离体兔心内灌入含有3倍高糖的K-H液10 mL(配方:氯化钠6.932 g/L、碳酸氢钠2.1 g/L、氯化钾0.354 g/L、磷酸氢化钾0.16 g/L、七水硫酸镁0.295 g/L、二水氯化钙0.265 g/L、葡萄糖1.98 g/L),然后将离体兔心放置在4℃的冰箱内保存18 h;第4组:(低温高压CO干燥保存组,Group IV)由主动脉根部往离体兔心内灌入含有3倍高糖的K-H液10 mL,冲出冠状动脉内残留血液,并将心脏放置在4℃高压CO干燥保存罐中保存18 h(CO=0.8ATA,O2=3.2ATA,ATA:1 个标准大气压)[2];第5 组:(单纯低温 HTK 浸泡组,Group V)由主动脉根部往离体兔心内灌入HTK液10 mL(配方:氯化钠0.876 6 g/L、氯化钾0.671 0 g/L、6H2O·硫酸镁0.813 2 g/L、组氨酸·HCL·H2O 3.773 3 g/L、组氨酸27.928 9 g/L、色氨酸0.408 5 g/L、甘露醇5.465 1 g/L、二水氯化钙0.002 2 g/L、2-酮戊二酸-氢-钾0.184 2 g/L,该HTK液由德国克勒化学制药厂按照Bretschneider配方生产),冲出冠状动脉内残留血液,并将心脏放置在4℃的冰箱内保存18 h。
1.2.2 兔心腹腔异位移植的方法[3-6]
受体兔分别用3%戊巴比妥钠由耳缘静脉注入麻醉(0.75 mL/kg),并由耳缘静脉注入稀释后的肝素钠溶液抗凝(25 μ/mL、5 mL/kg);受体兔腹部备皮后用I型安尔碘消毒,并由腹部正中开腹,精密游离腹主动脉及下腔静脉。将供心的主动脉与受体腹主动脉行端-侧吻合,将供心的肺动脉与下腔静脉行端-侧吻合。将供心的肺静脉及上、下腔静脉结扎。吻合完毕后温盐水复温(整个过程控制在20 min内)。
1.2.3 标本的采集
供心移植完毕后1 h由供心肺动脉采取血液标本1 mL,同时切取少许心尖部心肌组织送检;
1.3 观测指标
1.3.1 心脏复跳指标
本实验采用“半定量评分法”判定供心复跳情况:即通过触摸、肉眼观察和显微镜观察来评定恢复血供后5 min内、1 h后这2个时间点供心的跳动情况。评分标准:1分:显微镜下观察到的心肌纤维颤动,但触摸不到心脏跳动;2分:可触摸到很弱的或局部的心脏跳动;3分:心脏整体跳动但是心跳频率和强度较低;4分:正常的心脏跳动频率和强度。3分及4分的供心认定为复跳成功;1分及2分的供心认定为复跳失败。通过对供心跳动情况的半定量分析,可大致了解不同保存处理方法对供心的保护效果。
1.3.2 心肌酶指标
采用Elisa方法检测血液标本中的肌酸激酶同工酶(creatine kinase-MB,CK-MB)、肌酸激酶(creatine kinase,CK)、门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、乳酸脱氢酶(lactic dehydrogenase,LDH)等心肌酶;上述心肌酶平时保存在心肌细胞的细胞器或胞质内,当心肌细胞受损,细胞膜破坏,胞质中的游离心肌酶迅速释放入血,对反映心脏心肌细胞损伤具有特异性和敏感性。
1.3.3 心肌炎性反应因子的测定
采用Western blotting法测定心肌组织中4个炎性反应因子:肿瘤坏死因子-α(tumor necrosis factorα,TNF-α),白细胞介素-1(interleukin-1,IL-1),白细胞介素-17(interleukin-17,IL-17),细胞间黏附因子-1(intercellular cell adhesion molecule-1,ICAM-1)。
1.3.4 心肌切片苏木精-伊红染色(HE染色)
分别取高压CO干燥组及HTK浸泡组保存了18 h并恢复血供1 h后的供心组织行HE染色检查。
1.4 统计学方法
使用SPSS 13.0统计软件对数据进行处理。所测各项指标均以均数±标准差(±s)表示,组间差异采用单因素方差分析(One-way ANOVA)和SNK-q检验。采用χ2检验(Fisher确切概率法)比较供心复跳率指标在不同组间的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 供心复跳率比较
CO高压干燥保存组及HTK浸泡保存组在恢复供心血供后5 min及1 h这两个时间点供心复跳率方面差异无统计学意义(P值分别为1.000、0.569),详见表1。

表1 离体兔心恢复血供后的复跳率Tab.1 Resuscitation rate of the isolated rabbit heart n(%)
2.2 各组间心肌酶的比较
本实验用Elisa法测量恢复灌注后1 h从供心肺动脉端抽出来的血中的心肌酶;各实验组的心肌酶检测结果详见图1及表2;CO高压干燥组与HTK液浸泡组在CK-MB、LDH和CK这3项指标间差异有统计学意义(P<0.05);而AST在该两组之间差异无统计学意义(P=0.249)。
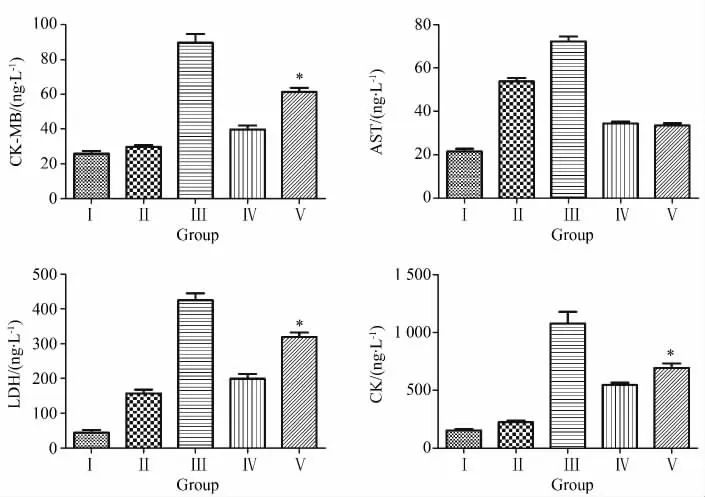
图1 各实验组间心肌酶检查(Elisa法)结果的柱状图Fig.1 Histogram of different cardiac function enzymes
表2 各实验组间心肌酶检查(Elisa法)结果Tab.2 The measurements(Elisa)of the cardiac function enzyme (±s,n=8)

表2 各实验组间心肌酶检查(Elisa法)结果Tab.2 The measurements(Elisa)of the cardiac function enzyme (±s,n=8)
*P<0.05 vs groupⅣ;Group I:examination without transplantation or preservation;GroupⅡ:underwent transplantation without preservation;GroupⅢ:preserved with desiccation;GroupⅣ:preserved with desiccation and CO;GroupⅤ:preserved with HTK solution;CK-MB:creatine kinase-MB;AST:glutamic-pyruvic transaminase;LDH:lactic dehydrogenase,CK:creatine kinase.
Item GroupⅠ GroupⅡ GroupⅢ GroupⅣ GroupⅤCK-MB/(ng·L-1) 25.68±1.41 29.63±0.76 89.76±4.24 39.57±1.80 61.27±1.69*AST/(ng·L-1) 21.53±0.93 53.83±1.15 72.17±1.36 34.36±0.67 33.54±0.86 LDH/(ng·L-1) 43.98±6.14 160.08±7.46 429.02±16.08 200.23±11.53 323.11±10.74*CK/(ng·L-1) 155.08±10.73 225.50±9.17 1076.54±75.73 546.75±17.60 693.63±33.13*
2.3 各组间炎性反应因子比较
本实验使用Western blotting法检测恢复血供后1 h供心组织中的炎性反应因子,检测结果见图2及表3。CO高压干燥组与HTK液浸泡组在TNF-α、IL-1及IL-17这3项指标间差异有统计学意义(P<0.05);而ICAM-1在该两组之间差异无统计学意义(P=0.998)。
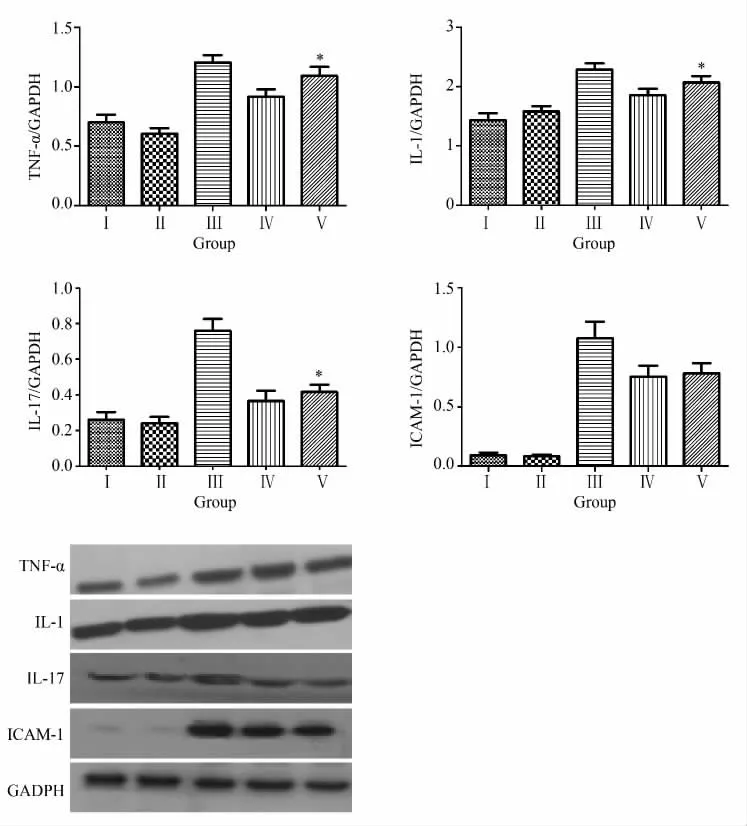
图2 各实验组间心肌炎性因子检查(Western blotting法)Fig.2 The histogram of different myocardium inflammatory factors
表3 各实验组间炎性反应因子检查结果(Western blotting法)Tab.3 The measurements of the myocardium inflammatory factors(Western blotting)(±s,n=8)
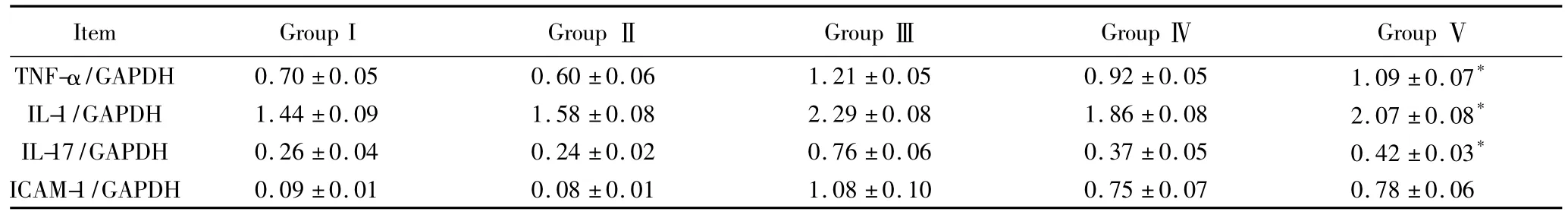
表3 各实验组间炎性反应因子检查结果(Western blotting法)Tab.3 The measurements of the myocardium inflammatory factors(Western blotting)(±s,n=8)
*P<0.05 vs groupⅣ;Group I:examination without transplantation or preservation;GroupⅡ:underwent transplantation without preservation;GroupⅢ:preserved with desiccation;Group Ⅳ:preserved with desiccation and CO;Group Ⅴ:preserved with HTK solution;TNF-α:Tumour necrosis factor-α;IL-1:interleukin-1;IL-17:interleukin-17;ICAM-1:intercellular adhesion molecule-1;GAPDH:glyceraldehyde-3-phosphate dehydrogenase.
Item Group I GroupⅡ GroupⅢ GroupⅣ GroupⅤTNF-α/GAPDH 0.70±0.05 0.60±0.06 1.21±0.05 0.92±0.05 1.09±0.07*0.75±0.07 0.78±0.06 IL-1/GAPDH 1.44±0.09 1.58±0.08 2.29±0.08 1.86±0.08 2.07±0.08*IL-17/GAPDH 0.26±0.04 0.24±0.02 0.76±0.06 0.37±0.05 0.42±0.03*ICAM-1/GAPDH 0.09±0.01 0.08±0.01 1.08±0.10
2.4 心肌组织切片苏木精-伊红染色(HE染色)检查结果
CO高压干燥保存组心肌纤维结构较清晰,细胞核无明显聚集、肿胀、破裂;而传统的HTK低温浸泡保存组心肌纤维结构混乱不清,部分心肌纤维溶解,细胞核聚集、肿胀、破裂(图3)。
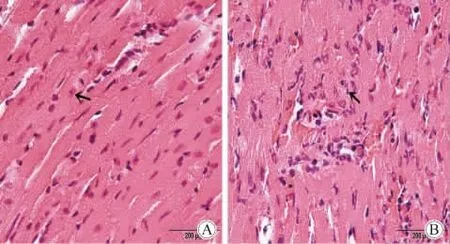
图3 高压CO干燥组(Ⅳ组)及HTK浸泡组(Ⅴ组)心肌组织苏木精-伊红染色(HE染色)检查Fig.3 The myocardial images(HE staining)of groupⅣ andⅤ;
3 讨论
心脏移植是作为终末期心力衰竭唯一有效的治疗方法,在过去的60年里,无论是在供心保存方法、手术技术还是围术期治疗等方面都取得了长足的发展,但仍有很多问题亟待解决。其中最主要的问题便是供心保存时间过短。
目前世界范围内普遍采用单纯低温浸泡保存法对老鼠、兔子、狒狒及人类心脏进行保存(利用UW液这种临床上常用的器官保存液作为保存液),其保存最长时限为4~18 h[7]。然而自然界中的动植物通过减少自体组织内水分而保持其生命力的现象普遍存在。例如某些细菌在进入休眠期后可以减少自身60%水分甚至更多[8]。通过以上的观察研究结果表明低温干燥或许可以成为一种新型的、更为有效的离体心脏保存方式。
CO是一种可以干扰人体内氧运输的有毒气体。但Tenhunen法[9]的研究表明正常人体内也可以产生CO,其是一种体内氧化血红素代谢产物。而且近年来的研究[10-14]发现,CO不仅是体内一种重要的细胞内第二信使,其在心血管系统、神经系统、免疫系统的病理生理过程中扮演着重要的调节角色。同时内源性CO还表现出抗血管平滑肌细胞增生及抑制心脏排斥的生物学特性[15]。最重要的是,CO还具有抑制细胞内新陈代谢及细胞凋亡的作用,并且在高压的CO环境下上述作用更显著[1,16]。
目前已知的干燥保存机制在于:使细胞内总的含水量减少,尤其是游离水明显减少,但仍保留一定量的结合水保护细胞内一些高能化合物的活性,进而维持细胞处于一种较低的代谢状态[17];而目前已知的高压CO作用机制在于:1)CO能与细胞色素氧化酶中的2价铁离子结合,抑制该酶的活性,进而抑制细胞内葡萄糖的氧化代谢和能量生成;2)在高压CO与O2存在的环境中,两者能建立起一种动态的平衡,代谢产物通过一种较低的能耗方式排出,而不会因代谢产物蓄积而引起坏疽;3)CO还具有抗凋亡作用[1]。
本实验是建立在日方实验的基础上[1,18],进一步将低温高压CO干燥保存方法应用于大动物(新西兰兔)离体心脏的保存,并与传统的低温HTK浸泡保存方法进行比较。实验表明:1)“低温高压CO干燥保存组”的CK-MB、MB及LDH均较“低温HTK浸泡保存组”低(P值均小于0.05),表明低温高压CO干燥保存法对离体兔心的保存效果较传统的低温HTK浸泡保存方法优越;2)IL-1、IL-17、TNF-α是常见的炎性反应因子,它们不仅可以通过多种途径激活体内的炎性细胞、介导炎性反应的进程,还可以通过不断促进自身的合成从而增强炎性反应[19-20]。其中TNF-α与IL-1本身还具有心肌抑制的作用[21]。“低温高压CO干燥保存组”心肌组织中的 IL-1、IL-17、TNF-α均较“低温HTK浸泡保存组”低(P值均小于0.05),表明低温高压CO干燥保存法可以通过抑制炎性反应,减轻供心的缺血再灌注损伤,进而起到保护供心的作用;3)通过分析HE染色图片表明经过高压CO干燥保存法保存后心肌纤维结构的完整性较传统的HTK低温浸泡保存法要好,进而表明高压CO干燥保存法对离体心脏的保存效果较传统的HTK低温浸泡保存法优越。
本实验不仅验证了低温高压CO干燥保存方法对离体心脏的保存效果优于传统的低温HTK浸泡方法,同时还证实了该保存方法在大动物离体心脏上同样适用。而且本实验通过对供心组织中炎性反应因子的测定,进一步表明低温CO干燥保存法可以通过抑制供心组织内的炎性反应,减轻缺血再灌注损伤,进而起到保护供心的作用。
本研究应用最新的气体高压干燥保存法对离体心脏进行保存,并对其作用机制进行探索,为解决供心保存时限短、保存效果不佳这两个制约心脏移植发展的关键问题提供了一种新的可能性。但若想将该实验研究结果应用于临床实践仍需要进一步的研究。
[1] Hatayama N,Naito M,Hirai S,et al.Preservation by desiccation of isolated rat hearts for 48 hours using carbon monoxide(PCO=4,000 hPa)and oxygen(PO(2)=3,000 hPa)[J].Cell Transplant,2012,21(2-3):609-615.
[2] 张钟,肖泽周,郭义龙,等.一氧化碳高压干燥环境对离体兔心的保护效果[J].南方医科大学学报,2015,35(7):1008-1013.
[3] 贺铭,曹西南.离体心脏保存技术的研究进展[J].医学综述,2009,15(13):1992-1994.
[4] 李刚,张倞,张杨,等.兔腹腔异位心脏移植模型的建立方法比较[J].同济大学学报:医学版,2007,28(6):44-48.
[5] 庄红明,朱洪荫,牛星焘,等.家兔同种心脏异位移植术[J].中国病理生理杂志,1988,4(1):60-62.
[6] Esper E,Filer S R,Wardrip C L,et al.Modified technique for abdominal heterotopic cardiac transplantation in the rabbit[J].Lab Anim Sci,1998,48(2):201-205.
[7] Makowka L,Zerbe T R,Chapman F,et al.Prolonged rat cardiac preservation with UW lactobionate solution[J].Transplant Proc,1989,21(1 Pt 2):1350-1352.
[8] Gaubin-Blanquet Y,Pianezzi B,Massue J P.Influence of various physical factors on the developmental capacities of the ovum of Artemia salina[J].C R Seances Soc Biol Fil,1976,170(6):1305-1301.
[9] Tenhunen R,Marver H S,Schmid R.The enzymatic conversion of heme to bilirubin by microsomal heme oxygenase[J].Proc Natl Acad Sci U S A,1968,61(2):748-755.
[10]Chien J W,Sullivan K M.Carbon monoxide diffusion capacity:how low can you go for hematopoietic cell transplantation eligibility? [Z].2009,15(4):447-453.
[11] Bojakowski K,Gaciong Z,Grochowiecki T,et al.Carbon monoxide may reduce ischemia reperfusion injury:a case report of complicated kidney transplantation from a carbon monoxide poisoned donor[J].Transplant Proc,2007,39(9):2928-2929.
[12] Hirano K,Sato Y,Kobayashi T,et al.Carbon monoxide hemoglobin and bilirubin metabolism in adult living-related liver transplantation[J].Hepatogastroenterology,2003,50(54):1745-1748.
[13] Jamieson R W,Friend P J.Organ reperfusion and preservation[J].Front Biosci,2008,13:221-235.
[14] Ozaki K S,Kimura S,Murase N.Use of carbon monoxide in minimizing ischemia/reperfusion injury in transplantation[J].Transplant Rev(Orlando),2012,26(2):125-139.
[15] Clark J E,Naughton P,Shurey S,et al.Cardioprotective actions by a water-soluble carbon monoxide-releasing molecule[J].Circ Res,2003,93(2):e2-e8.
[16]夏中元,王宇,刘菊英.厌氧培养箱法建立大鼠心肌细胞缺氧/复氧损伤模型[J].临床误诊误治,2013,26(10):102-104.
[17] Hatayama N,Yoshida Y,Seki K.A study on the perfusion preservation,resuscitation,and transplantation of a rat heart isolated for 96 hours[J].Cell Transplant,2009,18(5):529-534.
[18] Yoshida Y,Hatayama N,Seki K.Study on the preservation with CO(PCO=200-2,000 hPa),resuscitation,and heterotopic transplantation of an isolated rat heart[J].Cell Transplant,2009,18(5):535-540.
[19] Chu W M.Tumor necrosis factor[J].Cancer Lett,2013,328(2):222-225.
[20] Shuh M,Bohorquez H,Loss G E Jr,et al.Tumor necrosis factor-alpha:life and death of hepatocytes during liver ischemia/reperfusion injury[J].Ochsner J,2013,13(1):119-130.
[21]Kumar A,Thota V,Dee L,et al.Tumor necrosis factor alpha and interleukin 1beta are responsible for in vitro myocardial cell depression induced by human septic shock serum[J].J Exp Med,1996,183(3):949-958.

