Fe3O4纳米颗粒-蛋白的相互作用及生物效应
夏 凯 孔华庭 崔之芬 张 瑜 潘 亮 诸 颖
1(中国科学院上海应用物理研究所 物理生物学室生物成像中心,上海同步辐射光源 上海 201800)
2(中国科学院大学 北京 100049)
Fe3O4纳米颗粒-蛋白的相互作用及生物效应
夏 凯1,2孔华庭1,2崔之芬1张 瑜1,2潘 亮1,2诸 颖1
1(中国科学院上海应用物理研究所 物理生物学室生物成像中心,上海同步辐射光源 上海 201800)
2(中国科学院大学 北京 100049)
研究了在生物医学领域广泛应用的Fe3O4纳米颗粒与多种蛋白(包括白蛋白、纤维蛋白和免疫球蛋白等)的相互作用及其生物学效应,结果发现Fe3O4纳米颗粒与蛋白的相互作用存在蛋白种类选择性,对蛋白的吸附能力由强到弱依次为纤维蛋白>免疫球蛋白>白蛋白。形成的Fe3O4纳米颗粒-蛋白复合物有效地降低了纳米颗粒的细胞毒性。
Fe3O4纳米颗粒,蛋白,吸附,选择性,细胞毒性
众所周知,生命体系富含多种蛋白,纳米颗粒由于小尺寸、大比表面积和高的吸附活性,很容易和生命体系中的各种蛋白分子发生相互作用,形成纳米颗粒-蛋白复合物[9–13]。因此,在Fe3O4纳米颗粒的生物安全性评估中,首先研究其和生命体系中多种蛋白的相互作用及生物效应具有十分重要的意义。
本工作以粒径为5nm的Fe3O4为研究对象,研究其和多种蛋白包括白蛋白、纤维蛋白和免疫球蛋白等的相互作用,并考察纳米颗粒-蛋白复合物的细胞摄取和生物相容性,研究结果为其更好地应用于生物医药领域打下了基础。
1 实验材料
1.1 实验试剂
粒径为5 nm的 Fe3O4纳米颗粒购于杭州纳晶科技股份有限公司,储存浓度为5mg·mL−1。表面修饰羧基(–COOH),在水中及培养基中的分散性良好,室温避光保存。
白蛋白、纤维蛋白和免疫球蛋白购于sigma-aldrich西格玛奥德里奇(上海)贸易有限公司。
3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑嗅盐(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazo lium bromide, MTT)、十二烷基磺酸钠(Sodium Dodecyl Sulfonate, SDS)购自Sigma上海公司;Dulbecco's modified Eagle's medium (DMEM, Gibco, Grand Island, NY, USA)培养基、胎牛血清、青链霉素、0.25% EDTA (Eathylene Diamine Tetraacetic Acid)胰蛋白酶、谷氨酰胺购自Life technologies上海公司;10×磷酸盐缓冲液(Phosphate Buffered Saline, PBS)、Bradford蛋白浓度测定试剂盒、SDS-PAGE (Sodium Dodecyl Sulfonate-Polyacrylamide Gelelectrophoresis)凝胶配制试剂盒、考马斯亮蓝快速染色液购自碧云天生物技术研究所;超薄镀碳支持膜购于中镜科仪南京公司。
安全头盔的颜色设计十分重要,因为色彩和人们的情绪有很大的联系。在日常生活中,色彩的效果主要是,一加深视觉上的外观感染力;二增强人们对产品的认知及记忆;三影响人们的情绪及内心情感[5]。在交通道路上,因为颜色而引起的事故不在少数。澳大利亚莫纳什大学有过相关研究,通过分析了八十五万起的交通事故记录,发现了黑色的汽车在白天和黑夜发生事故的概率都远远地高于其他颜色的车辆。不只是莫纳什大学有过研究,很多团队都有相关的调查,调查的结果都指向了黑色的汽车发生事故的概率更大。颜色与事故发生率之间有什么关系呢?通常来说,有两个原因。一是颜色带来的心理效应,二是各种环境下颜色的视认性[6]。
1.2 主要仪器
二氧化碳细胞培养箱(3423):Thermo Scientific;高速离心机(CT 15RE):Hitachi;超纯水仪(Advantage A10):Millipore;荧光酶标仪(Synergy H1):Biotek;倒置明场显微镜(CKX41):Olympus。
2 实验方法
2.1 Fe3O4纳米颗粒及Fe3O4纳米颗粒-蛋白复合物的电镜表征
Fe3O4纳米颗粒以10μg·mL−1的浓度分散于超纯水中,超声30min使之分散均匀。2mg·mL−1的Fe3O4纳米颗粒与1mg·mL−1的蛋白等体积混匀,25 °C孵育过夜,15 000r·min−14 °C离心30min,收集沉淀。将沉淀以10μg·mL−1的浓度重悬于超纯水中,超声30min使其分散均匀。将Fe3O4纳米颗粒、Fe3O4纳米颗粒-蛋白复合物滴于超薄碳膜上,用透射电子显微镜(Transmission Electron Microscope, TEM)进行观察。
2.2 Fe3O4纳米颗粒与蛋白的相互作用
2mg·mL−1的Fe3O4纳米颗粒与1mg·mL−1的蛋白等体积混匀,25 °C孵育过夜。15 000r·min−1转速,4°C离心30min,收集上清。上清液用蛋白上样缓冲液(2×)稀释,95°C 10min煮沸变性后SDS-PAGE电泳(SDS-PAGE浓度为12%,电泳条件为20mA,2h)。考马斯亮蓝染色30min,脱色后于成像仪中观察蛋白条带。另外,上清液用Bradford蛋白浓度测定试剂盒定量检测蛋白含量。
2.3 细胞培养
人宫颈癌细胞(HeLa细胞),购于中国科学院上海典型培养物保藏委员会细胞库。将HeLa细胞培养于DMEM培养基中,加有100μg·mL−1的链霉素,100U·mL−1的青霉素,4mmol·L−1的谷氨酰胺,4.5mg·mL−1的葡萄糖,10%热灭活胎牛血清(Fetal Bovine Serum, FBS)。细胞培养于5% CO2和37 °C恒温恒湿培养箱中。每两天进行一次细胞传代,从而保持细胞稳定生长。
2.4 Fe3O4纳米颗粒的细胞毒性评估
将HeLa细胞种于24孔板中,每孔细胞密度为105,贴壁过夜。吸去培养基,用PBS缓冲溶液漂洗两遍,每孔中加入一定量有血清或无血清培养基分散的Fe3O4纳米颗粒,Fe3O4纳米颗粒终浓度为50μg·mL−1、100μg·mL−1、150μg·mL−1、200μg·mL−1、250μg·mL−1、300μg·mL−1、350μg·mL−1和400μg·mL−1。分别以不加纳米颗粒的有血清或无血清培养基作为对照。24h后,使用PBS缓冲溶液漂洗三次,每孔加入440μL新鲜培养基与60μL MTT(终浓度为0.6mg·mL−1),继续孵育4h至产生紫色甲瓒结晶,每孔加入500μL的酸化SDS溶液(pH 3.0–4.0),孵育至紫色甲瓒结晶溶解。酶标仪测OD 570nm吸光值。细胞存活率的计算为:细胞存活率(%)=(实验组OD值−空白组OD值)/(对照组OD值−空白组OD值)×100%。
2.5 光学显微镜观察细胞摄取Fe3O4纳米颗粒-蛋白复合物
2mg·mL−1的Fe3O4纳米颗粒与1mg·mL−1的三种蛋白等体积混匀,25 °C孵育过夜,使Fe3O4纳米颗粒和蛋白质充分吸附,15000 r·min−14 °C 离心30min,沉淀用PBS缓冲液洗涤三遍,得到Fe3O4纳米颗粒-蛋白复合物。
HeLa细胞用24孔板培养,密度为105细胞/孔种板,贴壁过夜。将Fe3O4纳米颗粒和Fe3O4纳米颗粒-蛋白复合物分散于无血清培养基中,各组中纳米颗粒的终浓度均为200μg·mL−1,混匀置于培养箱中培养24h。PBS洗涤三次除去细胞表面及培养板中游离的Fe3O4纳米颗粒和Fe3O4纳米颗粒-蛋白复合物,每孔加入1mL PBS缓冲液,使用倒置光学显微镜(200×)观察。
2.6 Fe3O4纳米颗粒-蛋白复合物的细胞毒性评估
Fe3O4纳米颗粒和Fe3O4纳米颗粒-蛋白复合物与细胞的孵育过程同上,孵育结束后,MTT法检测细胞存活率,方法同§2.4。
3 实验结果
3.1 Fe3O4纳米颗粒对HeLa细胞的毒性效应
TEM结果显示(图1),实验所用Fe3O4纳米颗粒平均粒径为5nm,颗粒大小均一,无杂质。对Fe3O4纳米颗粒的细胞毒性进行评估(图2)发现,当颗粒浓度低于100μg·mL−1时,无论培养基中是否含有血清,均显示很好的生物相容性。当浓度高于150μg·mL−1时,纳米颗粒对细胞具有浓度依赖的毒性效应。有意思的是,纳米颗粒分散在有血清培养基中的细胞毒性显著低于其分散在无血清培养基中的细胞毒性。例如,当Fe3O4纳米颗粒浓度为200μg·mL−1时,无血清培养基分散的纳米颗粒和细胞孵育后存活率为33.7%,有血清培养基分散的纳米颗粒和细胞孵育后存活率为76.9%,后者是前者的两倍多。

图1 Fe3O4纳米颗粒透射电镜成像图Fig.1 TEM image of Fe3O4 nanoparticles.
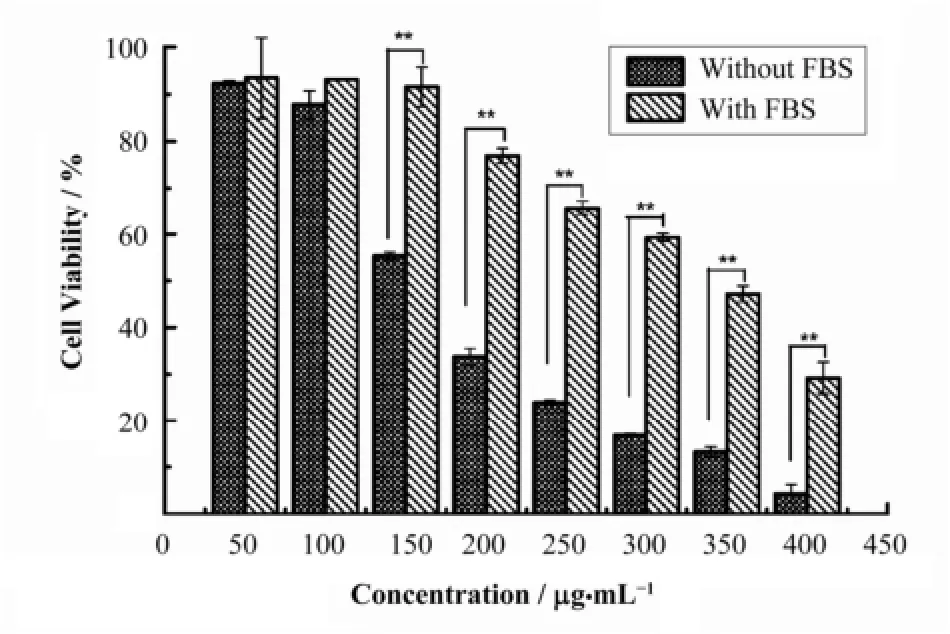
图2 含或不含血清培养液中Fe3O4纳米颗粒对HeLa细胞的毒性*р< 0.05;**р< 0.01;单因素ANOVA (Analysis of Variance)分析用于显著性分析Fig.2 Cytotoxicity of Fe3O4 nanoparticles dispersed in culture medium with or without FBS. *р< 0.05; **р< 0.01; one-way ANOVA for comparison
3.2 Fe3O4纳米颗粒与蛋白的相互作用
实验发现,Fe3O4纳米颗粒和蛋白孵育后,对各种蛋白均有一定吸附。TEM成像(图3)可见各种蛋白包裹在Fe3O4纳米颗粒表面,形成了透明的蛋白冠,图3中黑色箭头指示蛋白冠。

图3 Fe3O4纳米颗粒-蛋白复合物的透射电镜成像图(a) Fe3O4-白蛋白复合物,(b) Fe3O4-免疫球蛋白复合物,(c) Fe3O4-纤维蛋白复合物Fig.3 TEM images of Fe3O4 nanoparticle-protein complexes.(a) Fe3O4-albumin complex, (b) Fe3O4-immunoglobulincomplex, (c) Fe3O4-fibrinogen complex
Fe3O4纳米颗粒与蛋白作用后,分别用SDS-PAGE蛋白电泳和Bradford蛋白浓度定量法对上清蛋白浓度进行半定量和定量检测。SDS-PAGE蛋白电泳结果显示(图4(a),第1、3、5泳道分别为吸附前总的白蛋白、免疫球蛋白和纤维蛋白;第2、4、6泳道分别为吸附后上清中的白蛋白、免疫球蛋白和纤维蛋白),Fe3O4纳米颗粒对纤维蛋白吸附最多,其次是免疫球蛋白,最少的是白蛋白。Bradford法定量分析显示(图4(b)),每毫克Fe3O4纳米颗粒吸附白蛋白、免疫球蛋白、纤维蛋白的量分别为0.023mg、0.21mg和0.44mg,和蛋白电泳结果一致。
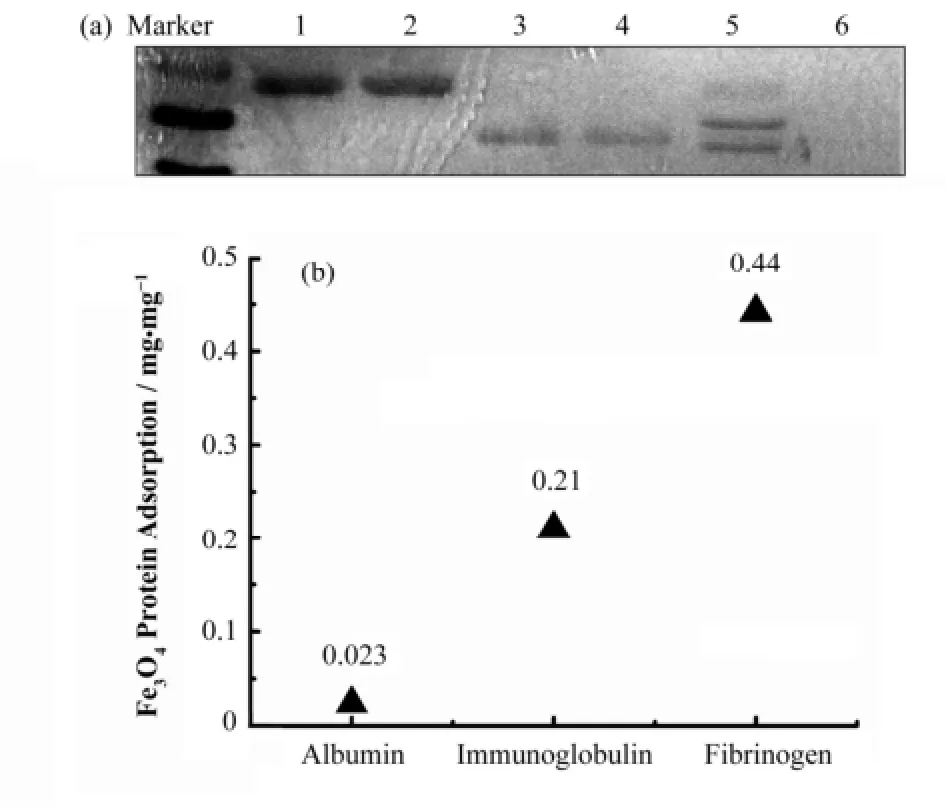
图4 Fe3O4纳米颗粒对不同蛋白的吸附(a) SDS-PAGE蛋白电泳分析,(b) Bradford蛋白浓度定量分析Fig.4 Adsorption amounts of various kinds of proteins on Fe3O4 nanoparticles.(a) SDS-PAGE analysis, (b) Bradford analysis
3.3 Fe3O4纳米颗粒-蛋白复合物的细胞生物学效应
Fe3O4纳米颗粒-蛋白复合物和HeLa细胞孵育24h后,倒置光学显微镜观察结果显示各种Fe3O4纳米颗粒-蛋白复合物均能被摄取进入到细胞内(图5)。进一步评估各种Fe3O4纳米颗粒-蛋白复合物的生物相容性。MTT测定结果显示,200μg·mL−1的裸露的Fe3O4纳米颗粒和细胞孵育24h后,细胞存活率仅为33.7%,而相同浓度的Fe3O4-白蛋白和细胞孵育24h后,细胞存活率上升为76.9%,Fe3O4-免疫球蛋白、Fe3O4-纤维蛋白复合物和细胞孵育后,存活率均超过了90%(图6),可见Fe3O4纳米颗粒上吸附的蛋白有效地降低了纳米颗粒的细胞毒性,并且毒性减弱的程度和纳米颗粒吸附蛋白的量有一定的相关性。

图5 Fe3O4纳米颗粒和Fe3O4纳米颗粒-蛋白复合物与Hela细胞孵育后光学显微成像图(a) Fe3O4纳米颗粒,(b) Fe3O4-白蛋白复合物,(c) Fe3O4-免疫球蛋白复合物,(d) Fe3O4-纤维蛋白复合物Fig.5 Optical microscope images of HeLa cells after incubation with Fe3O4 nanoparticles and various kinds Fe3O4 nanoparticle-protein complexes. (a) Fe3O4 nanoparticles, (b) Fe3O4-albumin complex, (c) Fe3O4-immunoglobulin complex, (d) Fe3O4-fibrinogen complex

图6 Fe3O4和蛋白相互作用对细胞毒性的影响*р< 0.05;**р< 0.01;单因素ANOVA 分析用于显著性分析Fig.6 Effect of proteins on the cytotoxicity of Fe3O4 nanoparticles. *р< 0.05; **р< 0.01; one-way ANOVA for comparison
4 讨论
纳米颗粒的生物安全性研究是一个十分重要的课题。本工作以粒径为5nm的Fe3O4纳米颗粒为研究对象,评估了其对HeLa细胞的毒性效应,实验结果和文献报道相一致[7−8],该颗粒在一定浓度范围内对细胞具有良好的生物相容性。但是,实验中也发现,当颗粒浓度高于150μg·mL−1时,其对细胞具有浓度依赖的毒性效应,且无血清培养基分散的纳米颗粒的细胞毒性显著高于有血清培养基分散的纳米颗粒的细胞毒性。
我们进一步对机制进行了分析。实验中选取了血清中三种代表性的蛋白包括白蛋白、免疫球蛋白和纤维蛋白,研究了纳米颗粒和蛋白的相互作用,发现纳米颗粒对各种蛋白均有一定吸附,根据蛋白种类不同,吸附量也不同。该纳米颗粒对各种蛋白吸附能力由高到低依次为纤维蛋白>免疫球蛋白>白蛋白。形成的Fe3O4纳米颗粒-蛋白复合物有效地降低了纳米颗粒的细胞毒性,且毒性减弱的程度和吸附的蛋白的量有一定的相关性。我们知道,胎牛血清中富含白蛋白、免疫球蛋白、纤维蛋白等多种蛋白,因此当纳米颗粒分散在含血清的培养基中时,血清蛋白的包裹能很好地改善纳米颗粒对细胞的生物相容性。
Fe3O4纳米颗粒在成像、药物输运、核磁共振成像、热疗等生物医药领域有广泛应用[14−15]。并且,在体内动物实验中,常需要使用较高的纳米颗粒浓度而达到良好的生物学效果。该工作的结果为进一步设计安全的纳米成像试剂或纳米载体用于药物输运提供了有用的信息。
1 Chen Y, Chen H R, Zeng D P, et al. Core/shell structured hollow mesoporous nanocapsules: a potential platform for simultaneous cell imaging and anticancer drug delivery[J]. ACS Nano, 2010, 4: 6001–6013
2 Yang X Y, Zhang X Y, Ma Y F, et al. Superparamagnetic grapheme oxide-Fe3O4nanoparticles hybrid for controlled targeted drug carriers[J]. Journal of Materials Chemistry, 2009, 19: 2710–2714
3 Mahmoudi M, Milani A S, Stroeve P. Synthesis, surface architecture and biological response of superparamagnetic iron oxide nanoparticles for application in drug delivery[J]. International Journal of Biomedical Nanoscience and Nanotechnology, 2010, 1: 164–201
4 Latham A H, Williams M E. Controlling transport and chemical functionality of magnetic nanoparticles[J]. Accounts of Chemical Research, 2008, 41: 411–420
5 Torres L M, Rinaldi C. Thermal potentiation of chemotherapy by magnetic nanoparticles[J]. Nanomedicine, 2013, 8: 1689–1707
6 Mahmoudi M, Simchi A, Imani M. Cytotoxicity of uncoated and polyvinyl alcohol coated superparamagnetic iron oxide nanoparticles[J]. The Journal of Physical Chemistry C, 2009, 113: 9573–9580
7 Ankamwar B, Lai T C, Huang J H, et al. Biocompatibility of Fe3O4nanoparticles evaluated by in vitro cytotoxicity assays using normal, glia and breast cancer cells[J]. Nanotechnology, 2010, 21: 1–9
8 Hussain S M, Hess K L, Gearhart J M, et al. In vitro toxicity of nanoparticles in BRL 3A rat liver cells[J]. Toxicology in Vitro, 2005, 19: 975–983
9 Nel A E, Mädler L, Velegol D, et al. Understanding biophysicochemical interactions at the nano-bio interface[J]. Nature Materials, 2009, 8: 543–557
10 Zhu Y, Cai X Q, Li J, et al. Synchrotron-based X-ray microscopic studies for bioeffects of nanomaterials[J]. Nanomedicine: Nanotechnology, Biology, and Medicine, 2014, 10: 515–524
11 Zhu Y, Li W X, Zhang Y, et al. Excessive sodium ions delivered into cells by nanodiamonds: implications for tumor therapy[J]. Small, 2012, 8: 1771–1779
12 Li J, Zhu Y, Li W X, et al. Nanodiamonds as intracellular transporters of chemotherapeutic drug[J]. Biomaterials, 2010, 31: 8410–8418
13 Lynch I, Dawson K A. Protein-nanoparticle interactions[J]. Nano Today, 2008, 3: 40–47
14 Hao R, Xing R J, Xu Z C, et al. Synthesis, functionalization, and biomedical applications of multifunctional magnetic nanoparticles[J]. Advanced Materials, 2010, 22: 2729–2742
15 Chu M Q, Shao Y X, Peng J L, et al. Near-infrared laser light mediated cancer therapy by photothermal effect of Fe3O4magnetic nanoparticles[J]. Biomaterials, 2013, 34: 4078–4088
CLC TL99, Q67
Fe3O4nanoparticle-protein interactions and their bioeffects
XIA Kai1,2KONG Huating1,2CUI Zhifen1ZHANG Yu1,2PAN Liang1,2ZHU Ying1
1(Division of Physical Biology and Bioimaging Center, Shanghai Synchrotron Radiation Facility, Shanghai Institute of Applied Physics, Chinese Academy of Sciences, Shanghai 201800, China)
2(University of Chinese Academy of Sciences, Beijing 100049, China)
Background: Fe3O4nanoparticles have wide applications in biomedical researches. Purpose: The aim is to study the Fe3O4nanoparticle-protein interactions and their bioeffects. Methods: Transmission electron microscope (TEM), light microscopy, SDS-PAGE (Sodium Dodecyl Sulfonate-Polyacrylamide Gelelectrophoresis), Bradford and MTT (3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide) methods were used to investigate the Fe3O4nanoparticle-protein interactions and their bioeffects. Results: The adsorption capacities of Fe3O4nanoparticle for different proteins were different, and the order was fibrinogen>immunoglobulin>albumin. The adsorption of proteins on the Fe3O4surface resulted in much reduced cytotoxicity for these protein-coated Fe3O4nanoparticles. Conclusion: These findings suggest that we should take the Fe3O4nanoparticle-protein interactions into consideration when designing safe Fe3O4nanoparticles for biomedical applications.
Fe3O4nanoparticle, Protein, Adsorption, Selectivity, Cytotoxicity
TL99,Q67
10.11889/j.0253-3219.2015.hjs.38.050501
项目(No.11275251、No.U1232113)、上海市青年科技启明星计划(No.14QA1404400)资助
夏凯,女,1989年出生,2012年毕业于安徽师范大学,现为硕士研究生
诸颖,E-mail: zhuying@sinap.ac.cn
2015-01-19,
2015-02-11

