CYP2C19基因多态性与缺血性脑血管病患者PTAS术后氯吡格雷反应性的关联研究
谢 霞,侯华娟,张治中,蔡必扬,张雨蒙,范文平,刘柯婷,戴敏慧,刘新峰
0 引 言
近年来,随着血管内介入技术的发展和新型血管内支架的研制,经皮血管内支架成形术(percutaneous transluminalangioplasty and stenting,PTAS)已经成为治疗缺血性脑血管病的重要手段。但是,支架置入术后常造成血管损伤处的动脉粥样硬化斑块破裂、血管内膜损伤,而暴露于富含各种血小板激活因子的血液中,导致血小板聚集形成血栓,活化的血小板又可进一步激活内源性及外源性凝血途径。因此为了预防PTAS术后支架内血栓形成及支架内再狭窄,指南推荐术后常规联用阿司匹林及氯吡格雷双联抗血小板治疗[1]。因个体对氯吡格雷的反应存在明显的差异性,部分低反应性的患者常易发生支架内血栓[2]。目前对氯吡格雷反应多样性的遗传学研究主要集中于CYP2C19的基因多态性。众多研究已表明CYP2C19同工酶基因的单核苷酸多态性(single nucleotide polymorphism,SNP)与氯吡格雷产生不同程度的抗血小板作用密切相关[3-4];但关于CYP2C19基因多态性与缺血性脑血管病PTAS术患者氯吡格雷反应性的研究较少。因此本研究拟通过评估患者PTAS术后6个月CYP2C19基因多态性与氯吡格雷治疗后血小板高反应性(high ontreatment platelet reactivity,HTPR)的关系及其对PTAS术后支架内再狭窄(in-stent restenosis,ISR)的影响,以期指导今后的抗血小板药物个体化治疗。
1 资料与方法
1.1 研究对象 连续性纳入2011年1月至2014年3月在南京军区南京总医院神经内科行PTAS术的缺血性脑血管病患者145例。纳入标准:①汉族;②年满18周岁;③确诊为缺血性卒中,经脑动脉数字减影血管造影(digital subtraction angiography,DSA)证实为颅内外动脉狭窄(症状性狭窄>50%或无症状性狭窄>70%);④术后遵医嘱规律服用氯吡格雷(75 mg/d)和阿司匹林(100 mg/d)双联抗血小板治疗6个月。排除标准:①对阿司匹林、氯吡格雷过敏或不能耐受者、低分子肝素禁忌证者;②血小板计数<100×109/L或>450×109/L,凝血功能障碍或有出血倾向者;③严重肝肾功能不良或心功能III级以上。入组患者平均年龄为(64.2±8.9)岁,男96例,女49例。其中高血压病95例(65.5%),糖尿病45例(31%),高脂血症40例(27.6%)。145例患者共置入支架174枚,其中颅外支架111枚(76.6%),所有患者均成功施行PTAS术,均无血管破裂、血管夹层、肾功能损害等非神经系统并发症及手术相关神经功能缺损或症状恶化。根据CYP2C19*2基因分型结果:将患者分为野生型组(CYP219*1/*1,69例)和突变组(杂合突变型CYP2C19*1/*2与纯合突变型CYP2C19*2/*2,76例)。2组患者临床基线资料差异均无统计学意义(P>0.05),见表1。本研究经南京军区南京总医院伦理委员会批准(批准号:812201080088),所有入选患者均签署知情同意书。
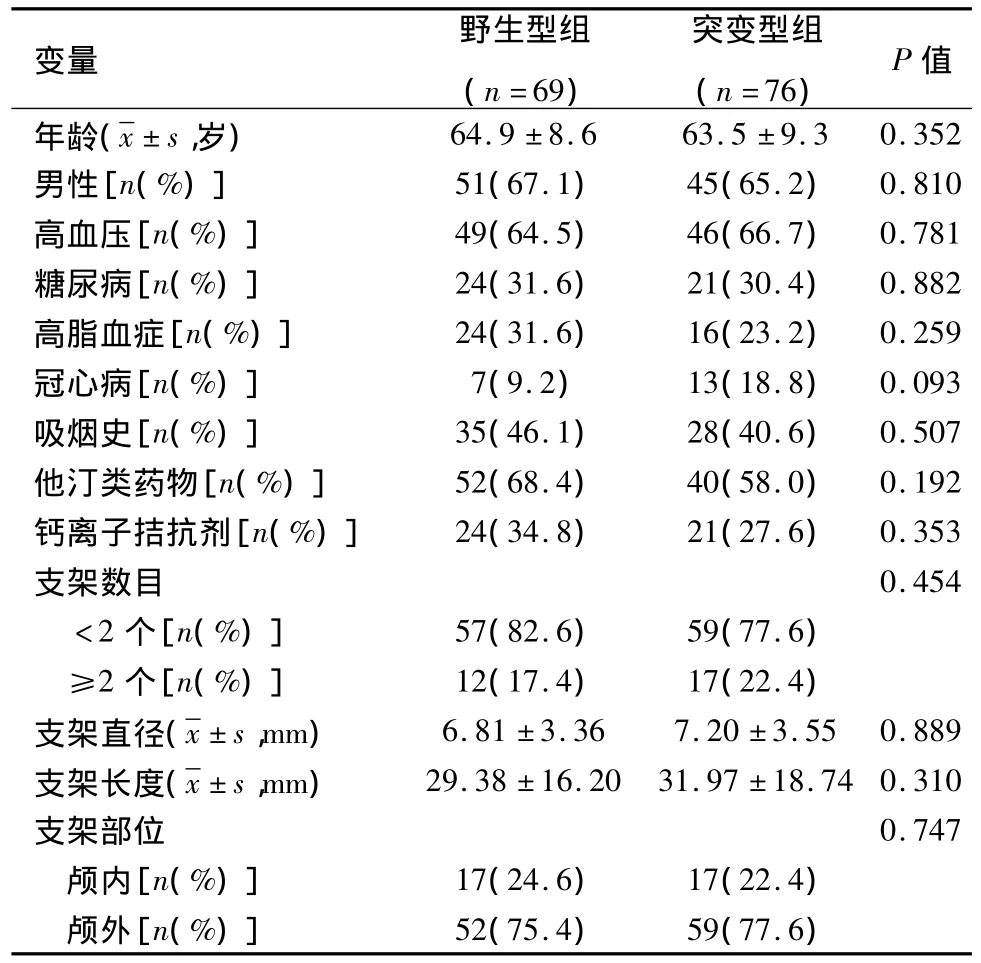
表1 行PTAS术缺血性脑血管病患者各组临床基线资料的比较Table 1 Baseline characteristicsstratified based on CYP2C19 polymorphism
1.2 研究方法
1.2.1 基线资料收集 ①基本信息如性别、年龄等;②既往病史如糖尿病病史、高血压史、吸烟史、饮酒史;实验室常规检查项目如血糖、血脂等;③PTAS手术情况如支架置入数量、部位等临床资料。
1.2.2 全脑血管造影及支架置入术 PTAS术前予口服阿司匹林(100~300 mg)及氯吡格雷(75~300 mg)24 h以上或阿司匹林(100 mg/d)及氯吡格雷(75 mg/d)4 d以上。根据DSA结果决定PTAS方式,由经验丰富的血管内介入治疗医师参照现行指南标准操作。支架置入后造影确定支架位置和残余狭窄。PTAS术后联用维持剂量氯吡格雷(75 mg/d)和阿司匹林(100 mg/d)6个月,常规复查DSA评估支架内有无再狭窄。
1.2.3 血小板抑制率的检测方法 采用TEG仪(型号:GE5000,Haemoscope公司,美国)检测。试剂包括:花生四烯酸、二磷酸腺苷(adenosine diphosphate,ADP)、激活剂F(由蝮蛇血凝酶和血小板XIIIa因子混合而成)、高岭土(含1%kaolin液)。分别用3.2%枸橼酸钠和肝素钠抗凝管抽取患者空腹静脉血液2 mL。采血后2h内使用TEG4个通道进行检测,TEG软件根据检测结果自动计算出血小板ADP受体抑制率。
1.2.4 DNA提取及基因型测定 乙二胺四乙酸抗凝管抽取患者空腹外周血2 mL,采用DNA试剂盒[天根生化科技(北京)有限公司]提取全血基因组DNA并将浓度标化至10 ng/μL。采用多重高温连接酶检测反应技术进行基因型测定。设立空白对照样本并随机选取10%重复样本,评价基因检测结果的可靠性。
1.2.5 评定标准 成功施行PTAS定义为颅外动脉残余狭窄<30%,颅内动脉术后狭窄程度较术前至少降低50%。支架内再狭窄标准[5]:①颅外动脉:经DSA证实的支架内及支架附近5 mm内管腔直径狭窄≥50%;②颅内动脉:置入支架附近5mm内直径狭窄≥50%或血管绝对管径较术后减少>20%。判定颅内外动脉狭窄程度分别采用WASID[6]和 NASCET[7]标准。参照既往文献[8-9]将TEG检测的血小板ADP受体抑制率<30%定义为氯吡格雷HTPR。
1.3 统计学分析 采用SPSS21.0统计学软件进行分析。计量资料符合正态分布时以均数±标准差(±s)表示,2组间均数比较用t检验。计数资料以频数和率表示,组间比较采用χ2检验或Fisher精确概率法。Hardy-Weinberg(H-W)遗传平衡采用χ2检验。多因素Logistic回归分析HTPR发生的相关危险因素。以P≤0.05为差异有统计学意义。
2 结 果
2.1 基因分型结果 CYP2C19*2最小等位基因频率为32.8%。野生型69例、杂合突变型57例、纯合突变型19例。CYP2C19*2位点基因型分布符合Hardy-Weinberg平衡(P>0.05),样本的群体代表性良好。
2.2 基因型与氯吡格雷反应性 突变组血小板ADP受体抑制率较野生型组明显减弱[(45.22±22.96)%vs(58.43 ±21.98)%,P=0.001]。突变组中杂合突变型为(47.80±22.93)%,纯合突变型为(37.53±21.84)%。所有患者HTPR发生率为26.9%(39例),突变组HTPR发生率高于野生型组(35.5%vs17.4%,P=0.014)。杂合突变型为29.8%(17/57),纯合突变型为 52.6%(10/19)。单因素Logistic回归分析结果显示,只有携带CYP219*2等位基因与氯吡格雷HTPR发生相关,见表2。多因素Logistic回归分析结果显示,携带CYP219*2等位基因为PTAS术后6个月氯吡格雷HTPR的独立预测因素(OR=2.356,95%CI:1.053 ~5.272),见表3。
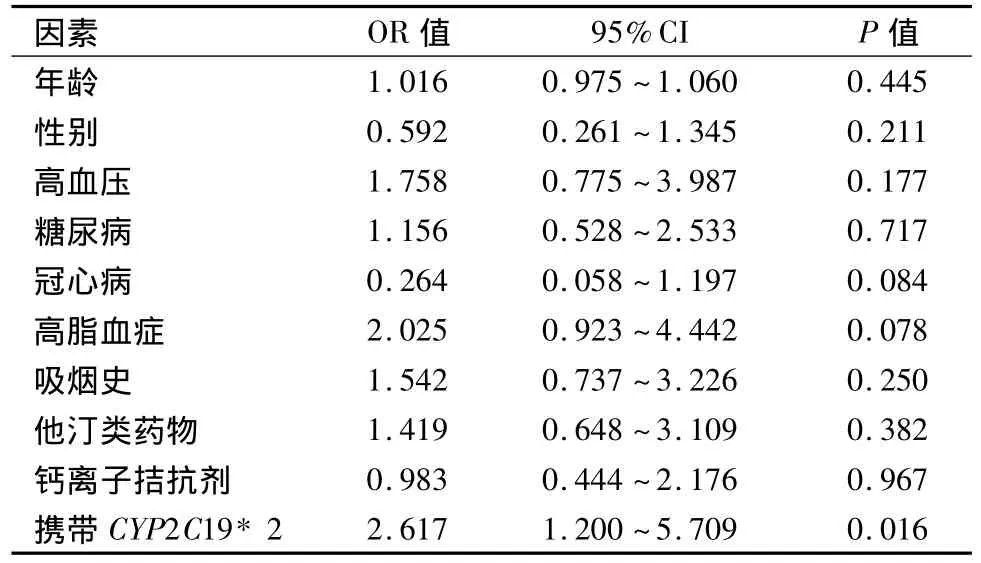
表2 行PTAS术缺血性脑血管病患者氯吡格雷治疗后HTPR影响因素的单因素回归分析结果Table 2 Logistic analysis of factors associated with HTPR
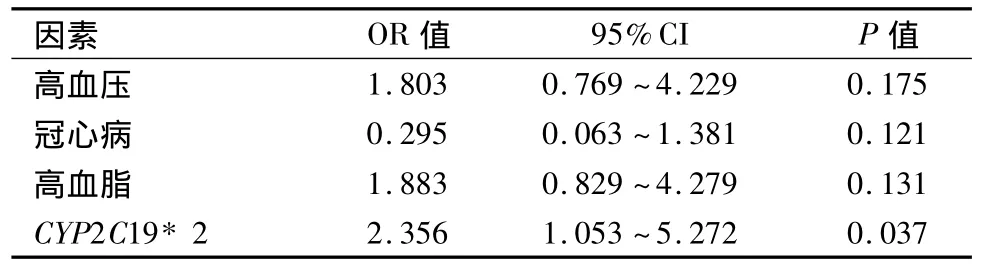
表3 行PTAS术缺血性脑血管病患者氯吡格雷治疗后HTPR多因素Logistic回归分析结果的因素Table 3 Multivariate Logistic regression analysis of factors associated with HTPR
2.3 基因型与ISR发生率 根据PTAS术后6个月的DSA结果,10例(6.9%)患者发生 ISR,颅内外PTAS发生率分别为20.6%和2.7%。突变型基因(CYP2C19*2)ISR发生率较野生型患者高(11.8%vs 1.4%,P=0.019)。
3 讨 论
本研究发现,在PTAS术后长期服用氯吡格雷抗血小板的患者中,CYP2C19*2基因型携带者血小板抑制功能减弱,氯吡格雷治疗后HTPR发生率增高,且与PTAS术后支架内再狭窄的发生有一定的相关性。
目前用于检测血小板功能的方法多样,对于检测时间、HTPR定义均无统一公认的标准。部分研究表明氯吡格雷反应性存在时间依赖性,Campo G等[10]通过分别检测患者PCI术前、术后1个月及术后6个月的血小板功能,发现患者术后半年氯吡格雷抗血小板聚集作用基本稳定。TEG具有可操作性强,重复性好等优点,因此本研究选择于患者术后6个月时通过TEG在来检测氯吡格雷的反应性。
CYP2C19是氯吡格雷发挥抗血小板作用的关键酶,在氯吡格雷经肝两步氧化代谢转化为活性代谢产物过程中,分别有45%和20%由CYP2C19基因编码的蛋白介导[11]。CYP2C19*2为其最主要的突变体,其突变机制为第5外显子681位碱基G突变为A,使外显子5'端前40bp的碱基发生缺失,从而改变 mRNA阅读框架,导致蛋白合成提前终止[12]。携带CYP2C19无功能等位基因的患者,氯吡格雷活性代谢产物减少,抑制血小板功能下降25% ~33%[13]。本研究患者的 CYP2C19*2最小等位基因频率为32.8%,等位基因分布与既往中国人群的研究报道相似[14-15]。通过多因素Logistic回归分析校正既往文献中报道的危险因素如年龄、性别、基础疾病、药物相互作用等因素后发现CYP2C19*2基因多态性与HTPR的发生显著相关。
支架置入术后再狭窄是脑血管介入治疗的一大难题,高龄、糖尿病、吸烟、支架置入数量及部位可能与ISR有关[16]。本研究入选患者PTAS术后6个月复查DSA结果显示有10例患者发生ISR,颅内外PTAS发生率分别为20.6%和 2.7%,颅内动脉PTAS术后 ISR发生率高于颅外动脉。携带CYP2C19*2等位基因患者ISR发生率高于野生型患者,提示CYP2C19*2基因携带者可能因其血小板抑制功能降低而ISR发生率增高。
本研究仍存在以下不足之处:①仅对CYP2C19的单个SNP位点进行了检测,尚需增加样本量来探讨多个位点基因多态性与氯吡格雷反应性的关系;②只采用了TEG一种方法来检测血小板抑制率,可能存在一定的局限性;③本研究为小样本回顾性研究,仍需大样本研究来进一步证实。
[1] 中华医学会神经病学分会脑血管病学组缺血性脑血管病血管内介入诊疗指南撰写组.中国缺血性脑血管病血管内介入诊疗指南[Z].2011,44,863-869.
[2] Campo G,Fileti L,de Cesare N,et al.Long-term clinical outcome based on aspirin and clopidogrel responsiveness status after elective percutaneous coronary intervention:a 3T/2R(tailoring treatment with tirofiban in patients showing resistance to aspirin and/or resistance to clopidogrel)trial substudy[J].J Am Coll Cardiol,2010,56(18):1447-1455.
[3] Collet JP,Hulot JS,Pena A,et al.Cytochrome P450 2C19 polymorphism in young patients treated with clopidogrel after myocardial infarction:a cohort study[J].Lancet,2009,373(9660):309-317.
[4] Mega JL,Simon T,Collet JP,et al.Reduced-function CYP2C19 genotype and risk of adverse clinical outcomes among patients treated with clopidogrel predominantly for PCI:a meta-analysis[J].JAMA,2010,304(16):1821-1830.
[5] Albuquerque FC,Levy EI,Turk AS,et al.Angiographic patterns of Wingspan in-stent restenosis[J].Neurosurgery,2008,63(1):23-28.
[6] Kasner SE,Lynn MJ,Chimowitz MI,et al.Warfarin vs aspirin for symptomatic intracranial stenosis:subgroup analyses from WASID[J].Neurology,2006,67(7):1275-1278.
[7] Moneta GL,Edwards JM,Chitwood RW,et al.Correlation of North American Symptomatic Carotid Endarterectomy Trial(NASCET)angiographic definition of 70%to 99%internal carotid artery stenosis with duplex scanning[J].J Vasc Surg,1993,17(1):152--159.
[8] Bliden KP,Dichiara J,Tantry US,et al.Increased risk in patients with high platelet aggregation receiving chronic clopidogrel therapy undergoing percutaneous coronary intervention:is the current antiplatelet therapy adequate?[J] J Am Coll Cardiol,2007,49(6):657-666.
[9] Fu Z,Dong W,Shen M,et al.Relationship between hyporesponsiveness to clopidogrel measured by thrombelastography and in stent restenosis in patients undergoing percutaneous coronary intervention[Z].2014,47,197-202.
[10] Campo G,Parrinello G,Ferraresi P,et al.Prospective evaluation of on-clopidogrel platelet reactivity over time in patients treated with percutaneous coronary intervention relationship with gene polymorphisms and clinical outcome[J].J Am Coll Cardiol,2011,57(25):2474-2483.
[11] Kazui M,Nishiya Y,Ishizuka T,et al.Identification of the human cytochrome P450 enzymes involved in the two oxidative steps in the bioactivation of clopidogrel to its pharmacologically active metabolite[J].Drug Metab Dispos,2010,38(1):92-99.
[12] Frere C,Cuisset T,Morange P E,et al.Effect of cytochrome p450 polymorphisms on platelet reactivity after treatment with clopidogrel in acute coronary syndrome[J].Am J Cardiol,2008,101(8):1088-1093.
[13] Mega JL,Close SL,Wiviott SD,et al.Cytochrome p-450 polymorphisms and response to clopidogrel[J].N Engl J Med,2009,360(4):354-362.
[14] Zhang L,Chen Y,Jin Y,et al.Genetic determinants of high ontreatment platelet reactivity in clopidogrel treated Chinese patients[J].Thromb Res,2013,132(1):81-87.
[15] Li X,Zhang L,Chen X,et al.PON1 Q192R genotype influences clopidogrel responsiveness by relative platelet inhibition instead of on-treatment platelet reactivity[J].Thromb Res,2013,132(4):444-449.
[16] Zhu SG,Zhang RL,Liu WH,et al.Predictive factors for instent restenosis after balloon-mounted stent placement for symptomatic intracranial atherosclerosis[J].Eur J Vasc Endovasc Surg,2010,40(4):499-506.

