膜性肾病合并新月体形成的临床病理分析
钱玉珺,左 科,李世军,李晓梅,曾彩虹,刘志红,吴 燕
0 引 言
膜性肾病(membranous nephropathy,MN)是成人最常见的肾小球疾病之一,临床表现以肾病综合征或大量蛋白尿为主,可继发于自身免疫疾病、慢性感染、肿瘤、药物等[1]。特发性膜性肾病(idiopathic membranous nephropathy,IMN)肾组织病理中无明显增殖性病变,若肾小球膜性病变合并内皮增殖、袢坏死、新月体形成,高度考虑为继发性MN或合并其他类型肾病,如抗 GBM 肾炎[2-5]、系统性血管炎[6-9]及 IgA 肾病[10-11]。但在临床上,少数合并新月体形成的MN患者反复筛查未找到继发性MN证据,亦非抗GBM肾炎、系统性血管炎、IgA肾病等,且部分患者血清抗磷脂酶A2受体(phospholipase A2receptor,PLA2R)阳性。对于该类患者的临床病理特征鲜有报道[12]。本研究回顾性分析此类MN合并新月体病例,对其临床病理特点及预后进行分析。
1 资料与方法
1.1 研究对象 回顾性分析2005年4月至2014年3月在我科行肾活检示MN的患者。入选标准:①患者肾活检示肾小球膜性病变(毛细血管袢上皮侧有免疫复合物沉积)同时合并有新月体形成;②患者无自身免疫性疾病;③患者无病毒性肝炎;④患者无甲状腺及其他部位肿瘤;⑤患者无有机溶剂、重金属中毒。排除抗GBM肾炎、系统性血管炎、IgA肾病后的53例患者。以同期随机选取的100例无新月体形成的IMN为对照组,比较其临床病理特点及预后。
1.2 临床资料与实验室指标 统计患者性别、活检时年龄,有无肾外损害、高血压、外周水肿、肾功能不全(包括急性与慢性);肾活检及随访时的血肌酐、据CKD-EPI公式评估的肾小球滤过率(eGFR)、血清蛋白、抗 PLA2R、ANA、ANCA、抗 GBM、24 h 尿蛋白定量、尿沉渣红细胞计数。肾功能不全定义为eGFR<60mL/(min·1.73 m2)。终末期肾病(end stage renal disease,ESRD)定义为 eGFR <15 mL/(min·1.73 m2)或需要持续性肾替代治疗。
1.3 肾病理 所有患者均在超声引导下行经皮肾活检术,观察光镜、免疫荧光、电镜表现等。光镜组织经10%甲醛固定、石蜡包埋后连续切片,厚度1.5μm,常规行苏木精-伊红(HE)、过碘酸Shiff(PAS)、过碘酸六胺银(PASM)和Masson三色染色。肾组织免疫荧光采用直接法,行 IgG、IgA、IgM、C3、C4、C1q 和Fibrin染色,观察免疫球蛋白和补体沉积的部位和强度。MN合并新月体组中有26例、对照组中有54例采用间接荧光法检测IgG亚型,一抗为鼠抗人的IgG亚型,二抗为荧光素标记的兔抗人IgG。MN合并新月体组中有5例、对照组中有18例行肾组织PLA2R染色。观察患者新月体及球性硬化、节段硬化、袢坏死、间质纤维化/小管萎缩(interstitial fibrosis/tubular atrophy,IFTA)比例以及小动脉病变、免疫荧光类型等。
1.4 统计学分析 使用SPSS 19.0对相关数据进行统计学分析。正态分布数据以均数±标准差(±s)表示,2组样本间比较采用t检验。非正态分布数据以中位数(范围)表示,组间比较采用Man-Whitney、Kruskal-Wallis检验,配对比较采用Wilcoxon检验。分类变量以率(百分比)表示,组间比较采用卡方检验或Fisher精确检验。采用Logistic回归及线性回归分析方法校正年龄因素。所有检验均为双侧检验,以P≤0.05为差异有统计学意义。
2 结 果
2.1 基础资料情况 我院肾脏科2005年4月至2014年3月间肾活检病理示IMN共有4100例,其中70例合并新月体形成(1.7%)。合并抗GBM肾炎3例,ANCA相关性血管炎7例,ANCA阴性血管炎2例,合并 IgA肾病5例,其余53例(1.3%)ANCA、抗GBM抗体均为阴性。
2.2 纳入资料情况 53例MN合并新月体患者中男34例、女19例,活检时平均年龄高于对照组[(50.2 ±14.8)岁 vs(40.4 ±14.3)岁,P <0.05]。53例患者与对照组100例患者均无肾外损害表现,且高血压及肾功能不全发生率均高于对照组(47.2%vs 19.0%,28.3%vs 4.0%,P <0.05)。见表1。
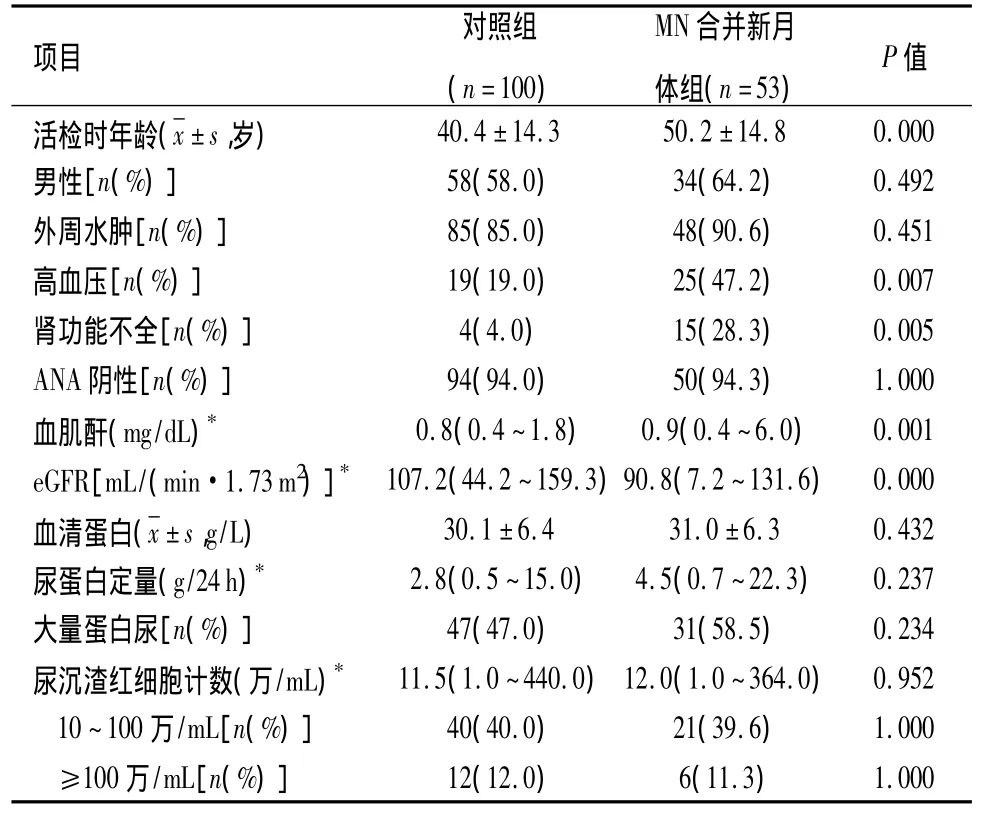
表1 膜性肾病合并新月体患者与对照组患者实验指标比较Table 1 Clinical and laboratory features of the cases of membranous nephropathy(MN)with crescents and MN controls
2.3 实验室检验结果特点 53例MN合并新月体患者中,50例ANA为阴性,ANA阴性率与对照组比较,差异无统计学意义(94.3%vs 94.0%,P >0.05)。其肾活检时肾功能较对照组差,中位血肌酐高于对照组(0.9mg/dL vs 0.8 mg/dL,P=0.001),中位 eGFR低于 对 照 组[90.8 mL/(min·1.73m2)vs 107.2 mL/(min·1.73m2),P=0.000]。53 例患者血清蛋白、中位尿蛋白定量、大量蛋白尿比例以及尿沉渣红细胞计数与对照组比较,差异无统计学意义。见表1。
2.4 肾病理特点 53例患者中位新月体比例为4.6%(1.8% ~ 35.3%),其中以细胞性新月体为主,细胞纤维性新月体、纤维性新月体比例均较低。53例患者中位球性硬化比例高于对照组(8.1%vs 0.0%,P <0.05),节段硬化和袢坏死发生率均高于对照组(49.1%vs 16.0%、11.3%vs 0.0%,P <0.05)。53例患者IFTA比例与小动脉病变发生率高于对照组,分别为(86.8%vs 54.0%,92.5%vs 65.0%,P<0.05)。其小动脉病变通常表现为节段透明变性、内膜或弹力层增厚,有4例小动脉狭窄、1例小动脉闭锁和1例入球小动脉血栓。见图1。
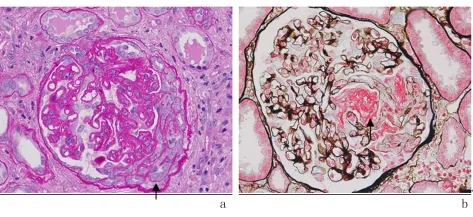
图1 膜性肾病合并新月体的病理改变示意图(×400)Figure 1 Athological features of membranous nephropathy with crescents(×400)
53例患者肾组织免疫荧光显示血管袢有多种免疫球蛋白及补体的沉积,且均有IgG沉积,强度多为中等及以上。其中只有1例无C3沉积,其他均有轻度到中度强度沉积。患者中16例(30.2%)有IgA 沉积、8例(15.1%)IgM 沉积、3例(5.7%)C4沉积、23 例(43.4%)C1q 沉积、3 例(5.7%)Fibrin沉积,C4阳性率低于对照组(5.7%vs 20.0%,P=0.018)。共有26例患者行肾组织IgG亚型染色,提示为多种IgG亚型沉积。见表2。
2.5 PLA2R检测 53例患者中共有45例接受了血清抗PLA2R检测,其中30例(66.7%)为阳性。该30例中共有5例行肾组织PLA2R染色,结果均为阳性(100.0%)。对照组100例中,95例检测了血清抗PLA2R,54例(56.8%)为阳性。共有18例行肾组织PLA2R染色,结果均为阳性(100.0%)。2组比较差异无统计学意义(P<0.05)。见图2。

表2 膜性肾病合并新月体患者与对照组肾活检肾病理特点比较Table 2 Renal pathological features of membranous nephropathy(MN)with crescents versus MN control

图2 肾组织PLA2R染色示意图Figure 2 PLA2R glomerular deposits in the renal tissue of the patient
2.6 随访治疗与预后 53例患者中有50例获得随访,随访中位时间为24.5个月。治疗方案包括肾素-血管紧张素系统阻滞剂、糖皮质激素联合环磷酰胺、雷公藤或神经钙蛋白抑制剂等。1例进展至ESRD。50例患者活检时肾功能均较对照组差,末次随访时的中位血肌酐及eGFR采用线性回归分析方法校正年龄因素后与对照组差异无统计学意义(P>0.05)。50例患者活检时、末次随访时血清蛋白、尿蛋白定量与对照组相比差异无统计学意义(P >0.05)。见表3。
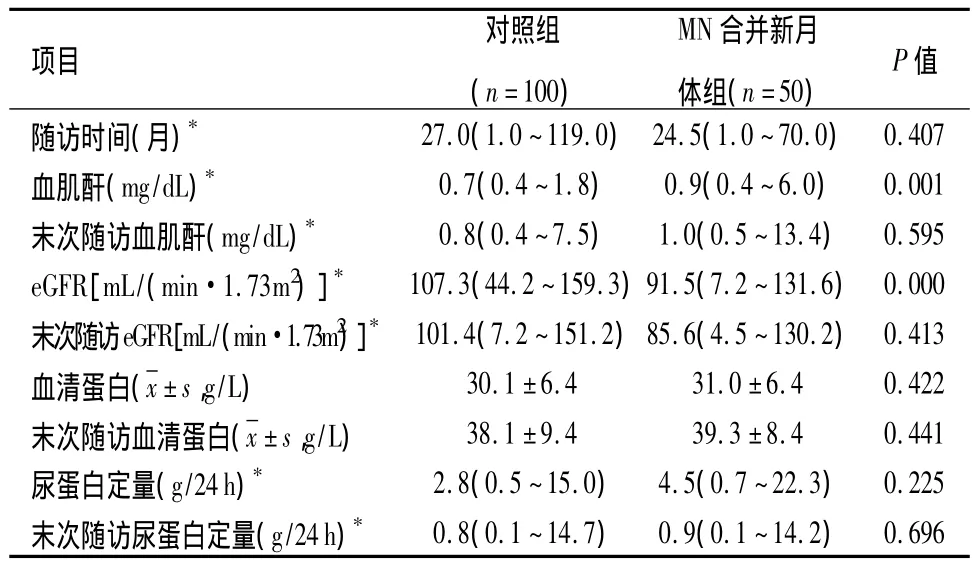
表3 膜性肾病合并新月体患者与对照组随访结果比较Table 3 Follow-up data about the membranous nephropathy(MN)patients with crescents versus the MN controls
3 讨 论
MN是一个病理形态学诊断名词,其特征性的病理学改变是肾小球毛细血管袢上皮侧可见大量的免疫复合物沉积,不伴有肾小球固有细胞增殖和局部炎症反应。临床上,少数MN患者虽然病理上可见有新月体形成,但反复筛查未找到继发性MN证据,也非合并抗GBM肾炎、系统性血管炎、IgA肾病等其他可导致新月体形成的肾小球疾病[12]。这些患者除病理上可见有新月体形成,但在临床表现、预后转归与典型IMN差异性以及诊断为IMN的可能性方面目前尚无定论。
本研究53例患者就诊时未发现继发性MN病因,且大部分患者血清抗PLA2R抗体阳性。根据定义判断,该类患者可归为IMN。但事实上,MN最常见的继发性病因为自身免疫相关性疾病,尤其是系统性红斑狼疮(systemic lupus erythematosus,SLE)。SLE肾受累早期可无肾外表现,且血清学阴性,随访过程中逐渐出现肾外受累及血清学检查异常表现。因此MN合并新月体形成可能预示某些继发性MN的疾病早期。1983年Adu等[13]报道了10例行肾活检诊断为MN的患者。随访1~14年后,其中4例确诊为Ⅴ型狼疮性肾炎。陈强等[14]报道了4例患者病初诊断为MN,起初无肾外表现,且自身抗体阴性,无低补体血症。随访10个月~2年后出现肾外表现及自身抗体阳性,最终诊断为Ⅴ型狼疮性肾炎。本研究53例合并新月体MN患者有3例ANA阳性,虽然这3例患者无肾外受累临床表现及其他自身抗体阳性,并且ANA阳性率与对照组差异无统计学意义,但患者仍需严密门诊随访,观察有无肾外表现及监测血清学指标。发现MN合并新月体时,尤其对于血清抗PLA2R抗体阴性及ANA阳性患者,需仔细寻找有无肾外表现及血清学的自身免疫性疾病的证据,并需长期随访复查,谨防漏诊。
MN可合并其他导致新月体形成的肾小球疾病,最常见有MN合并抗GBM肾小球肾炎、ANCA相关性血管炎、ANCA阴性血管炎及IgA肾病。Rodriguez等[12]报道的19例及本研究的53例MN合并新月体患者均无肾外损害表现,肾组织病理坏死性改变比例均较小,表明至少有部分病例可排除ANCA阴性系统性血管炎可能,是一种独特类型的MN。本研究MN合并新月体形成病例中,合并抗GBM肾炎3例、ANCA相关性血管炎7例、ANCA阴性血管炎2例、IgA肾病5例。MN合并IgA肾病较为少见[10-11]。王素霞等[9]报道了 11 例 MN 合并IgA肾病,其中有2例观察到肾小球新月体形成。Rodriguez等[12]报道有1例MN合并新月体患者在肾活检8个月后检测抗MPO阳性,而且系统性血管炎早期可能无肾外表现。抗GBM肾炎可在诊断MN多年后出现[3-5]。对于暂时无抗GBM肾小球肾炎与系统性血管炎的血清学、临床表现证据的患者,亦不能忽视可能合并这些疾病的可能,需要在长期随访中关注有无肾外表现及监测血清ANCA、抗GBM抗体等。
MN合并新月体形成时还需排除是否与单克隆免疫球蛋白血症相关。单克隆免疫球蛋白相关肾疾病病理表现多样,可表现为膜增生性肾小球肾炎、毛细血管内增生性肾小球肾炎、局灶节段性肾小球硬化症、肾小管间质性肾炎、免疫触须样肾小球病[15-16]。少数患者病理可表现为MN,并且可合并新月体形成,这可能与单克隆免疫球蛋白沉积于肾组织足细胞或基底膜形成免疫复合物,从而导致肾小球的损伤有关[17-18]。但本研究部分患者肾组织IgG亚型染色提示为多克隆,不符合单克隆免疫球蛋白沉积特点,故至少在本组部分病例中,MN合并新月体形成与单克隆免疫球蛋白血症无关。
本组病例最长随访时间长达70个月,至今仍未发现继发MN或合并其他新月体性肾小球疾病的证据,且大部分病例血清抗PLA2R或肾组织PLA2R染色阳性。血清抗PLA2R对诊断IMN具有高度特异性,70%IMN血清抗PLA2R为阳性,肾组织PLA2R染色也常用来鉴别MN是否为特发性[19]。Rodriguez等[12]报道的19例MN合并新月体患者38%肾组织PLA2R染色为阳性,故认为MN合并新月体至少有部分患者为特发性,IMN也可以合并新月体,发病机制可能是免疫复合物的沉积导致了严重的肾小球损伤。本研究中53例患者有45例检测血清抗PLA2R阳性,5例检测肾组织PLA2R染色,其中30例(66.7%)血清抗PLA2R阳性,5例(100%)肾组织PLA2R染色阳性,这部分患者可考虑为IMN。有研究表明,一部分血抗清抗PLA2R阴性的特发性MN可能与THSD7A抗体有关[20]。因此,对于血清抗PLA2R或肾组织PLA2R染色阴性的病例,如长期随访未发现继发MN或合并其他新月体性肾小球疾病的证据,可考虑检测血清抗THSD7A或肾组织THSD7A进一步明确是否为IMN。
综上,临床上对于MN合并新月体患者的诊断需高度谨慎,应注意排查继发性MN或合并其他新月体性肾小球疾病的证据,重点排除继发SLE等自身免疫性疾病以及合并抗GBM肾炎、系统性血管炎、IgA肾病,随访中需关注有无肾外系统受累临床表现,定期监测相应血清学指标。MN合并新月体患者中至少有部分患者为病理表现较为特殊的IMN,这些患者与典型IMN相比,在临床上高血压、肾功能不全比率较高,病理上除可见少量新月体形成,肾小球袢坏死及IFTA表现突出,免疫荧光示C4阳性率低,短期随访预后与典型IMN患者无明显差别。本研究作为国内较早开展的MN合并新月体的回顾性研究,示MN合并新月体比例较国外Rodriguez等[12]报道的0.4%高,新月体比例较其25%低。Rodriguez等[12]报道的19例中有4例进展至ESRD,而本研究仅有1例,且通过MN合并新月体组与对照组的预后指标对比,表明了国内此类患者预后相对较好。
本研究作为单中心回顾性研究,存在样本量较少、统计资料不完全、随访时间较短等局限性。此外,对于MN合并新月体的认识尚浅,仍需长期观察及进一步探讨其发病机制,以期在临床上指导治疗与判断预后。
[1] 周 岩,李 川,龚运兵,等.107例西藏高原地区肾活检患者病理资料分析[J].医学研究生学报,2014,27(11):1188-1190.
[2] Basford AW,Lewis J,Dwyer JP,et al.Membranous Nephropathy with Crescents[J].J Am Soc Nephrol,2011,22(10):1804-1808.
[3] Kurki P,Helve T,von Bonsdorff M,et al.Transformation of membranous glomerulonephritis into crescentic glomerulonephritis with glomerular basement membrane antibodies.Serial determinations of anti-GBM before the transformation[J].Nephron,1984,38(2):134-137.
[4] Moorthy AV,Zimmerman SW,Burkholder PM,et al.Association of crescentic glomerulonephritis with membranous glomerulonephropathy:a report of three cases[J].Clin Nephrol,1976,6(1):319-325.
[5] Thitiarchakul S,Lal SM,Luger A,et al.Goodpasture's syndrome superimposed on membranous nephropathy.A case report[J].Int J Artif Organs,1995,18(12):763-765.
[6] Nasr SH,Said S M,Valeri AM,et al.Membranous Glomerulonephritis with ANCA-Associated Necrotizing and Crescentic Glomerulonephritis[J].Clinical Journal of the American Society of Nephrology,2009,4(2):299-308.
[7] 章海涛,陈惠萍,程震,等.系统性血管炎合并肾小球膜性病变[J].肾脏病与透析肾移植杂志,2011,20(1):18-22.
[8] Morizane R,Konishi K,Hashiguchi A,et al.MPO-ANCA associated crescentic glomerulonephritis with numerous immune complexes:case report[J].BMC Nephrol,2012,13(6):1125-1125.
[9] Shimada M,Fujita T,Nakamura N,et al.A case of myeloperoxidase anti-neutrophil cytoplasmic antibody(MPO-ANCA)-associated glomerulonephritis and concurrent membranous nephropathy[J].BMC Nephrol,2013,14(4):73-73.
[10] 王素霞,邹万忠,杨莉,等.膜性肾病合并IgA肾病的临床病理特点[J].中华病理学杂志,2007,36(3):171-174.
[11] Jennette JC,Newman WJ,Diaz-Buxo JA.Overlapping IgA and membranous nephropathy[J].Am J Clin Pathol,1987,88(1):74-78.
[12] Rodriguez EF,Nasr SH,Larsen CP,et al.Membranous Nephropathy With Crescents:A Series of 19 Cases[J].American Journal of Kidney Diseases,2014,64(1):66-73.
[13] Adu D,Williams DG,Taube D,et al.Late onset systemic lupus erythematosus and lupus-like disease in patients with apparent idiopathic glomerulonephritis[J].Q J Med,1983,52(208):471-487.
[14] 陈强,胡伟新,刘志红,等.152例V型狼疮肾炎的临床病理研究[J].中华肾脏病杂志,2002,18(6):417-421.
[15] Bridoux F,Leung N,Hutchison CA,et al.Diagnosis of monoclonal gammopathy of renal significance[J].Kidney Int,2015,87(4):698-711.
[16] Leung N,Bridoux F,Hutchison CA,et al.Monoclonal gammopathy of renal significance:when MGUS is no longer undetermined or insignificant[J].Blood,2012,120(22):4292-4295.
[17] de Seigneux S,Bindi P,Debiec H,et al.Immunoglobulin deposition disease with a membranous pattern and a circulating monoclonal immunoglobulin G with charge-dependent aggregation properties[J].Am J Kidney Dis,2010,56(1):117-121.
[18] Nasr S H,Satoskar A,Markowitz GS,et al.Proliferative glomerulonephritis with monoclonal IgG deposits[J].J Am Soc Nephrol,2009,20(9):2055-2064.
[19] Beck LJ,Bonegio RG,Lambeau G,et al.M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy[J].N Engl J Med,2009,361(1):11-21.
[20] Tomas NM,Beck LJ,Meyer-Schwesinger C,et al.Thrombospondin type-1 domain-containing 7A in idiopathic membranous nephropathy[J].N Engl J Med,2014,371(24):2277-2287.

