我院2009年-2013年鲍曼不动杆菌的变化趋势
娄峻 杨佳 邱卫强
830011 乌鲁木齐市,新疆医科大学附属肿瘤医院内二科(杨佳)
鲍曼不动杆菌为非发酵革兰阴性杆菌,属于条件致病菌,广泛存在于正常人体的皮肤、呼吸道和泌尿道,也广泛分布于自然界的水和土壤中,该菌是医院感染的重要病原菌[1],主要引起呼吸道感染,也可引发菌血症、泌尿系统感染、继发性脑膜炎、手术部位感染、呼吸性相关性肺炎等。近年来,由于广谱抗菌药物的大量使用,侵入型检查治疗操作的普及,广泛耐药鲍曼不动杆菌的检出率呈上升趋势,给临床医师的抗感染治疗带来了很大的挑战,尽管广谱、高效的抗生素不断推出,以及更为先进的消毒洁净技术不断使用来预防感染,但是该菌引起的感染仍日益严重。为加强鲍曼不动杆菌的耐药性监测,了解其临床感染的分布特点,抑制该菌在医院内的传播和有效的抗感染治疗,本文对我院2009年-2013年临床分离的鲍曼不动杆菌进行了回顾性调查和分析,现报告如下。
1 资料与方法
1.1 临床资料 收集2009年1月1日-2013年12月31日自我院住院患者痰液、尿液、脑脊液等各类标本分离的鲍曼不动杆菌4373株,剔除同一患者相同部位的重复菌株。
1.2 细菌鉴定及药敏试验 采用法国梅里埃公司的VITEK2-Compact全自动细菌鉴定仪对细菌进行培养、分离、鉴定和药敏试验。实验操作按照《全国临床检验操作规程》(第3版)进行。药敏试验根据CLSI《抗菌药物敏感性试验指南M100-S20(2010版)》所规定的折点进行结果判断。质控菌株大肠埃希菌ATCC 25922和金黄色葡萄球菌ATCC 29213均购自卫生部临床检验中心。
1.3 广泛耐药鲍曼不动杆菌的筛选 分离出的鲍曼不动杆菌对临床常用抗生素如β-内酰胺类、氨基糖苷类、喹诺酮类、磺胺类、碳青霉烯类等几乎全部耐药,而仅对多粘菌素B和米诺环素敏感,即判断为广泛耐药鲍曼不动杆菌。
1.4 统计学处理 所有数据均采用WHONET 8.4软件进行分析。
2 结果
2.1 鲍曼不动杆菌历年检出情况 2009年-2013年我院检出病原菌分别为8826株、9002株、9648株、8748株和7917株。其中共检出鲍曼不动杆菌4373株,历年分别检出 790株(8.95%)、812株(9.02%)、872 株(9.04%)、1025 株(11.72%)和874株(11.04%)。其中,广泛耐药鲍曼不动杆菌历年分别检出 364 株(46.08%)、402 株(49.51%)、446 株(51.15%)、565 株(55.12%)和579 株(66.25%),均呈逐年上升趋势,见表1。
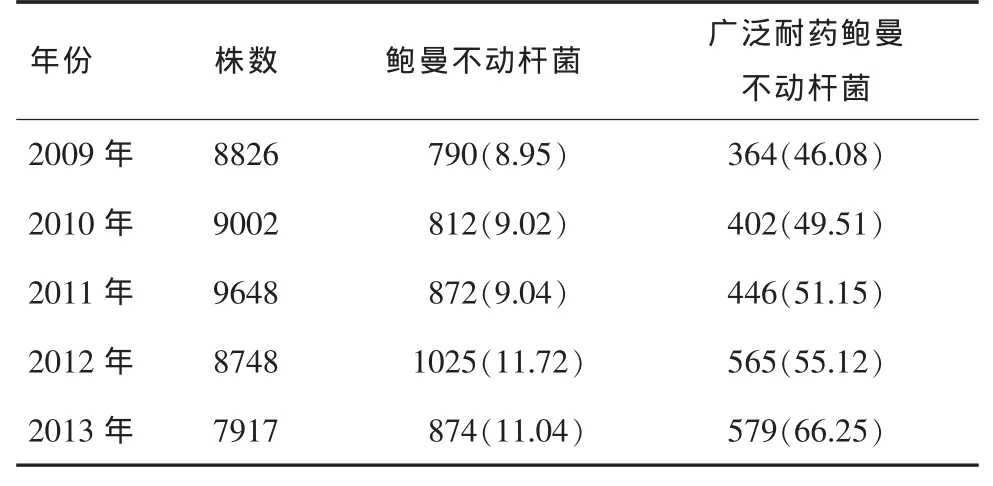
表1 鲍曼不动杆菌各年临床检出率[n(%)]
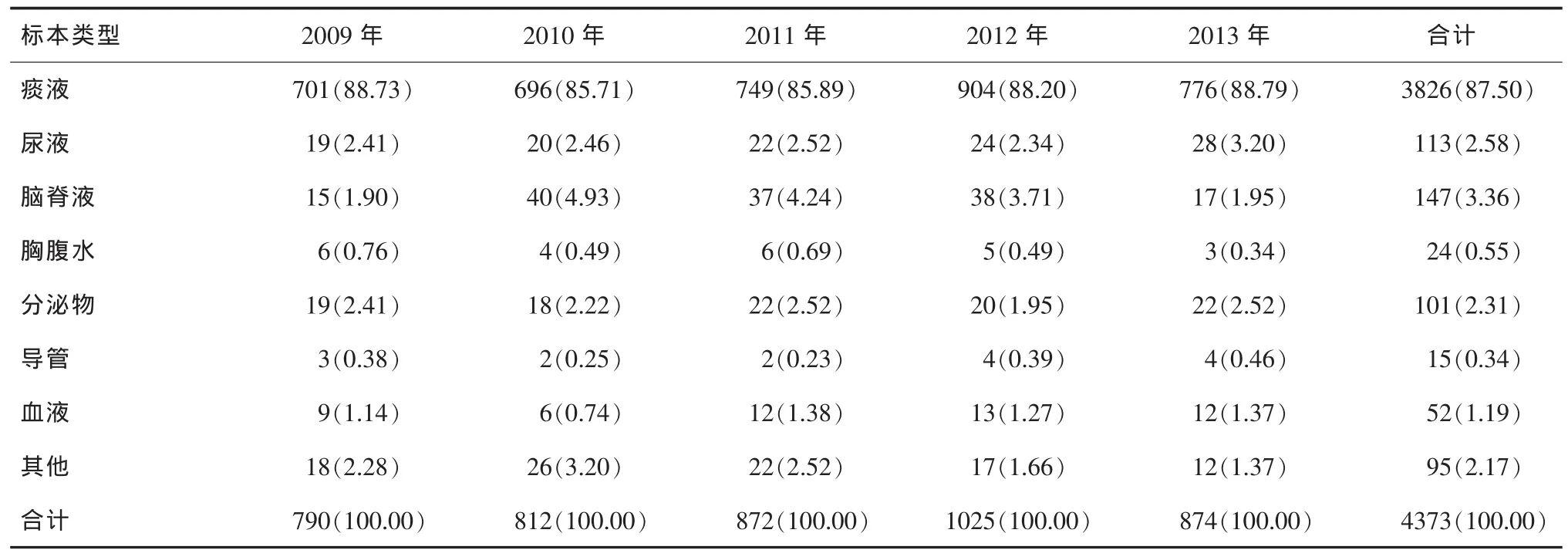
表2 2009-2013年鲍曼不动杆菌各种临床标本检出率[n(%)]
2.2 鲍曼不动杆菌在各类标本中的检出情况2009年-2013年鲍曼不动杆菌标本类型分布以痰液为主,检出率最高(87.50%),其次是脑脊液、尿液、分泌物,其检出率分别是 3.36%、2.58%、2.31%,各类标本每年检出率较为稳定,见表2。
2.3 鲍曼不动杆菌临床科室分布情况 2009年-2013年鲍曼不动杆菌科室分布以呼吸重症科占首位,为36.57%,第二位和第三位分别是 ICU(31.95%)和呼吸内科(7.55%),各科室历年检出情况较为稳定,见表3。
2.4 鲍曼不动杆菌药敏试验结果分析 2009年-2013年鲍曼不动杆菌对临床常用抗生素的耐药率各不相同,其中对青霉素类(氨苄西林、哌拉西林、哌拉西林/他唑巴坦、氨苄西林/他唑巴坦)、头孢菌素类(头孢他啶、头孢吡肟)、喹诺酮类(左氧氟沙星、环丙沙星)、磺胺类(复方新诺明)、单环β-内酰胺类(氨曲南)的耐药率较高,历年普遍在61.65%以上;对亚胺培南和美罗培南(碳青霉烯类抗生素)的耐药率从2009年的50.63%和50.13%上升到2013年的76.43%和76.66% ,2012年最高达到80.88%和80.49%;对氨基糖苷类的耐药率组内变化较大,如对妥布霉素和庆大霉素的耐药率历年均高于阿米卡星的耐药率;对米诺环素、多粘菌素B、头孢哌酮/舒巴坦的耐药率较低,均低于27.00%,见表4。
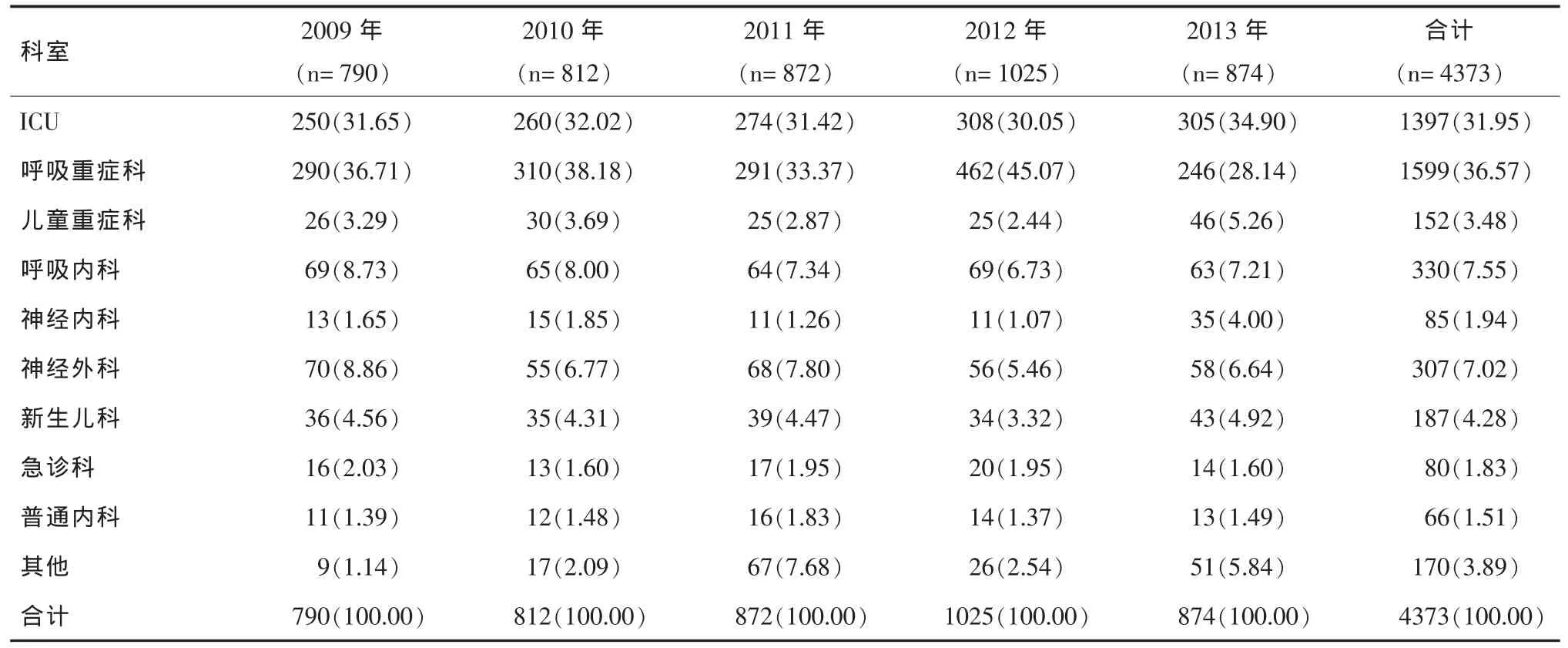
表3 2009年-2013年鲍曼不动杆菌临床科室分布[n(%)]
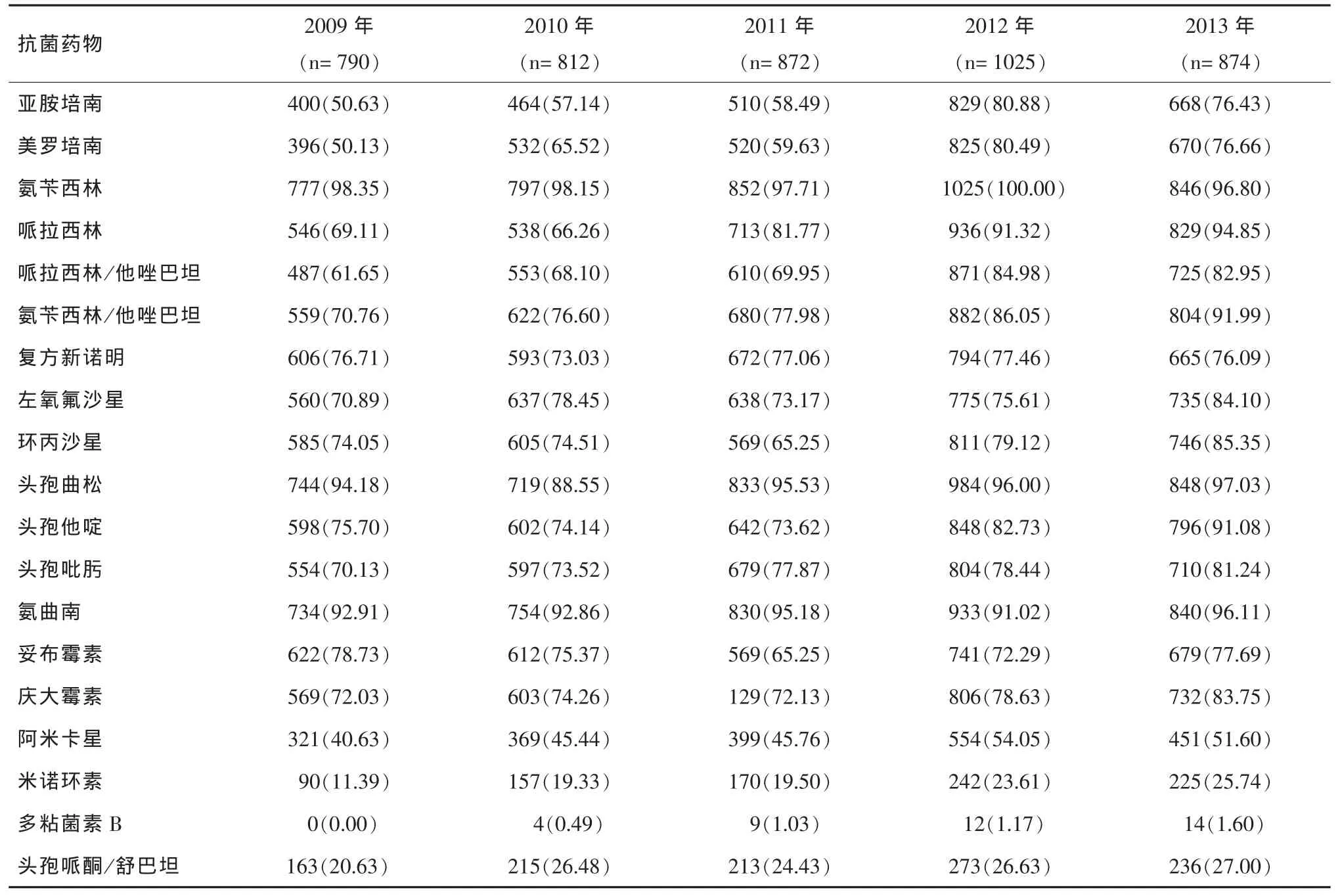
表4 鲍曼不动杆菌对常用抗生素的耐药情况[n(%)]
2.5 广泛耐药鲍曼不动杆菌的药敏试验结果 广泛耐药鲍曼不动杆菌的耐药情况较严重,对碳青霉烯类(亚胺培南、美罗培南)的耐药率较高,均大于90.11%,对头孢哌酮/舒巴坦在 45.27%~58.20%之间,对米诺环素的耐药率较低,在 20.60%~34.20%之间,对多粘菌素B的耐药率最低,历年均小于1.73%,见表5。
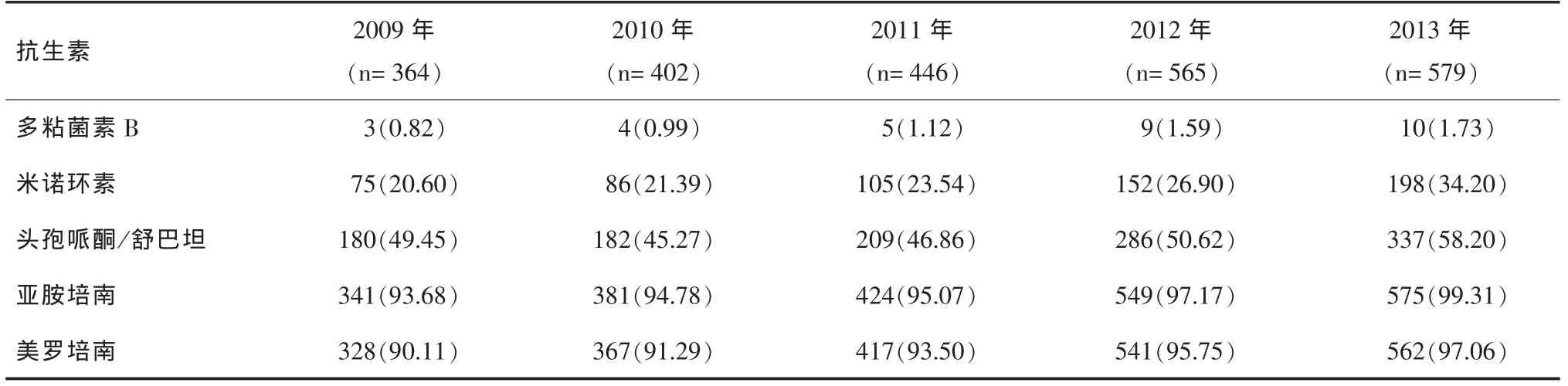
表5 2356株广泛耐药鲍曼不动杆菌对特殊抗生素的耐药情况[n(%)]
3 讨论
鲍曼不动杆菌对湿热、紫外线、化学消毒剂和外界环境有较强抵抗力,具有多重耐药、交叉耐药和耐药率高等特点,其广泛存在于自然界、医院环境和人体的皮肤、呼吸道、消化道和泌尿生殖道中,是一种条件致病菌。美国国家医院感染监测系统显示[2,3],鲍曼不动杆菌在医院内感染中占第四位,是仅次于铜绿假单胞菌的非发酵菌,已成为院内感染的重要病原菌和院内不动杆菌属暴发流行的主要菌种之一。我院2009年-2013年鲍曼不动杆菌历年分别检出 790 株(8.95%)、812 株(9.02%)、872 株(9.04%)、1025 株(11.72%)和874 株(11.04%),呈逐年上升趋势。其中,广泛耐药鲍曼不动杆菌分别检出364株(46.08%)、402 株(49.51%)、446 株(51.15%)、565 株(55.12%)和579 株(66.25%),均呈明显的逐年上升趋势。
本文研究结果显示,4373株鲍曼不动杆菌标本分布以痰液为主,检出率最高,为87.50%,提示鲍曼不动杆菌感染以下呼吸道为主,这与相关报道[4,5]一致。尿液、脑脊液和分泌物标本的检出率位列第二、第三和第四位,说明鲍曼不动杆菌引起的泌尿系统感染、血流感染和伤口感染也不容忽视。科室分布以呼吸重症科占首位(36.57%),第二位和第三位分别是 ICU(31.95%)和呼吸内科(7.55%),这可能与上述科室多为重症慢性消耗型患者、机体免疫力低下、需长期应用各种广谱抗生素及使用各种侵入性医疗器械检查和治疗,如气管切开或插管、使用人工呼吸机、行静脉导管和腹膜透析有关。此外,鲍曼不动杆菌接触生物器材后48 h就可以形成成熟的生物膜,72 h后形成的生物膜较铜绿假单胞菌和金黄色葡萄球菌厚,该生物膜可长期黏附于呼吸机上而不易清除,同时环境中各种物体表面也存在大量该菌,呼吸支持时也会将上呼吸道正常定植的鲍曼不动杆菌带入下呼吸道而引起感染[6]。我院鲍曼不动杆菌来源科室分布广泛,许多病区均有分布,该菌在新生儿科、儿童重症科和神经内科也有一定的检出率,这可能与这些科室的患者大多为儿童或老年人,机体免疫力弱,大多长期应用各种广谱抗生素和侵入性治疗有关。
由于碳青霉烯类抗生素的大量应用,鲍曼不动杆菌的耐药率不断上升,出现了多重耐药菌、广泛耐药菌甚至泛耐药的“超级细菌”,给临床治疗造成极大的挑战。本文研究结果显示,除米诺环素、多粘菌素B和头孢哌酮/舒巴坦外,鲍曼不动杆菌对其他抗生素如青霉素类、头孢菌素类、喹诺酮类、磺胺类和单环β-内酰胺类抗生素的耐药率均较高,历年耐药率普遍在61.65%以上,且对青霉素类(如氨苄西林/他唑巴坦)和碳青霉烯类抗生素(如亚胺培南、美罗培南)的耐药率逐年增高。目前已有对碳青霉烯类等所有抗菌药物耐药的“广泛耐药株”出现,我院广泛耐药鲍曼不动杆菌的耐药情况严重,对碳青霉烯类抗生素的耐药率均大于90.11%,对头孢哌酮/舒巴坦的耐药率在45.27%~58.20%之间,对米诺环素的耐药率较低,在 20.60%~34.20%之间,对多粘菌素B的耐药率最低,均在1.73%以下。多粘菌素B对广泛耐药鲍曼不动杆菌有很好的体外抗菌活性,是目前对碳青霉烯类抗生素耐药的鲍曼不动杆菌最为有效的抗菌药物之一[7]。广泛耐药菌的变化趋势和耐药形势严重,应引起临床医师和感染控制工作者的高度重视,并采取措施防止广泛耐药菌的蔓延和在医院内暴发流行。鲍曼不动杆菌的高耐药率与其复杂的耐药机制有关,主要为可以产生β-内酰胺酶、金属酶、头孢菌素酶、苯唑西林酶、碳青霉烯酶、氨基糖苷类钝化酶等。对β-内酰胺类抗生素耐药是通过产生染色体或质粒介导的超广谱β-内酰胺酶以及外膜蛋白的减少、缺失或突变的改变和形成药物“外排泵”[8];对氨基糖苷类抗生素的耐药机制主要是通过产生氨基糖苷类修饰酶,即乙酰转移酶、磷酸转移酶及核苷转移酶,外膜通透性降低,主动外排、靶位突变或甲基化修饰等来灭活氨基糖苷类抗生素从而形成耐药[9];对喹诺酮类抗生素耐药机制主要是拓扑异构酶的改变、膜通透性的改变和药物的主动外排系统的过表达[10];对四环素类的耐药主要是Tet、TetK的外排作用,及TetM和TetO保护核糖体免受四环素、多西环素和米诺环素的杀灭作用(替加环素除外)[8]。此外,鲍曼不动杆菌还可以通过转座子、整合子和质粒等可移动基因元件获得对多种抗菌药物的耐药性;另一方面,大剂量广谱抗菌药物、经验用药也可以诱导鲍曼不动杆菌的耐药性增加[11]。
综上所述,鲍曼不动杆菌感染已成为临床感染检出的主要病原菌之一,其对抗菌药物的广泛耐药性已成为临床医生抗感染治疗的主要挑战,这就要求临床医生应加强预防感染意识、严格执行消毒隔离制度、防止交叉感染、改善住院环境,避免环境污染。临床实验室要加强鲍曼不动杆菌的规范性连续性耐药监测,掌握病原菌的流行病学及抗菌药物耐药特点,为临床合理用药提供实验室依据。
1 倪语星,尚红,主编.临床微生物学检验础.第5版.北京:人民卫生出版社,2012,29.
2 雷彦平.本院鲍曼不动杆菌近5年耐药率的变化趋势.中国临床药理学杂志,2012,151:330-333.
3 Peleg AY,Seifert H,Paterson DL.Acinetobacter baumannii:emergence of a successful Pathogen.Clin Microbiol Rev,2008,21:538-582.
4 李永丽.鲍曼不动杆菌多重耐药机制及耐药基因检测研究进展.检验医学,2012,27:963-968.
5 国承杰,张文.我院2009-2010年鲍曼不动杆菌的临床分布及耐药性研究.山东医药,2012,52:77-79.
6 何发明,范晶,余泽波,等.ICU中痰标本来源的鲍曼不动杆菌的临床意义分析.中国抗生素杂志,2012,37:357-359.
7 Clinical and Laboratory Standards Institute.Performance standards for antimicrobial susceptibility testing.M100-S18,CLSI,2008.
8 Vila J,Marti S,Sanchez-Cespedes J.Porins,efflux pumps and multidrug resistance in Acinetobacter baumannii.JAntimicrob Chemother,2007,59:1210-1215.
9 谢美红,张利媚,余小萍,等.鲍曼不动杆菌对阿米卡星药敏试验误差分析.实用检验医师杂志,2014,6:176-178.
10 Gordon NC,Wareham DW.Multidrug-resistant Acinetobacter baumannii:mechanisms of virulence and resistance.Int JAntimicrob A-gents,2010,35:219-226.
11 徐一鸣,王蓓,蒋晓飞.2008至2012鲍曼不动杆菌临床感染分布及耐药特征检查.检验医学,2014,29:245-247.

