rhTNF-α对人肝癌细胞HepG-2体外抗肿瘤作用研究
周勇军 李龙平 王新华 侯敢 黄迪南
524000 湛江市,广东医学院生化教研室(侯敢 黄迪南)
肝癌是我国最常见的恶性肿瘤,病死率极高。目前,肝癌治疗仍以手术为首选,但手术切除的突出问题是切除率低,就诊患者中适合手术切除者不足25%,且术后复发率高,根治性切除术后5年复发率达 61.5%[1,2]。肿瘤坏死因子 α(tumor necrosis factorα,TNF-α)是迄今为止发现的抗肿瘤活性最强的细胞因子,但TNF-α不能持续、长期、大剂量使用,大大限制了其在临床上的广泛应用,降低TNF-α的毒副作用、增强靶向性和延长其生物半衰期是解决这一难题的三个关键。本课题组制备新型的重组人肿瘤坏死因子α(recombinant human tumor necrosis factor-α,rhTNF-α),体外抗肿瘤活性高,局部用药或联合用药更显示出疗效好、毒副作用少等优势[3]。5-氟尿嘧啶(5-FU)虽已用于治疗多种肿瘤,但有诸多副作用,5'-脱氧氟尿苷(5'-dFUrd)是一新型的氟尿嘧啶前体药,具有更强的肿瘤选择性和更小的副作用,本身无细胞毒作用,需在体内经过多步酶解反应才能生成有化疗作用的 5-FU。胸苷磷酸化酶(thymidine phsphorylase,TP)在肿瘤组织内催化 5'-dFUrd、卡培他滨等5-FU的前体药转化为有细胞毒作用的5-FU,是发挥关键作用的限速酶,肿瘤组织中TP的表达水平能够预测肿瘤对5-FU化疗药物的敏感性[4]。本文以人肝癌细胞HepG-2为研究对象,探讨rhTNF-α在体外对肝癌细胞生长抑制、侵袭能力及化疗药物敏感性的影响,报道如下。
1 材料与方法
1.1 细胞系 人肝癌细胞HepG-2由广东医学院生化教研室细胞库提供。
1.2 主要试剂 二甲基亚砜(dimethyl sulfoxide,DMSO)、四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)购于美国Sigma公司;人rhTNF-α细胞因子由广东医学院生化教研室赠送,以每管100μl分装 eppendorf管,浓度为 5×103ng/mL,-20 °C 低温保存备用;RPMI-1640培养基、胎牛血清购于杭州吉诺公司;去生长因子Matrigel、TP检测试剂盒购于美国B&D公司。
1.3 方法
1.3.1 细胞培养 将HepG-2细胞接种于含10%灭活胎牛血清的RPMI-1640培养液中,在37℃、5%CO2、饱和湿度下培养,2-3 d传代 1次。
1.3.2 MTT 比色法检测 rhTNF-α 对 HepG-2 细胞的生长抑制作用 将处于对数生长期的HepG-2细胞用0.25%胰酶消化,用含10%胎牛血清的RPMI-1640 培养基培养液调成浓度为 5.8×104/mL 的细胞悬液,以每孔100μl体积接种于三块96孔板中,置37℃,50 ml/LCO2孵箱中培养24 h,待细胞贴壁后弃去原培养液,加入含有rhTNF-α的新鲜培养液200 μl,使终浓度分别为 10 ng/mL(试验组 A)、50 ng/mL(试验组 B)、100 ng/mL(试验组 C)、200ng/mL(试验组D),每种浓度组以及阴性对照组均设3个复孔,分别在加药后24 h、48 h、72 h后加入MTT(10 mg/mL)20 μl,继续孵育 4 h,吸出孔内上清液,每孔加入150μl DMSO,振荡 10 min,以 530 nm为测定波长,630 nm为参考波长,观察细胞形态并用450型自动酶标仪检测各孔A值,计算抑制率。细胞抑制率=(对照组A值-药物处理组A值)/对照组A值×100%。
1.3.3 体外侵袭实验 先用不同浓度 rhTNF-α作用 HepG-2 细胞 24 h,用无血清 RPMI-1640 按 1∶10稀释Matrigel胶,每个Transwell小室铺入20μl稀释过的Martigel胶,置37℃孵育0.5 h。胰酶消化细胞,用含5%胎牛血清的RPMI-1640培养基将细胞浓度调整为3×104/mL。在每个Transwell下室中加入600μl含20%胎牛血清的RPMI-1640培养基,上室中加入200μl细胞悬液,常规培养24 h。取出小室,去除外室内培养基,用甲醇固定5 min,然后用1%结晶紫染色20 min。自来水冲洗后用棉签擦去Matrigel胶和上室内的细胞,快速风干,切下小室的聚碳酸酯膜后贴在载玻片上,用中性树脂封片。在400倍显微镜下观察,随机选取5个视野计数细胞个数,取平均数。
1.3.4 ELISA法检测肿瘤细胞中TP水平 将处于对数生长期的HepG-2细胞用0.25%胰酶消化,用含10%胎牛血清的RPMI-1640培养基培养液调成浓度为 5.8×104/mL 的细胞悬液,以每孔 100 μl体积接种于三块96孔板中,置37℃,50 ml/L CO2孵箱中培养24 h,待细胞贴壁后弃去原培养液,加入含有rhTNF-α的新鲜培养液200μl,使终浓度分别为10 ng/mL(试验组 A)、50 ng/mL(试验组 B)、100 ng/mL(试验组 C)、200 ng/mL(试验组 D),每个浓度组以及阴性对照组均设3个复孔,置37℃,50 ml/L CO2孵箱中继续培养24 h,吸出孔内上清液并检测TP水平。
1.3.5 MTT比色法检测5'-dFUrd和5-FU 对HepG-2细胞抑制实验 将处于对数生长期的细胞用0.25%胰酶消化,用含10%胎牛血清的RPMI-1640 培养液调成浓度为 5.8×104/mL 的细胞悬液,以每孔100μl体积接种于三块96孔板中,置37℃,50 ml/L CO2孵箱中培养24 h,待细胞贴壁后弃去原培养液,分别加入含有 5-FU(1 mg/L)、5'-dFUrd(1 mg/L)的新鲜培养液 200 μl(每孔设 3 个复孔),置37℃,50 ml/LCO2孵箱中继续培养24 h,弃去培养液,加入含有 rhTNF-α的新鲜培养液 200μl,使终浓度分别为 10 ng/mL(试验组 A)、50 ng/mL(试验组 B)、100 ng/mL(试验组 C)、200 ng/mL(试验组D),每种浓度组以及阴性对照组均设3个复孔。在加药 72 h 后加入 MTT(10 mg/mL)20 μl,继续孵育 4 h,吸出孔内上清液,每孔加入150μl DMSO,振荡10 min,以530 nm为测定波长,630 nm为参考波长,观察细胞形态并用450型自动酶标仪检测各孔A值。按如下公式计算增殖抑制率。细胞增殖抑制率=(对照组A值-药物处理组A值)/对照组A值×100%。
1.4 统计学处理 采用SPSS16.0统计软件对数据进行统计学分析,计量资料采用±s表示,多组间计量资料的比较采用方差分析,HepG-2肝癌细胞对5'-dFUrd的敏感性与细胞中TP水平的相关性分析采用Pearson相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 rhTNF-α对HepG-2 肝癌细胞的生长抑制作用结果 不同浓度的rhTNF-α作用HepG-2细胞后,各药物处理组抑制率均增高,10~200 ng/mL的rhTNF-α均呈现量-效与时-效关系,随着药物浓度的增加和作用时间的延长,细胞生长抑制率逐渐升高,200 ng/mL的rhTNF-α作用72 h引起的生长抑制率最高,见图1。

图1 不同浓度rhTNF-α对HepG-2肝癌细胞的抑制作用
2.2 rhTNF-α 对 HepG-2 细胞体外侵袭性影响本实验采用了Matrigel胶模拟基质的方法检测细胞的侵袭能力。经rhTNF-α作用的HepG-2细胞(实验组)的侵袭能力明显高于未作用细胞(对照组),且rhTNF-α浓度越高,HepG-2细胞侵袭能力越强,见图2~5。
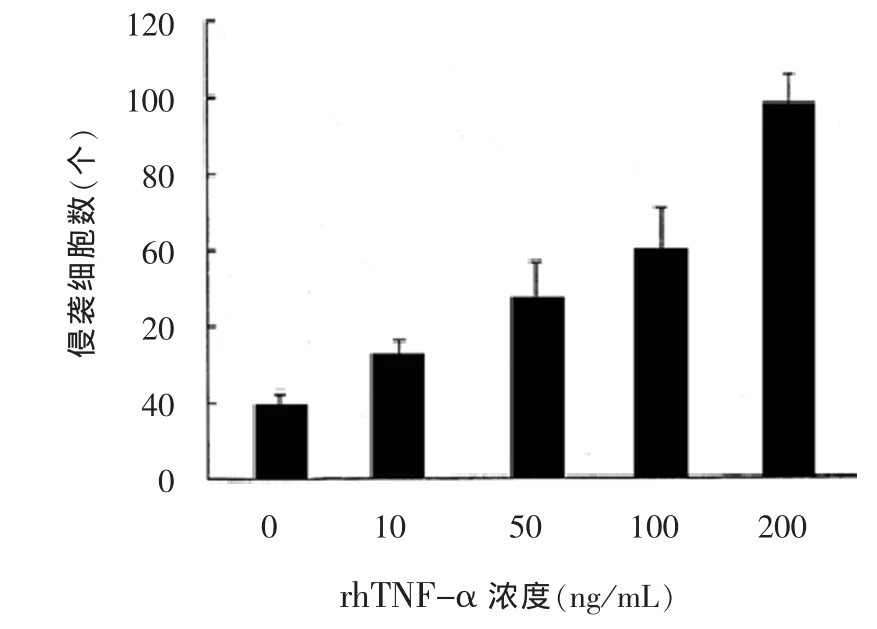
图2 不同浓度rhTNF-α对HepG-2肝癌细胞侵袭能力的影响
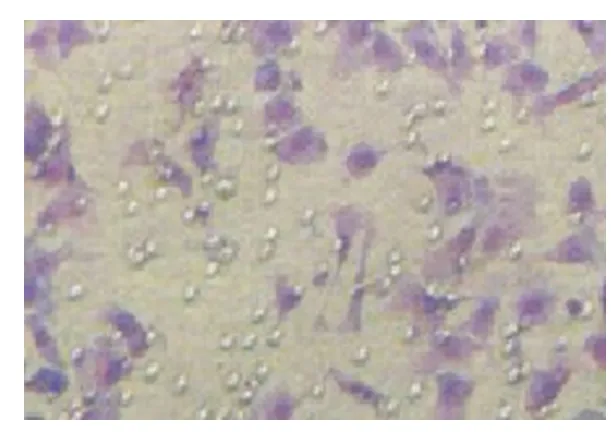
图3 未经rhTNF-α处理的细胞侵袭能力(×400)

图4 经50 ng/mL rhTNF-α处理的细胞侵袭能力(×400)
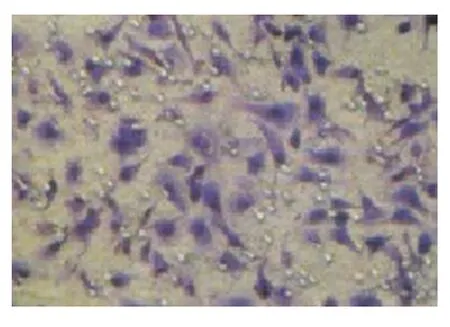
图5 经200 ng/mLrhTNF-α处理的细胞侵袭能力(×400)
2.3 不同剂量rhTNF-α对HepG-2肝癌细胞中TP水平的影响 rhTNF-α能明显提高HepG-2肝癌细胞中TP水平的表达。TP水平随着rhTNF-α浓度的增加而增加,对照组及各试验组间TP的表达水平差异有统计学意义(F=12.062,P=0.014)。各组间两两比较差异均有统计学意义(P均<0.05),见表1。
表1 不同剂量rhTNF-α对HepG-2肝癌细胞中TP 水平的影响(±s)

表1 不同剂量rhTNF-α对HepG-2肝癌细胞中TP 水平的影响(±s)
注:*与对照组比较,P=0.011,P=0.001,P=0.001,P=0.001;★与试验组 A 比较,P=0.020,P=0.002,P=0.001;#与试验组 B 比较,P=0.040,P=0.009;○与试验组 C 比较,P=0.036
?
2.4 rhTNF-α与5-FU 及 5′-dFUrd 联合应用对肝癌细胞化疗敏感性的影响 rhTNF-α与5-FU联合应用对提高HepG-2肝癌细胞对化疗药物的敏感性无明显影响,各组间差异无统计学意义(F=0.485,P=0.692)。rhTNF-α与5′-dFUrd 联合应用可提高HepG-2肝癌细胞对化疗药物的敏感性,各组间差异有统计学意义(F=26.630,P=0.006),且随着 rhTNF-α浓度的增加,细胞存活率逐渐降低,各组间两两比较,差异均有统计学意义(P均<0.05)。细胞对5′-dFUrd敏感性的增加与rhTNF-α上调TP呈正相关性(r=0.679,P=0.001),见表2。
3 讨论
表2 rhTNF-α与5-FU 及 5′-dFUrd 联合应用对 HepG-2肝癌细胞化疗敏感性的影响(±s,%)
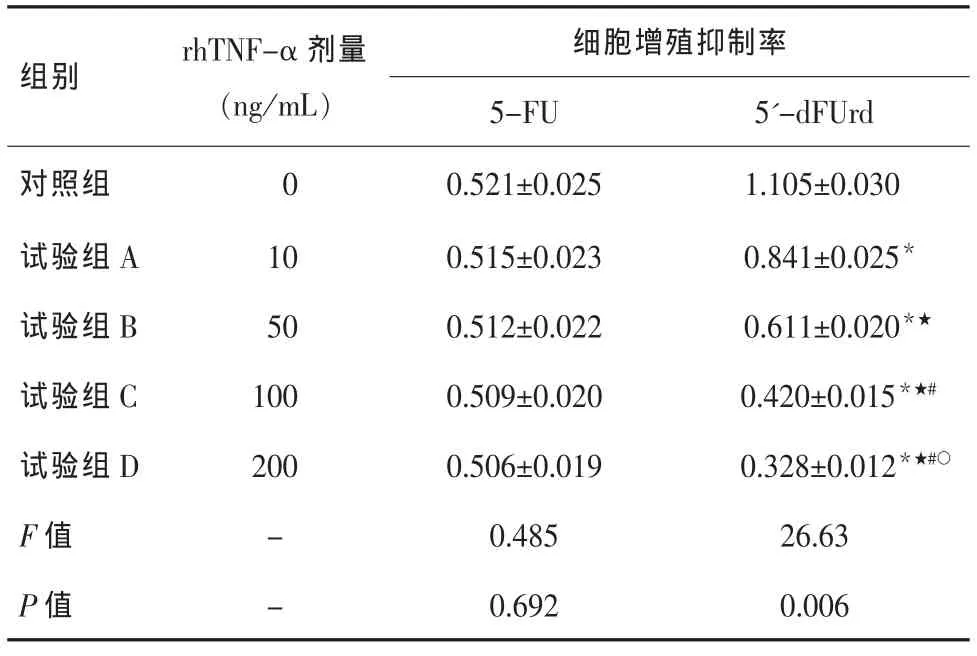
表2 rhTNF-α与5-FU 及 5′-dFUrd 联合应用对 HepG-2肝癌细胞化疗敏感性的影响(±s,%)
注:*与对照组比较,P=0.004,P=0.002,P=0.001,P=0.001;★与试验组 A 比较,P=0.003,P=0.001,P=0.001;#与试验组 B 比较,P=0.003,P=0.002;○与试验组 C 比较,P=0.008
?
恶性肿瘤是严重威胁人类生命健康的头号杀手,手术、放疗和化疗是治疗肿瘤的常用方法。肝细胞癌属于最难治疗的恶性肿瘤之一,手术治疗是首选,但切除率低、复发率高,早期治疗、综合治疗及优化个体治疗方案是新的治疗肝癌的方向。其中筛选安全有效、副作用小的抗肿瘤药物一直是研究重点。肿瘤靶向治疗是利用特异性的载体,将药物或其他杀伤肿瘤细胞的活性物质选择性地运送到肿瘤部位,把治疗作用或药物效应尽量限定在特定的靶细胞、组织或器官内,而不影响正常细胞、组织或器官的功能,从而提高疗效、减少毒副作用的一种方法。利用生物工程技术在分子水平改建细胞因子结构以增强其抗瘤活性和降低毒性的有效探索,有望为细胞因子治疗肿瘤开辟一条新的途径。TNF-α是一类由单核-巨噬细胞及其他多类细胞合成、释放,引起全身系统性炎症反应的多效炎症性细胞因子。可活化巨噬细胞,活化的巨噬细胞具有强烈的杀瘤效应,同时能增强IL-2诱生的淋巴因子激活杀伤细胞(lymphokine activated killer cells,LAK),使 LAK 细胞增多从而增强抗肿瘤作用,并且能诱导干扰素及IL-1 产生,两者进而发挥抗肿瘤活性[5]。TNF-α 是迄今为止发现的抗肿瘤活性最强的细胞因子,其显著特征是,在体内外均能特异性地直接杀伤肿瘤细胞。TNF-α的抗肿瘤作用,引起了人们的极大关注,成为细胞因子研究的新热点。TNF-α抗肿瘤的分子机理非常复杂,就现阶段而言主要是受体引发的信号传导机制:TNF-α抗肿瘤的机理主要是通过与两个受体结合而发挥细胞毒反应,TNF-α的活性三聚体趋化细胞表面的3个受体共同参加反应,然后通过细胞内一系列的接头蛋白参与反应[6]。细胞中的TRADD接头蛋白,首先被活化聚集在TNF-α受体的胞内部分,然后再活化另外3个接头蛋白FADD、RIP 以及 TRAF2[7]。其中 FADD 通过活化 caspase-8引发细胞凋亡。而TRAF2的作用是双重的,既可以激活cIAP引发细胞抗凋亡的反应,又可以激活细胞的JNK途径,通过c-JUN调节核内与细胞凋亡相关基因的表达,引发细胞凋亡产生细胞毒反应。RIP则活化一种蛋白激酶-IKK复合物,作用于NF-κβ,使其Iκβ基团游离,NF-κβ分子量因此变小进而能穿过核膜进入核内调控各种基因。其结果是抑制细胞凋亡和促进炎症反应。TNF-α是一种具有较强免疫活性的细胞因子,通过对肿瘤细胞的细胞毒作用以及免疫调节作用而抑制肿瘤细胞的增殖,此作用主要是TNF-α通过与肿瘤细胞膜上的特异受体的结合,利用细胞内信号的传导,调节相关基因转录,诱导细胞进入编程性死亡通路,引起细胞凋亡。牛朝诗等[8]探讨TNF-α对胶质瘤细胞生物学活性的影响,应用MTT法研究经TNF-α处理的大鼠C6胶质瘤细胞的生长和增殖活性,结果表明TNF-α对体外培养的C6胶质瘤细胞的生长和增殖具有抑制作用,并诱导胶质瘤细胞凋亡。本文研究发现rhTNF-α能抑制肝癌细胞 HepG-2 的增殖,50 mg/mL rhTNF-α处理48 h可见细胞的增殖发生明显的抑制,抑制效果随浓度增加而增加,并且随作用时间的延长而增加,具有剂量和时间双依赖性。
肿瘤细胞对细胞外基质的侵袭破坏是肿瘤转移的重要环节,其中肿瘤细胞穿过基膜的移动参与了肿瘤侵袭的全过程。目前体外研究肿瘤细胞侵袭行为的简便和快速有效的方法是Matrigel胶模拟基质检测细胞侵袭能力实验,其基本原理是在体外应用Matrigel胶模拟胞外基质,有侵袭力的肿瘤细胞能在一定时间内穿过Matrigel胶,肿瘤细胞的侵袭力越强,消化穿透Matrigel胶的肿瘤细胞就越多。本文研究结果发现rhTNF-α能够增强HepG-2细胞的体外侵袭能力,且随rhTNF-α浓度增加,HepG-2细胞侵袭能力增加,具有剂量依赖性,说明rhTNF-α能促进肝癌细胞的侵袭性,其可能的机制是通过调控HepG-2中细胞表面黏附因子CD15和CD15s的含量,使CD15s上调,CD15下调,从而增强HepG-2细胞的侵袭能力,提高其转移潜力[9]。
TNF-α与多种化疗药物具有协同作用,有学者相继发现将TNF-α与放化疗联合应用于中晚期肿瘤治疗,可大大提升放、化疗的敏感性。de Lima等[10]将TNF-α与化疗药物美法仑(melphalan)联合使用,在晚期黑色素瘤和软组织肉瘤的临床试验治疗中发现二者同时使用可以大大地提高治疗效果,认为TNF-α可选择性地使肿瘤内皮细胞破坏、溶解,使美法仑在肿瘤部位的药物浓度增加,增强了美法仑对肿瘤细胞的毒性,从而产生了强大的抗肿瘤效果,并且显著减缓了人胰腺癌肿瘤的增殖和生长,且无明显的系统毒性等副作用,可以有效的治疗晚期黑色素瘤和软组织瘤。但目前尚未有相关的研究在肝肿瘤中开展,并且TNF-α与化疗药物协同作用的机理及调控机制未完全清楚。本文研究结果显示:rhTNF-α能明显提高HepG-2肝癌细胞TP水平的表达,且表现出剂量依赖性,随着rhTNF-α浓度增加TP蛋白表达增加,还能明显提高HepG-2肝癌细胞对 5-FU 前体药物的敏感性(P<0.05),5-FU 前体药物敏感性的增加与rhTNF-α上调TP水平呈正相关,相关系数 r为 0.679(P=0.001)。提示 rhTNF-α主要通过上调HepG-2肝癌细胞TP表达水平来增加其对5-FU前体药物的敏感性。但rhTNF-α上调TP酶蛋白的具体机制目前尚不十分清楚。有研究[11]发现TNF-α可以提高结肠癌细胞的TP表达,这一作用主要通过II型受体(TNF-αR2)而不是 I型受体来实现,TP活性的提高与TPmRNA的表达水平有关,R2受体在上调TP酶蛋白的表达中起了重要作用。
总之,适当剂量rhTNF-α能明显抑制HepG-2细胞生长,上调肿瘤细胞中TP的表达,增强肿瘤细胞5-FU前体药物的敏感性,但在体外也能增强肿瘤细胞的侵袭能力,其在体内是否能够增强肿瘤细胞的侵袭能力,促进肿瘤细胞的转移尚需进一步研究。本文研究为rhTNF-α与5-FU前体药联合应用于治疗肝细胞癌提供了实验室依据,相信rhTNF-α在抗肿瘤的应用中有更广阔的前景。
1 张思维,李连弟,鲁凤珠,等.中国1990-1992年原发性肝癌死亡调查分析.中华肿瘤杂志,1999,21:245-249.
2 吴孟超.原发性肝癌治疗的进展及展望.第二军医大学学报,2002,23:1-4.
3 杨莉萍,侯敢,黄迪南.尿激酶型纤溶酶原激活物介导的肿瘤靶向性重组人肿瘤坏死因子-α的生物活性.广东医学,2013,34:2447-2449.
4 Lu S,Xu W,Fan Z,etal.Overexpression of Smac/DIABLOin Hep-2 cell line:possible role in potentiating the sensitivity of chemotherapeutic drugs.Tumori,2010,96:310-315.
5 Bazzoni F,Beutler B.The tumor necrosis factor ligand and receptor families.NEngl JMed,1996,334:1717-1725.
6 Chen G,Goeddel DV.TNF-R1 signaling:a beautiful pathway.Sci-ence,2002,296:1634-1635.
7 Wang CY,Mayo MW,Korneluk RG,etal.NF-kappaB antiapoptosis:induction of TRAF1 and TRAF2 and c-IAP1 and c-IAP2 to suppresscaspase-8 activation.Science,1998,281:1680-1863.
8 牛朝诗,孙敬武,卞留贯.TNF-α抑制胶质瘤细胞增殖和诱导凋亡的研究.中国药理学通报,2000,16:205-207.
9 陈传萍,何群王,邵成.TNF-α对人肝癌细胞系CD15和CD15s含量及细胞侵袭性的影响.中国医科大学学报,2012,41:972-976.
10 de Lima VC,de Carvalho AF,Morato-Marques M,etal.TNF-alpha and melphalan modulateaspecific group of early expressed genes in a murinemelanomamodel.Cytokine,2013,62:217-225.
11 Zhu GH,Schwartz EL.Expression of the angiogenic factor thymidine phosphorylase in THP-1 monocytes:induction by autocrine tumor necrosis factor-alpha and inhibition by aspirin.Mol Pharmacol,2003,64:1251-1258.

