山楂酸对人肺癌细胞增殖与迁移及其诱导破骨细胞分化的调控作用机制研究
王霆 杨兴海 韩帅 魏海峰 吴志鹏 钱明 肖建如
山楂酸对人肺癌细胞增殖与迁移及其诱导破骨细胞分化的调控作用机制研究
王霆 杨兴海 韩帅 魏海峰 吴志鹏 钱明 肖建如
目的 研究山楂酸 ( maslinic acid,MA ) 对人肺癌细胞增殖、迁移和其诱导的破骨细胞分化的调控作用和可能的作用机制。方法 应用山楂酸处理肺癌细胞株,MTS 法检测细胞活性的抑制率;通过 Transwell 观察肺癌细胞的迁移;收集山楂酸刺激肺癌细胞后的培养基并观察其对破骨细胞分化的诱导作用;并通过 PCR 实验检测可能靶基因 mRNA 的水平改变。结果 山楂酸对正常肺上皮细胞 HBE 无明显抑制作用,但可显著抑制肺腺癌细胞 A549、PC9 和 H1299 的增殖和迁移,且抑制作用和药物浓度呈正相关;20 μmol / L 的山楂酸对 A549、PC9 和 H1299 细胞增殖的抑制率分别为 29%、58% 和 22%,而 40 μmol / L 的抑制率为 68%、82% 和 66%。同时山楂酸可显著抑制由 A549 细胞诱导的 BMM 细胞向破骨细胞的分化 ( P<0.001 );通过 PCR 实验,本研究结果显示山楂酸可抑制 NF-κb 通路下游 BCL2、MMP2 和 MMP9 的 mRNA 水平,并促进 BAX、CASP3 和 CASP8 等凋亡相关 mRNA 水平。结论 山楂酸可显著抑制肺癌细胞的增殖及迁移,并抑制由肺癌细胞诱导的破骨细胞分化,这种抑制作用可能是通过抑制 NF-κb 通路和激活线粒体凋亡通路实现的。
山楂酸;细胞运动;破骨细胞;细胞分化;肺肿瘤
肺癌是目前发病率最高的恶性肿瘤之一,并已成为男性致死人数最多及女性致死人数第二多的肿瘤[1]。肺癌的转移是造成治疗失败和患者死亡的首要原因,而骨是肺癌最常见的转移部位之一,约30%~40% 的进展期肺癌出现骨转移[2]。肺癌骨转移常导致骨痛、高钙血症、病理性骨折、脊髓压迫甚至瘫痪等并发症,加速患者的死亡进程[2-3]。然而由于缺乏典型临床症状,多数患者在确诊时已是中晚期,难以手术切除。虽然目前肺癌的化疗方案有多种,但其 5 年生存率仅有 30%~40%[4],因此,对肺癌化疗药物的进一步研究,特别是针对肺癌骨破坏相关药物的进一步研究,可以为肺癌的临床治疗提供新的思路。
山楂酸 ( maslinic acid,MA ) 是一种五环三萜酸,存在于如山楂、芥末、橄榄、石榴、红枣等多种天然植物中[5]。山楂酸具有抗炎[6]、抗氧化[7]、抗HIV[8]等诸多药理学作用,近期研究也表明在前列腺癌、结肠癌和膀胱癌等肿瘤中[9-11],山楂酸可促进肿瘤细胞的凋亡并抑制肿瘤细胞的侵袭,并且,山楂酸还可抑制由 RANKL 诱导的破骨细胞分化并进一步抑制骨质疏松[12],而其对于人体较高的安全性[13],使其成为一种可能的新的肿瘤化疗辅助药物。然而,目前山楂酸在肺癌中的研究仍十分有限,关于山楂酸对肿瘤细胞诱导的破骨细胞分化的研究也尚未有报道。本研究旨在探究山楂酸对肺腺癌细胞增殖、凋亡和迁移的调控作用,并探索其中可能的信号通路,为山楂酸在肺癌中的临床应用提供理论依据。
材料与方法
一、试剂和材料
DMEM 培养基、RPMI 1640 培养基和胎牛血清购自美国 GIBCO 公司;山楂酸购自大连美仑生物技术有限公司;TRAP 染色和 TRAP 活性试剂盒购自美国 Genmed 公司;MTS 试剂购自美国 Promega 公司;Transwell 小室购自美国 Corning 公司;C57BL / 6 小鼠购自第二军医大学动物实验中心;M-CSF 因子购自美国 Peprotech 公司;qPCR mix 购自北京全式金生物技术有限公司。
二、细胞培养
人肺腺癌细胞株 A549、PC9、H1299 和人肺上皮细胞株 HBE 均由上海长征医院转化实验中心提供。HBE、A549 和 H1299 细胞用含 10% 胎牛血清( FBS ) 的 DMEM 培养基,PC9 细胞用含 10% FBS 的RPMI 1640 培养基,均在 37 ℃,5% CO2条件下培养,取对数生长期的细胞用于后续实验。
三、山楂酸对肺腺癌细胞增殖影响的检测
调整细胞悬液浓度至 105个 / ml,于 96 孔板每孔加入细胞悬液 100 μl,培养 24 h 后吸去原培养基,每孔加入不同药物浓度的培养基 ( 0、5、10、20、30、40 μmol / L ),每个浓度设 6 个复孔,对照组加入 0.01% DMSO ( 山楂酸的溶剂 )。培养 48 h,每孔加入 MTS 试剂 20 μl,震荡混匀,培养 2 h,用酶标仪在波长 490 nm 处测定吸光度值。
四、山楂酸对 A549 细胞迁移影响的检测
调整细胞悬液浓度至 105个 / ml,于 Transwell小室上层加入细胞悬液 100 μl,下层加入 500 μl 含10% FBS 的培养基,培养 24 h、弃去上、下层培养基,上层加入含 10、20、40 μmol / L 山楂酸或含0.01% DMSO 的无血清培养基,下层加入相应药物浓度的含 10% FBS 的培养基,每个浓度设 3 个复孔。培养 48 h,弃去培养基,擦去上层细胞,PBS 洗涤2 遍,甲醛固定 30 min,风干 15 min,0.1% 结晶紫染色 20 min,PBS 洗 3 遍,风干,镜下观察并计数。每孔用 500 μl 33% 醋酸洗脱后,将洗脱液用酶标仪在波长 570 nm 处测定吸光度值。
五、骨髓来源巨噬细胞 ( bone marrow-derived macrophages,BMM )
提取 6 周龄 C57BL / 6 小鼠处死,75% 乙醇浸泡 5 min,分离并完整取出双侧股骨,在 75% 乙醇中浸泡骨头 5 min,PBS 浸泡 5 min,切断股骨两端,用 1 ml 注射器吸取 DMEM 培养基并将骨干中骨髓冲洗出,吹打混匀,并以滤网滤去细胞团,接种于 100 mm 培养皿中,加入 M-CSF 使其浓度为5 nmol / L,培养 12 h 后,取上清离心后将细胞接种于 24 孔板,加入 M-CSF 使其浓度为 10 nmol / L,培养 48 h 并换液后用于后续实验。
六、山楂酸对 A549 诱导的破骨细胞分化影响的检测
将 A549 细胞接种于 100 mm 培养皿后,培养至约 70% 的密度,换液后加入无血清培养基,实验组加入山楂酸至 10 μmol / L,对照组加入 0.01% DMSO,培养 48 h,取上清离心后加入 BMM 细胞培养基,培养 5 天,参照说明书完成细胞的 TRAP 染色和 TRAP 活性测试。
七、山楂酸对相关信号通路影响的检测
将 A549 细胞接种于 6 孔板中,培养 24 h 弃去原培养基,加入含 5、10、20 μmol / L 山楂酸或含0.01% DMSO 的培养基,培养 48 h,用 TRIZOL 法提取细胞 RNA,通过 qRT-PCR 检测 B 淋巴细胞瘤-2基因 ( b-cell lymphoma-2,BCL2 )、基质金属蛋白酶 2 ( matrix metalloproteinase 2,MMP2 )、基质金属蛋白酶 9 ( matrix metalloproteinase 9,MMP9 )、Bcl-2相关 X 蛋白 ( Bcl-2 Associated X Protein,BAX )、胱天蛋白酶 3 ( caspase 3,CASP3 )、胱天蛋白酶 8 ( caspase 8,CASP8 ) 的 mRNA 水平 ( 引物序列和退火温度见表 1 )。
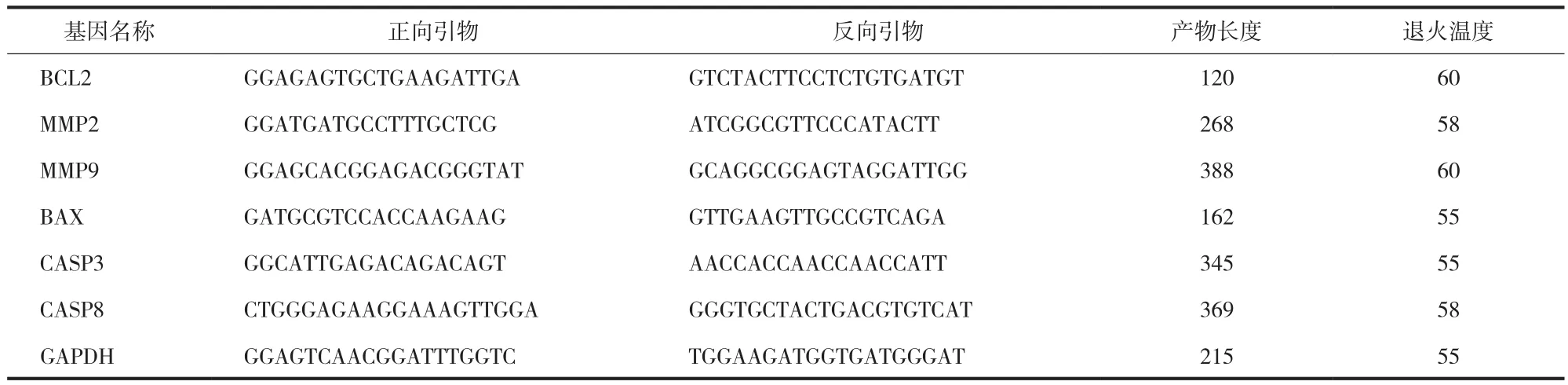
表 1 本实验用的 PCR 引物Tab.1 The primers used in this study
八、统计学分析
应用 SPSS 19.0 软件对实验数据进行分析,各组间比较采用独立样本 t 检验,P<0.05 为差异有统计学意义。
结 果
一、山楂酸对肺腺癌细胞活性的影响
对 A549 细胞用不同浓度的山楂酸刺激后,镜下观察发现,山楂酸刺激后的 A549 细胞密度明显减少,且可见部分细胞变圆、变小、漂浮等表现( 图 1 )。通过 MTS 实验,本研究发现山楂酸对正常肺上皮细胞 HBE 无明显作用 ( 图 2a ),但对肺腺癌细胞 A549、PC9 和 H1299 的增殖有明显的抑制作用,且这种作用与其剂量呈正相关 ( 图 2b~d )。相较于空白组,山楂酸浓度达到 10 μmol / L 时对 A549 ( P<0.001 ) 和 PC9 ( P=0.002 ) 细胞有明显抑制作用,达到 20 μmol / L 时对 H1299 细胞有显著抑制作用 ( P<0.001 )。20 μmol / L 的山楂酸对 A549、PC9 和 H1299 细胞增殖的抑制率分别为 29%、58% 和 22%,而 40 μmol / L 的山楂酸对 A549、PC9和 H1299 细胞增殖的抑制率分别为 68%、82% 和66%。
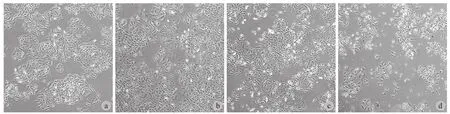
图 1 光镜下 ( ×40 ) 不同浓度的山楂酸刺激 A549 细胞后 48 h 的表现 a:对照;b:5 μmol / L 山楂酸;c:10 μmol / L 山楂酸;d:20 μmol / L 山楂酸Fig.1 The light microscopic ( ×40 ) showings of A549 cells after the stimulation of MA a: Control group; b: 5 μmol / L MA; c: 10 μmol / L MA; d: 20 μmol / L MA
二、山楂酸对 A549 细胞迁移的影响
利用 Transwell 小室,药物刺激 48 h,通过结晶紫染色并测量了细胞数和吸光度。结果表明,在正常情况下,A549 细胞可从 Transwell 小室上层迁移至下层,而加入山楂酸后,可显著抑制 A549 细胞的迁移,且这种抑制作用与山楂酸的浓度呈正相关,20 μmol / L 的山楂酸减少了 79.6% 的迁移细胞数,而40 μmol / L 的山楂酸减少了约 97.9% 的迁移细胞数( 图 3、图 4a ),可见相同浓度的山楂酸对迁移细胞数的抑制明显高于山楂酸对 A549 细胞增殖的抑制。利用醋酸将结晶紫洗脱并测量吸光度后,发现山楂酸作用后吸光度的改变和细胞数的改变呈相同趋势( 图 4b )。
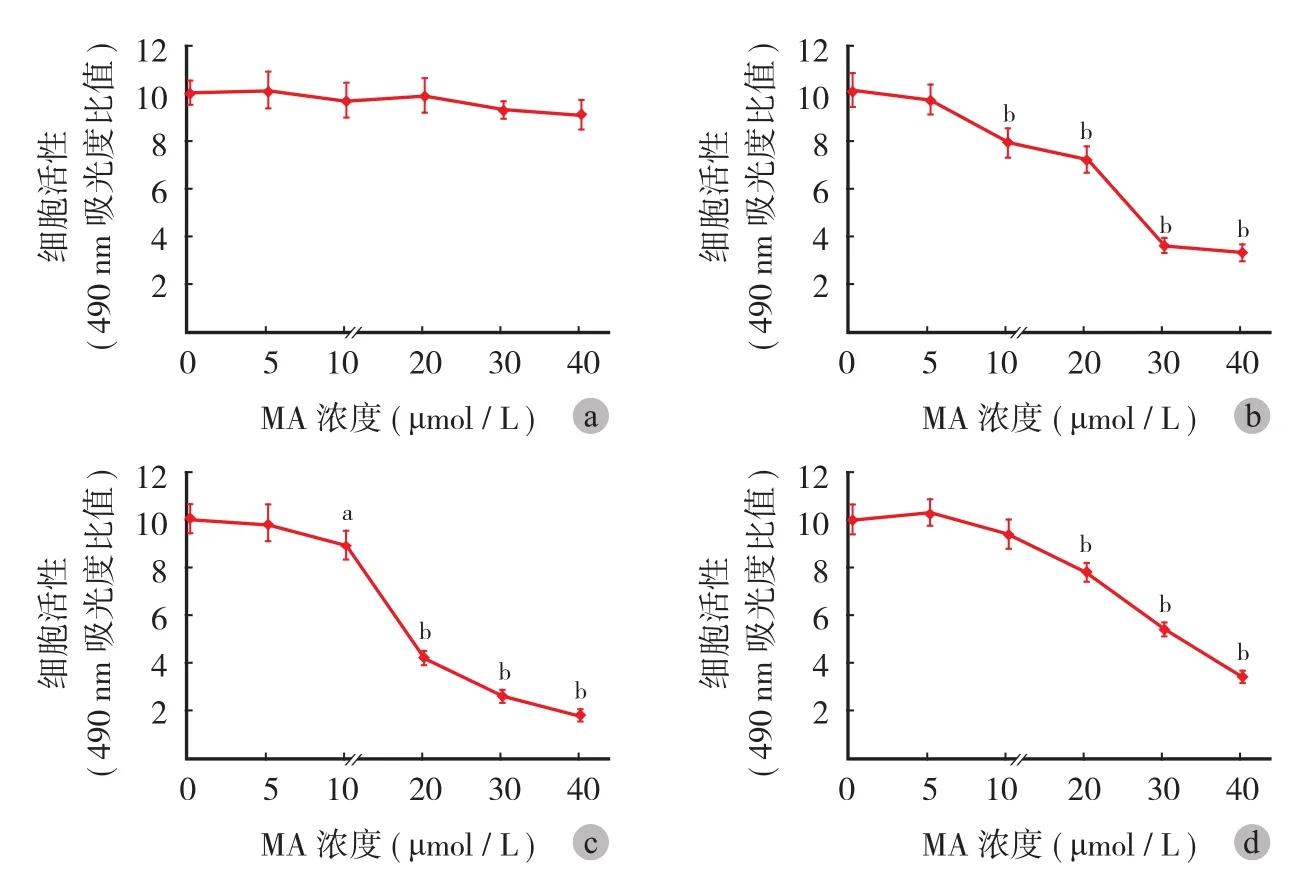
图 2 山楂酸对 HBE ( a )、A549 ( b )、PC9 ( c ) 和 H1299 ( d ) 细胞活性的影响。纵坐标轴为实验组和对照组的比值 ( 注:aP < 0.05,bP < 0.001 )Fig.2 The effects of MA in cellular activities of HBE ( a ), A549 ( b ), PC9 ( c ) and H1299 ( d ) cells. Data was shown in the formation of the ratio between experimental group and control group (aMeans P<0.05,bMeans P<0.001 )
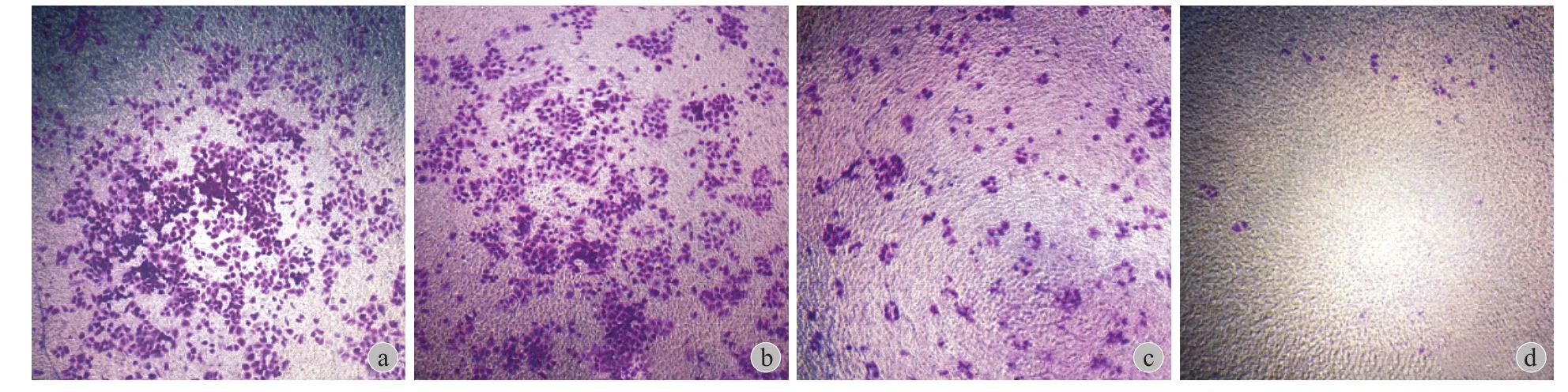
图 3 光镜下 A549 细胞的 Transwell 结晶紫染色结果 ( 结晶紫染色 ×40 ) a:对照;b:10 μmol / L 山楂酸;c:20 μmol / L 山楂酸;d:40 μmol / L 山楂酸Fig.3 The crystal violet staining of the transwell experiment of A549 cells under light microscopic ( ×40 ) a: Control group; b: 10 μmol / L MA; c: 20 μmol / L MA; d: 40 μmol / L MA
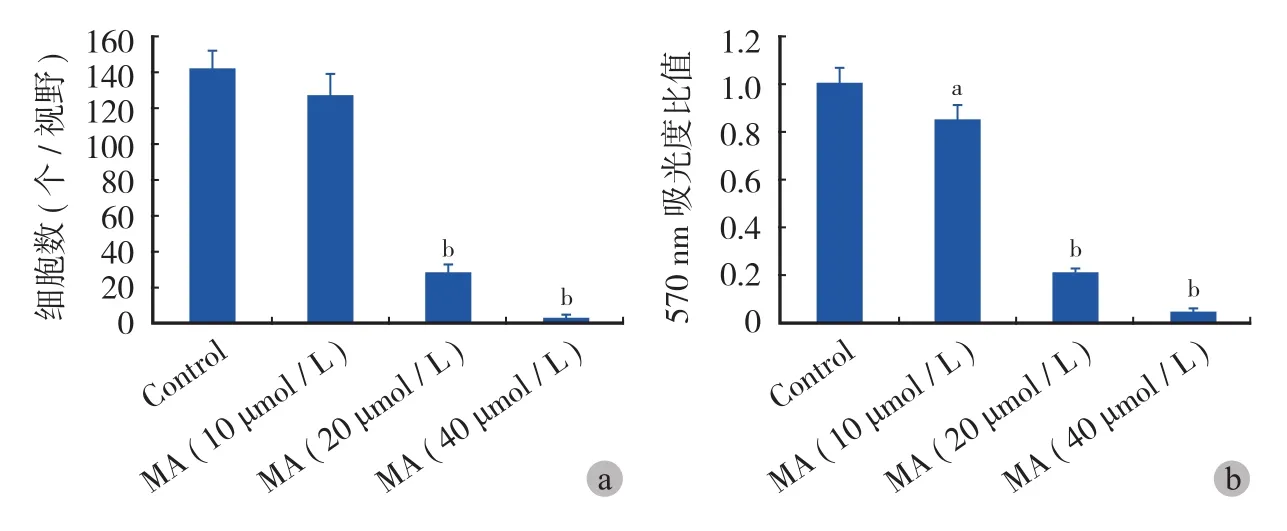
图 4 山楂酸对 A549 细胞迁移的影响 a:平均每高倍镜视野下的细胞数;b:醋酸洗脱并测量吸光度的统计结果 ( 注:aP < 0.05,bP <0.001 )Fig.4 The effects of MA in A549 cell migration a: The average cell number per high magnification; b: The absorbance detection after acetic acid elution. Data was shown in the formation of the ratio between experimental group and control group (aMeans P<0.05,bMeans P<0.001 )
三、山楂酸对 A549 诱导的破骨细胞分化的抑制作用
通过 10 μmol / L 的山楂酸刺激 A549 细胞 48 h,将其培养基用于 BMM 细胞条件培养,TRAP 染色,镜下观察破骨细胞分化情况。TRAP 染色阳性的多核巨细胞被认为是破骨细胞。结果发现正常 A549 细胞的培养上清可明显诱导 BMM 细胞向破骨细胞分化,而 10 μmol / L 的山楂酸显著抑制了 BMM 细胞向多核巨细胞的分化 ( 图 5 )。随机抽取 5 个高倍镜视野 ( ×100 ) 并计数 TRAP 阳性的多核巨细胞数目,发现 10 μmol / L 的山楂酸抑制了由 A549 诱导的约72% 的破骨细胞分化 ( 图 6a )。通过 TRAP 活性试剂盒检测破骨细胞活性并在 570 nm 处测吸光度后,结果表明 10 μmol / L 的山楂酸抑制了由 A549 诱导的约84% 的破骨细胞活性 ( 图 6b )。这些结果说明山楂酸可显著抑制由肺癌细胞诱导的破骨细胞分化。
四、山楂酸对 BCL2、MMP2 和 MMP9 的抑制作用研究
实验结果表明山楂酸可显著抑制 BCL2、MMP2和 MMP9 的 mRNA 水平,且这种抑制作用与山楂酸的浓度呈正相关 ( 图 7 )。进一步通过 qRT-PCR 检测,本研究发现 5 μmol / L 的山楂酸即可显著抑制BCL2 ( P=0.001 )、MMP2 ( P=0.032 ) 和 MMP9 ( P=0.008 ) 的 mRNA 水平 ( P<0.05 ),而 20 μmol / L 的山楂酸对 BCL2、MMP2 和 MMP9 mRNA 水平的抑制率高达 95%、65% 和 78% ( 图 8a~c )。
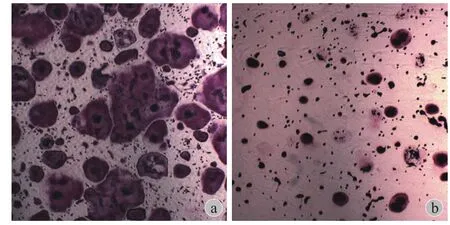
图 5 光镜下 A549 细胞对破骨细胞分化的诱导作用 ( TRAP 染色×40 ) a:对照;b:10 μmol / L 山楂酸Fig.5 The light microscopic ( ×40 ) showings of osteoclastogenesis induced by A549 cells a: Control group; b: 10 μmol / L MA
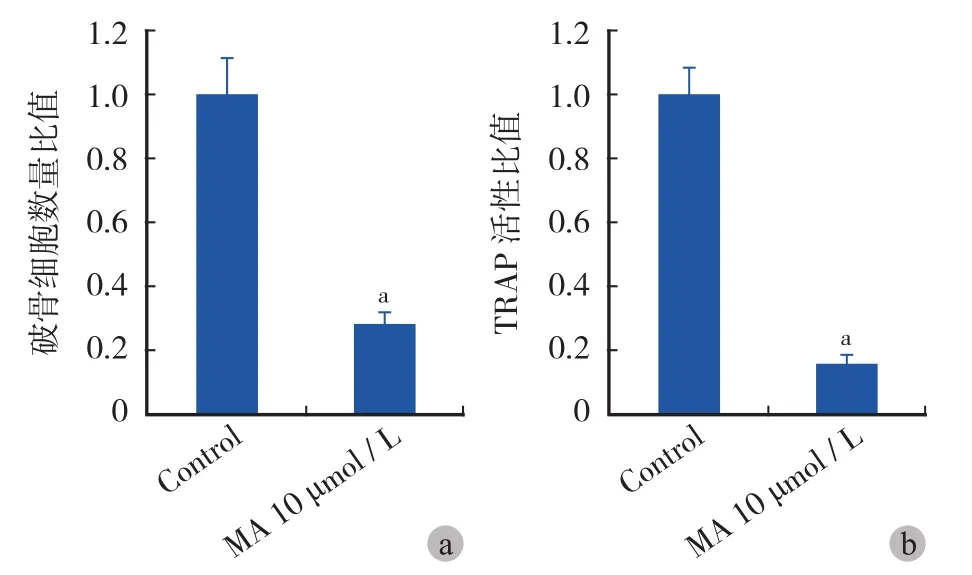
图 6 山楂酸对 A549 细胞诱导破骨细胞分化的抑制作用 a:平均每高倍视野下的破骨细胞数量对比;b:TRAP 活性对比 ( 注:aP < 0.001 )Fig.6 MA inhibited osteoclatsogenesis induced by A549 cells a: The average osteoclasts number per high magnification; b: The TRAP activity comparison. Data was shown in the formation of the ratio between experimental group and control group (aMeans P<0.001 )
五、山楂酸对 BAX、CASP3 和 CASP8 的促进作用研究
本研究结果显示山楂酸可显著促进 BAX、CASP3 和 CASP8 的 mRNA 水平,且这种促进作用与药物浓度呈正相关性 ( 图 7 )。进一步通过 qRT-PCR检测,发现 5 μmol / L 的山楂酸即可显著促进 BAX ( P=0.002 )、CASP3 ( P=0.046 ) 和 CASP8 ( P=0.019 )的 mRNA 水平,而 20 μmol / L 的山楂酸对 BAX、CASP3 和 CASP8 mRNA 水平的促进率为 262%、49%和 61% ( 图 8d~f )。
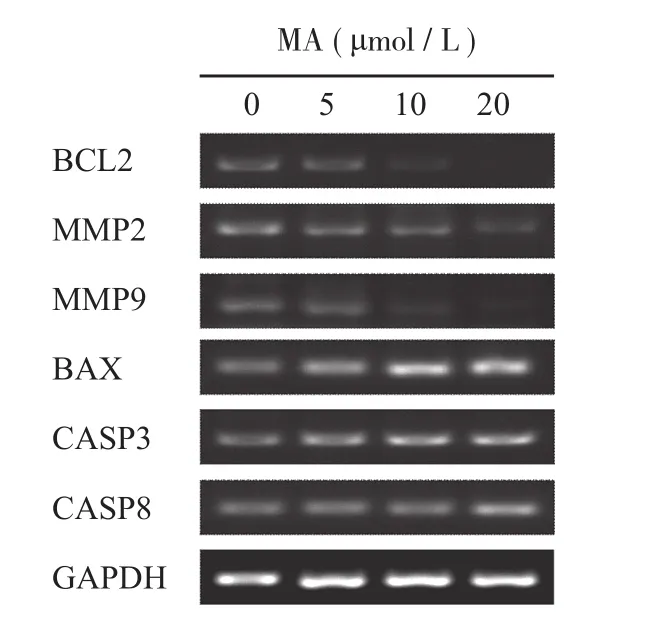
图 7 山楂酸对下游靶基因 mRNA 水平调控的 PCR 结果Fig.7 The PCR results of the downstream of MA in A549 cells
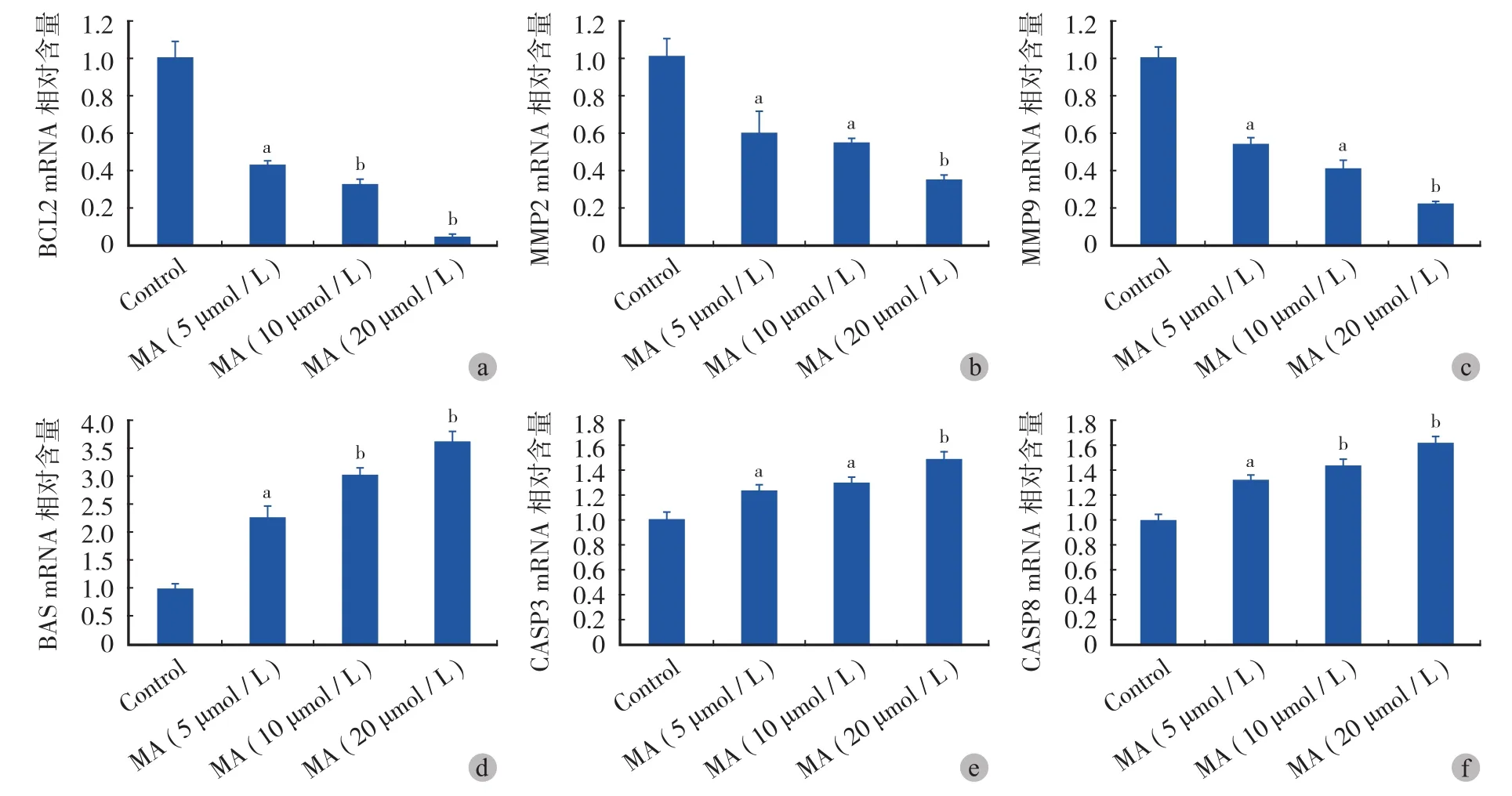
图 8 山楂酸对 BCL2 ( a )、MMP2 ( b )、MMP9 ( c )、BAX ( d )、CASP3 ( e ) 和 CASP8 ( f ) 的抑制作用。纵坐标轴为实验组和对照组的比值 ( 注:aP < 0.05,bP < 0.001 )Fig.8 The inhibition role of MA in the mRNA level of BCL2 ( a ), MMP2 ( b ), MMP9 ( c ), BAX ( d ), CASP3 ( e ) and CASP8 ( f ). Data was shown in the formation of the ratio between experimental group and control group (aMeans P<0.05,bMeans P<0.001 )
讨 论
已有的研究表明山楂酸可以通过诱导肿瘤细胞凋亡[11,14]、抑制肿瘤细胞 G1 期向 S 期的转化[15]、抑制肿瘤细胞迁移和侵袭[9]等多方面发挥抑制肿瘤的作用。然而,目前关于山楂酸对肺癌的研究仍十分有限,仅有 1 例关于山楂酸促进 A549 细胞凋亡的报道[16]。本研究发现山楂酸对正常肺上皮细胞 HBE无明显抑制作用,但可显著抑制肺腺癌细胞 A549、PC9 和 H1299 的增殖和迁移;并且,通过 A549 细胞与 BMM 细胞的条件共培养,我们发现山楂酸可显著抑制由 A549 细胞诱导的破骨细胞分化。进一步通过qRT-PCR 分析发现,山楂酸可抑制 BCL2、MMP2 和MMP9 的 mRNA 水平并促进 BAX、CASP3 和 CASP8的 mRNA 水平。
NF-κb 通路是细胞增殖和侵袭过程中的关键通路,在肿瘤的增殖、凋亡、侵袭和骨破坏等多个方面都发挥重要作用[12-13]。在胰腺癌、胆囊癌等肿瘤中山楂酸可通过抑制 NF-κb 通路,降低其下游MMP2、MMP9、BCL2 和细胞周期蛋白 D1 ( Cyclin D1 ) 等因子的表达,从而抑制肿瘤细胞的增殖和侵袭[12,16],但山楂酸对肺癌的作用机制仍不明确。而 MMP2、MMP9 也已被证实在肺癌细胞的迁移和侵袭过程中发挥重要作用[17-18]。本研究结果显示山楂酸可显著抑制肺癌细胞的增殖和迁移,并可抑制MMP2、MMP9 和 BCL2 的 mRNA 水平,这说明在肺癌细胞中山楂酸可能可通过抑制 NF-κb 通路发挥作用抑制肺癌细胞的增殖和迁移。
有学者认为:NF-κb 通路在破骨细胞的分化中也发挥重要作用,MMP2 和 MMP9 均可促进破骨细胞的分化[19-20]。已有的研究也表明山楂酸可抑制RANKL 诱导的破骨细胞分化和骨质疏松[12]。肿瘤细胞诱导的破骨细胞分化和骨破坏是肿瘤骨转移灶发生的重要环节,然而,目前尚未有关于山楂酸调控肿瘤细胞诱导的破骨细胞分化的研究报道。本研究通过 A549 细胞与 BMM 细胞的条件共培养,首次发现山楂酸可显著抑制由肺癌细胞引起的破骨细胞分化,并且,这种抑制作用可能是通过调控 NF-κb 通路实现的。因此,本研究也说明山楂酸可能可以用于肺癌骨转移的治疗。
线粒体凋亡通路是最经典的细胞凋亡通路之一,它的失活在肿瘤的发生和转移中都发挥重要作用,并且该通路也是许多化疗药物的治疗靶点[21]。本研究结果显示山楂酸可显著抑制多种肺癌细胞的活性,为研究山楂酸是否是通过诱导肺癌细胞凋亡从而抑制其活性,笔者通过 PCR 检测了山楂酸刺激 A549 细胞后细胞凋亡相关因子 BAX、CASP3 和CASP8 的 mRNA 水平,而 BAX、CASP3 和 CASP8均是线粒体凋亡通路中的关键蛋白。已有研究证实在贲门癌、结肠癌等肿瘤中山楂酸均可通过激活线粒体凋亡通路来促进肿瘤细胞的凋亡[22-23]。本研究进一步证实了在肺癌细胞中,山楂酸可通过提高BAX、CASP3 和 CASP8 的 mRNA水平,这说明山楂酸可能通过激活线粒体凋亡通路并诱导细胞凋亡从而抑制肺癌细胞的活性。
综上所述,本研究结果显示:山楂酸可显著抑制肺癌细胞的增殖和迁移,并抑制由肺癌细胞诱导的破骨细胞分化,而山楂酸对 NF-κb 通路的抑制作用和对线粒体凋亡通路的促进作用可能是其在肺癌细胞中发挥作用的重要原因。这些研究结果表明山楂酸可能可以作为肺癌,特别是肺癌骨转移新的治疗药物。
[1] Liu J, Wan L, Lu K, et al. The long noncoding rna meg3 contributes to cisplatin resistance of human lung adenocarcinoma. PLoS One, 2015, 10(5):e0114586.
[2] Coleman RE. Metastatic bone disease: clinical features, pathophysiology and treatment strategies. Cancer Treat Rev, 2001, 27(3):165-176.
[3] Sciubba DM, Nguyen T, Gokaslan ZL. Solitary vertebral metastasis. Orthop Clin North Am, 2009, 40(1):145-54, viii.
[4] Woodard GA, Jablons DM. The latest in surgical management of stage iiia non-small cell lung cancer: video-assisted thoracic surgery and tumor molecular profiling. Am Soc Clin Oncol Educ Book, 2015, 35:e435-441.
[5] Yin MC, Lin MC, Mong MC, et al. Bioavailability, distribution, and antioxidative effects of selected triterpenes in mice. J Agric Food Chem, 2012, 60(31):7697-7701.
[6] Huang L, Guan T, Qian Y, et al. Anti-inflammatory effects of maslinic acid, a natural triterpene, in cultured cortical astrocytes via suppression of nuclear factor-kappa B. Eur J Pharmacol, 2011, 672(1-3):169-174.
[7] Mkhwanazi BN, Serumula MR, Myburg RB, et al. Antioxidant effects of maslinic acid in livers, hearts and kidneys of streptozotocin-induced diabetic rats: effects on kidney function. Ren Fail, 2014, 36(3):419-431.
[8] Parra A, Rivas F, Lopez PE, et al. Solution- and solid-phase synthesis and anti-HIV activity of maslinic acid derivatives containing amino acids and peptides. Bioorg Med Chem, 2009, 17(3):1139-1145.
[9] Park SY, Nho CW, Kwon DY, et al. Maslinic acid inhibits the metastatic capacity of DU145 human prostate cancer cells: possible mediation via hypoxia-inducible factor-1α signalling. Br J Nutr, 2013, 109(2):210-222.
[10] Rufino-Palomares EE, Reyes-Zurita FJ, García-Salguero L, et al. Maslinic acid, a triterpenic anti-tumoural agent, interferes with cytoskeleton protein expression in HT29 human coloncancer cells. J Proteomics, 2013, 83:15-25.
[11] Zhang S, Ding D, Zhang X, et al. Maslinic acid induced apoptosis in bladder cancer cells through activating p38 MAPK signaling pathway. Mol Cell Biochem, 2014, 392(1-2):281-287.
[12] Li C, Yang Z, Li Z, et al. Maslinic acid suppresses osteoclastogenesis and prevents ovariectomy-induced bone loss by regulating RANKL-mediated NF-κB and MAPK signaling pathways. J Bone Miner Res, 2011, 26(3):644-656.
[13] Li C, Yang Z, Zhai C, et al. Maslinic acid potentiates the antitumor activity of tumor necrosis factor alpha by inhibiting NF-kappaB signaling pathway. Mol Cancer, 2010, 9:73.
[14] Yu Y, Wang J, Xia N, et al. Maslinic acid potentiates the antitumor activities of gemcitabine in vitro and in vivo by inhibiting NF-κB-mediated survival signaling pathways in human gallbladder cancer cells. Oncol Rep, 2015, 33(4):1683-1690.
[15] Reyes-Zurita FJ, Pachón-Peña G, Lizárraga D, et al. The natural triterpene maslinic acid induces apoptosis in HT29 colon cancer cells by a JNK-p53-dependent mechanism. BMC Cancer, 2011, 11:154.
[16] Hsia TC, Liu WH, Qiu WW, et al. Maslinic acid induces mitochondrial apoptosis and suppresses HIF-1α expression in A549 lung cancer cells under normoxic and hypoxic conditions. Molecules, 2014, 19(12):19892-19906.
[17] Kuo HY, Huang YS, Tseng CH, et al. PML represses lung cancer metastasis by suppressing the nuclear EGFR-mediated transcriptional activation of MMP2. Cell Cycle, 2014, 13(19): 3132-3142.
[18] Zhao M, Gao Y, Wang L, et al. Overexpression of integrin-linked kinase promotes lung cancer cell migration and invasion via NF-κB-mediated upregulation of matrix metalloproteinase-9. Int J Med Sci, 2013, 10(8):995-1002.
[19] Dutta A, Li J, Lu H, et al. Integrin αvβ6 promotes an osteolytic program in cancer cells by upregulating MMP2. Cancer Res, 2014, 74(5):1598-1608.
[20] Chen D, Zhang X, Guo Y, et al. MMP-9 inhibition suppresses wear debris-induced inflammatory osteolysis through downregulation of RANK/RANKL in a murine osteolysis model. Int J Mol Med, 2012, 30(6):1417-1423.
[21] Sarosiek KA, Ni Chonghaile T, Letai A. Mitochondria: gatekeepers of response to chemotherapy. Trends Cell Biol, 2013, 23(12):612-619.
[22] Chang T, Li X, Chen X, et al. Maslinic acid activates mitochondria-dependent apoptotic pathway in cardiac carcinoma. Clin Invest Med, 2014, 37(4):E217-224.
[23] Reyes-Zurita FJ, Rufino-Palomares EE, Lupiáñez JA, et al. Maslinic acid, a natural triterpene from Olea europaea L, induces apoptosis in HT29 human colon-cancer cells via the mitochondrial apoptotic pathway. Cancer Lett, 2009, 273(1):44-54.
( 本文编辑:李贵存 )
Maslinic acid regulates lung cancer cell proliferation, migration and induction to osteoclastogenesis: an in vitro study and a mechanism research
WANG Ting, YANG Xing-hai, HAN Shuai, WEI Hai-feng, WU Zhi-peng, QIAN Ming, XIAO Jian-ru.
Department of Bone Tumor Surgery, Changzheng Hospital, Second Military Medical University, Shanghai, 200003, PRC Corresponding author: YANG Xing-hai, Email: cnspineyang@163.com
Objective To investigate the effects of maslinic acid ( MA ) on lung cancer cell proliferation, migration and the induction role to osteoclasstogenesis, and further explore the possible molecular mechanisms of MA in lung cancer cells. Methods Lung cancer cell lines were treated with MA. Then, the cell proliferation rates were detected by MTS assay, while the migration of the tumor cell was examined by transwell assay. The condition medium from A549 cells stimulated by MA was collected, and then was used in BMM culture to observe the osteoclastogenesis. The mRNA levels of the possible targets of MA were detected by PCR assay. Results MA showed no significant inhibition on HBE cells, however, it significantly suppressed the proliferation and migration of A549, PC9 and H1299 cells with a positive correlation of the MA concentration. 20 μmol / L of MA suppressed the proliferation of A549, PC9 and H1299 cell proliferation with ratios of 29%, 58% and 22%, while the inhibition ratios of 40 μmol / L MA were 68%, 82% and 66% respectively. Furthermore, MA obviously inhibited osteoclast differentiation induced by A549 cells ( P<0.001 ). In addition, It was found that MA decreased the mRNA level of BCL2, MMP2 and MMP9 which were the downstream of NF-κb pathway, while it increased the mRNA level of BAX, CASP3 and CASP8 which were the key components of the mitochondrial apoptotic pathway. Conclusions MA can significantly suppress proliferation and migration of lung cancer cells, as well as the osteoclastogenesis induced by lung cancer cells. Roles of MA in lung cancer cells are possibly achieved through the NF-κb pathway and the mitochondrial apoptotic pathway.
Maslinic acid; Cell Movement; Osteoclasts; Cell differentiation; Lung neoplasms
10.3969/j.issn.2095-252X.2015.09.012
R734.2
上海市自然科学基金面上项目 ( STCSM,12ZR1439200 );上海市优秀青年医学人才培养计划 ( XYQ2013099 )
200003 上海,第二军医大学附属长征医院骨肿瘤外科
杨兴海,Email: cnspineyang@163.com
2015-06-03 )

